Введение
Атеросклеротическое поражение прецеребральных артерий является одной из главных причин развития как хронических, так и острых форм мозгового кровообращения [5]. При длительно существующем окклюзионно-стенотическом процессе может возникать дискоординация тонуса сосудов головного мозга с неизбежным изменением параметров ауторегуляции.
Оперативные вмешательства, выполняемые таким больным как на сосудах головного мозга, так и на артериях других органов (коронарных, почечных, аорте, артериях нижних конечностей) с целью устранить гемодинамически значимый стеноз, сами могут приводить к колебаниям перфузионного давления не только интраоперационно, но и в послеоперационном периоде с риском возникновения гемодинамического нарушения мозгового кровообращения.
В основе развития гемодинамического нарушения мозгового крово-обращения лежит срыв функций сосудистой системы головного мозга – ауторегуляции мозгового кровообращения, способствующей минимизации отклонений гемодинамического и биохимического гомеостаза при различных физиологических и патофизиологических состояниях [7, 20]. Кроме этого существует еще один механизм повреждения клеток головного мозга при выполнении каротидной эндартерэктомии (КЭАЭ) или стентирования сонных артерий – реперфузионный синдром, характерный для всех органов при восстановлении артериального кровотока (поперечно-полосатая мускулатура конечностей, миокард и др.). Особенная опасность реперфузии при операции на сонных артериях заключается в отсутствии возможности увеличения необходимого пространства полости черепа при неизбежно возникающем отеке головного мозга. При нарушении ауторегуляции мозгового кровообращения реперфузия способна приводить не только к развитию ишемических, но и геморрагических очагов в веществе головного мозга.
Наибольший опыт борьбы с феноменом ишемии-реперфузии накоплен в кардиохирургии, где до реконструктивной операции производят различные варианты подготовки кардиомиоцитов к восстановлению артериального кровотока – прекондиционирование [2]. Пионерской при этом признается экспериментальная работа C.E. Murry и соавт. (1986), в которой авторы выполняли ишемическое прекондиционирование путем кратковременного пережатия коронарных артерий, что способствовало большей устойчивости кардиомиоцитов к последующей гипоксии [26]. В последующем такой вариант ишемического прекондиционирования был описан в некоторых работах применительно к клинической практике [27], а также предложены некоторые лекарственные средства, способные вызывать схожие эндогенные эффекты (аденозин, никорандил) [17, 21]. Следует сказать, что механическое ишемическое прекондиционирование (временное пережатие артерий головного мозга) трудновыполнимо в хирургическом лечении сосудисто-мозговой недостаточности. Кроме этого с учетом возможности развития отека головного мозга при реперфузии важно не только повышать устойчивость нейронов к гипоксии, что возможно сделать путем классического ишемического прекондиционирования, но и уменьшать проявления повреждающего на них действия атомарного кислорода при восстановлении артериального кровотока. В связи с этим оправданно применение второго вида прекондиционирования – неишемического, при котором устойчивость головного мозга к ишемии возрастает в результате предварительного воздействия различных индукторов неишемической природы, например фармакологических агентов с нейропротективными свойствами. Целью настоящей работы стала оценка возможности фармакологического прекондиционирования препаратом Актовегин при хирургическом лечении пациентов с гемодинамически значимыми стенозами прецеребральных сосудов.
Материал и методы
В основу работы положены результаты хирургического лечения 80 пациентов (14 женщин и 66 мужчин в возрасте от 51 года до 84 лет), распределенных в две однородные группы в зависимости от тактики лечения.
Группу 1 составили 40 больных с гемодинамически значимым (более 70%) стенозом внутренней сонной артерии (подгруппа 1А – с односторонним поражением, подгруппа 1Б – с двусторонним гемодинамически значимым поражением). Пациенты этой группы были оперированы вскоре после поступления в стационар без применения предоперационного фармакологического прекондиционирования. Группа 2 также была представлена 40 пациентами с гемодинамически значимым (более 70%) стенозом внутренней сонной артерии (подгруппа 2А – с односторонним поражением, подгруппа 2Б – с двусторонним гемодинамически значимым поражением), которым перед хирургическим вмешательством проведено прекондиционирование депротеинизированным гемодериватом (Актовегин) в дозе 1200 мг/сут первые 10 дней внутривенно капельно, далее на амбулаторном этапе терапия продолжалась в таблетированной форме (по 400 мг три раза в сутки) сроком до одного месяца.
Степень сосудисто-мозговой недостаточности у пациентов, включенных в исследование, варьировалась от I до III по классификации А.В. Покровского. Больные IV степенью ишемии головного мозга (т.е. перенесшие острое нарушение мозгового кровообращения), а также лица с декомпенсированным сахарным диабетом и злокачественным характером артериальной гипертензии не включались. Обе группы пациентов были полностью однородны по возрасту, характеру сопутствующей патологии и степени поражения сонных артерий.
Всем пациентам выполнялась односторонняя эверсионная КЭАЭ. Больные, которым в ходе интраоперационного компресионного теста общей сонной артерии выставлялись показания к проведению операции с временным шунтом, исключались из исследования для сохранения однородности групп и снижения влияния вмешивающихся факторов на результаты работы.
Пациентам обеих групп проведены стандартные методы исследования, определившие показания к КЭАЭ и операционный риск (ультразвуковое ангиосканирование с допплерографией брахиоцефальных артерий, при необходимости – КТ-ангиография, ЭХО-кардиография, консультации кардиолога, невролога и др.). Кроме того, оценивались интенсивность кровоснабжения головного мозга с помощью однофотонной эмиссионной компьютерной томографии (ОФЭКТ) перфузии головного мозга с радиофармпрепаратом Теоксим [3] и состояние когнитивных функций (КФ) с использованием краткой шкалы оценки психического статуса (MMSE – Mini Mental State Examination).
Показатели перфузионной сцинтиграфии головного мозга и КФ больных в группе 1 оценивались перед операцией, на 7-е сутки после операции (перед выпиской из стационара) и через 6 месяцев. В группе 2 – до проведения фармакологического прекондиционирования, после его окончания (непосредственно перед операцией), на 7-е сутки после операции (перед выпиской из стационара) и через 6 месяцев. Кроме этого до операции и на 1–2-е сутки после КЭАЭ пациентам обеих групп выполняли магнитно-резонансную томографию (МРТ) головного мозга в режиме диффузионно-взвешенных изображений (ДВИ) для обнаружения ишемических очагов.
Для статистической обработки данных применялся пакет программ Statistica 8.0. Использовались U-критерий Манна–Уитни и критерий Вилкоксона.
Результаты
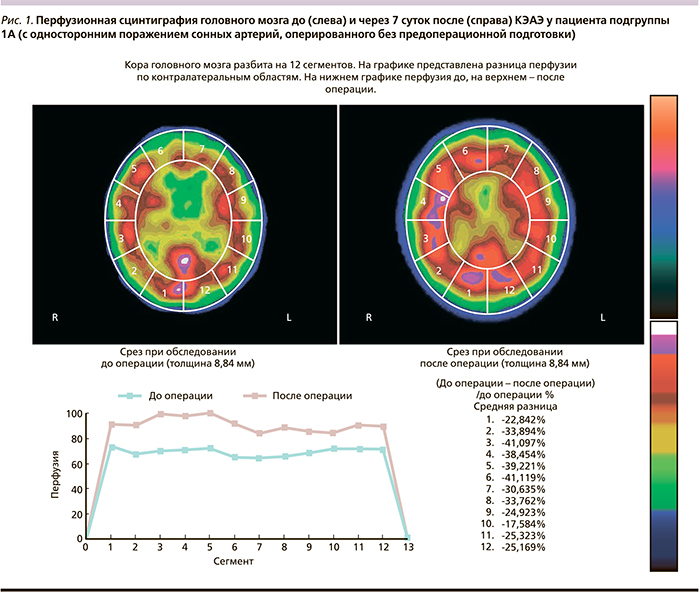
Исходно у пациентов обеих групп до лечения, по данным перфузионной сцинтиграфии, были выявлены достоверные признаки нарушения кровоснабжения головного мозга, более выраженные при двустороннем гемодинамически значимом поражении (табл. 1, 2).
При этом степень нарушения перфузии в группах достоверно не различалась. У 26 (33%) пациентов виллизиев круг был не замкнут, однако это мало отражалось на результатах перфузионной сцинтиграфии головного мозга. Так, при одностороннем поражении сонных артерий мы выявили достоверное снижение накопления радиофармпрепарата преимущественно на стороне поражения вне зависимости от функциональной полноценности виллизиева круга. При двустороннем поражении сонных артерий наблюдалось диффузное снижение перфузии коры головного мозга.
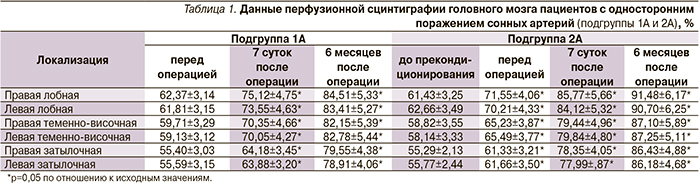
При анализе динамики кровоснабжения головного мозга в процессе хирургического лечения пациентов подгруппы 1А (с односторонним поражением, оперированных без подготовки) мы выявили достоверное (p<0,05) увеличение перфузии головного мозга через 7 суток на 21% и через 6 месяцев на 35% после КЭАЭ (табл. 1, рис. 1). У больных подгруппы 2А после курса предоперационной подготовки (фармакологического прекондиционирования) мы обнаружили достоверное (p<0,05) увеличение перфузии головного мозга на 16% по сравнению с исходным уровнем. Через 7 суток и 6 месяцев эти показатели улучшились на 39 и 49% соответственно (p<0,05, табл. 1, рис. 2). Важно отметить, что лучшую положительную динамику в обеих группах мы получили в лобных долях, несколько меньшую – в теменно-височных и еще меньшую – в затылочных (табл. 1).
При анализе результатов пациентов с двусторонним поражением сонных артерий (подгруппа 1Б) увеличение перфузии головного мозга на стороне операции через 7 суток составило 18% (p<0,05), через 6 месяцев – 29% (p<0,05). Результаты КЭАЭ у больных подгруппы 2Б показали, что предоперационная подготовка позволила увеличить перфузию головного мозга на 13% (p>0,05), что в дальнейшем сказалось на результатах непосредственно хирургического лечения – через 7 суток после операции кровоснабжение головного мозга увеличилось на 27% (p<0,05), а через 6 месяцев – на 40% (p<0,05).
Ни в одном из случаев после хирургического лечения не наблюдалось осложнений в виде острого нарушения мозгового кровообращения, однако при контрольной МРТ в режиме ДВИ у ряда больных было обнаружено появление новых ишемических очагов без какой-либо очаговой симптоматики. Как правило, они были представлены небольшими размерами (от 1 до 21 мм), локализовались как на стороне операции, так и контралатерально.
В основном они выявлялись в области коры и субкортикальных отделах, в единичных случаях – в подкорковых ядрах и белом веществе, у некоторых пациентов наблюдалась сочетанная локализация. Поскольку данные образования не привели к появлению очаговой неврологической симптоматики, их можно расценивать как клинически асимптомные постпроцедуральные церебральные ишемические очаги (АПЦИО). У пациентов группы 1 мы выявляли появление АПЦИО у 21% больных с односторонним и у 48% с двусторонним поражением сонных артерий. Во группе 2 частота появления ишемических очагов была значительно меньше и составила 5 и 12% при одностороннем и двустороннем поражениях сонных артерий соответственно.
По локализации АПЦИО в отношении стороны операции достоверной разницы между обеими группами отмечено не было. Среди всех пациентов с односторонним поражением сонных артерий, у которых были обнаружены асимптомные ишемические очаги на стороне КЭАЭ, эти образования выявлялись в 82%, контралатерально – в 3%, билатерально – в 5% случаев. При двустороннем поражении сонных артерий АПЦИО выявлялись на стороне операции в 65%, контралатерально – в 22%, и билатерально – в 13% случаев.
При этом лишний раз отметим, что число и размеры этих очагов при фармакологическом прекондиционировании были значительно меньше при сравнении с таковыми у группы больных, оперированных без предварительной медикаментозной подготовки.
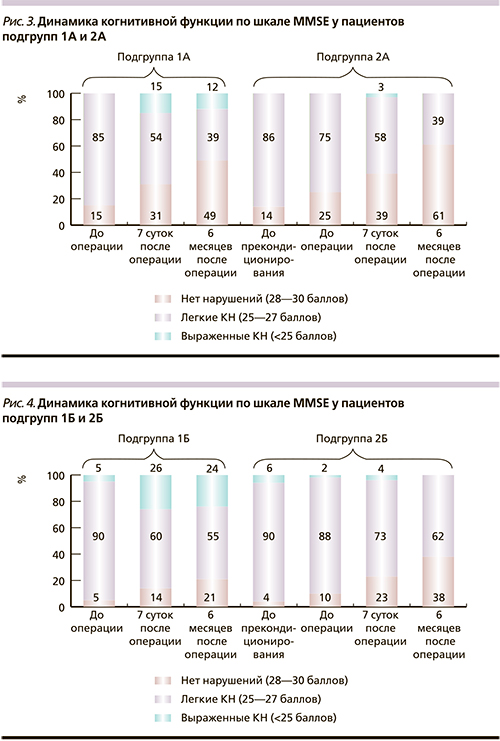
Динамика показателей КФ по шкале MMSE в группах представлена на рис. 3 и 4. До лечения мы обнаружили отсутствие когнитивных нарушений (КН) только у 14–15% больных с односторонним поражением сонных артерий и наличие в 85% случаев умеренных когнитивных нарушений (УКН). На 7-е сутки после операции без предварительной предоперационной подготовки отмечено увеличение доли пациентов без КН до 31% и уменьшение доли пациентов с наличием синдрома УКН до 54%. Однако было обнаружено появление выраженных КН в 15% случаев. Через 6 месяцев после операции выявлена тенденция к увеличению доли пациентов с отсутствием КН до 49%, снижение УКН до 39% и незначительное уменьшение доли выраженных когнитивных расстройств до 12%.
У пациентов подгруппы 2А доля пациентов без КН после прекондиционирования препаратом Актовегин увеличилась с 14 до 25%. На 7-е сутки после операции число больных без КН увеличилось до 39% за счет доли умеренных КН, которая уменьшилась с 75 до 58%. Появление же выраженных КН на этом этапе исследования мы наблюдали лишь среди 3% больных.
К 6-му месяцу наблюдения отмечено увеличение числа пациентов без нарушения КФ до 61%, снижение доли пациентов с УКН – до 39% и полное отсутствие больных с тяжелыми КН.
Похожие результаты мы получили при анализе пациентов с двусторонним поражением сонных артерий (подгруппы 1Б и 2Б) с той лишь разницей, что у этих больных мы имели изначально более тяжелые когнитивные расстройства, восстановление же кровотока привело к меньшей положительной динамике в отношении нормальной КФ и появлению большего числа больных, оперированных без предоперационной медикаментозной подготовки, с тяжелыми КН после операции. Проведенное же пациентам подгруппы 2Б фармакологическое прекондиционирование позволило выявить лучшую положительную динамику как в увеличении числа больных с нормальной КФ, так и в снижении, а к 6-му месяцу в полном исчезновении случаев грубых КН.
Обсуждение результатов
Основная цель, которую преследует хирургическое лечение стеноза брахиоцефальных артерий, – профилактика возникновения ишемического инсульта. Однако не только риск инсульта, сердечно-сосудистых осложнений и продолжительность жизни пациента выступают в качестве важных критериев оценки послеоперационного периода [4]. Последнее время все больше внимания уделяется влиянию восстановления проходимости сонных артерий на состояние КФ, существенно влияющее на прогноз и качество жизни больного. С расширением применения хирургических методов лечения стенозов внутренней сонной артерии (ВСА) состояние КФ привлекает внимание как важный аспект эффективности и безопасности оперативных вмешательств.
Имеющиеся в настоящее время результаты исследований КФ у больных цереброваскулярными заболеваниями после перенесенных операций на ВСА противоречивы [11, 19]. Некоторые авторы показали улучшение когнитивного статуса и качества жизни в послеоперационном периоде [14]. В других исследованиях не отмечено положительных изменений, а в ряде случаев констатировано ухудшение КФ [9]. Кроме этого в современной литературе имеются данные о разнонаправленной динамике – усугублении нарушений одних модальностей при улучшении других показателей высших психических функций [6, 18].
Большинство авторов полагают, что позитивная динамика КФ в послеоперационном периоде является следствием улучшения перфузии головного мозга, а также уменьшением в дальнейшем вероятности артерио-артериальной эмболии [18, 25].
Однако с другой стороны оперативное вмешательство сопряжено с риском интраоперационного церебрального повреждения и нарушения высших мозговых функций в послеоперационном периоде. Доказано, что ухудшение КФ может быть следствием церебральной микроэмболии во время хирургического вмешательства [15, 16, 25] либо церебральной гиперперфузии после КЭАЭ [10]. Принято считать, что микроэмболия во время выполнения стентирования или КЭАЭ является основной причиной появления АПЦИО. По данным исследования ICSS, при проведении магнитно-резонансной томографии в режиме ДВИ за 1–2-е сутки после стентирования сонных артерий и КЭАЭ ишемические очаги выявляются в 50 и 17% случаев соответственно. [8]. При этом клиническое значение АПЦИО, включая их влияние на состояние КФ, окончательно не установлено [23]. Тем не менее появившиеся за последние годы сообщения свидетельствуют о существенной взаимосвязи количества и размеров АПЦИО после перенесенных вмешательств на сонных артериях с нарушением КФ [1].
Изучение проблемы профилактики и коррекции последствий локальной ишемии, развивающейся при различных хирургических вмешательствах, привело к появлению концепции ишемического прекондиционирования, суть которой состоит в применении коротких подпороговых периодов ишемии, активирующих эндогенные защитные механизмы и тем самым снижающих степень повреждения клеток в результате последующего продленного ишемического эпизода. Однако позже открытое прекондиционирование фармакологическими средствами с клинической точки зрения выглядит предпочтительнее, т.к. технологически проще и лишено потенциальной опасности ишемических эпизодов для измененных тканей. С учетом механизма и характера ишемических повреждений головного мозга при операциях на брахиоцефальных артериях применение препаратов нейропротективного ряда может быть оправданным.
В нашей работе мы использовали биологический препарат Актовегин, представляющий собой высокоочищенный гемодериват крови телят, состоящий более чем из 200 биологически активных компонентов [22]. Актовегин увеличивает потребление кислорода и поступление глюкозы в клетки, благодаря чему усиливается энергетический метаболизм и при этом возрастает образование АТФ. Препарат также препятствует образованию и свободных радикалов и блокирует процессы апоптоза. Тем самым Актовегин защищает клетки, в особенности нейроны, от гибели в условиях гипоксии и ишемии. Помимо этого Актовегин улучшает микроциркуляцию в тканях, позитивно воздействуя на эндотелий сосудов [12, 13].
В ряде экспериментальных работ были достоверно доказаны возможности Актовегина предупреждать гибель клеток наиболее чувствительного к гипоксии гиппокампа, при моделировании острой ишемии, сохранении и восстановлении КФ подопытных животных [24].
Целесообразность применения фармакологической защиты мозга была подтверждена в нашей работе тем фактом, что восстановление адекватного кровотока в сосудах головного мозга без предварительной медикаментозной подготовки, несмотря на отсутствие явных неврологических нарушений, приводило к снижению КФ. Это могло быть связано с неадекватной ауторегуляцией мозгового кровотока, существующей на фоне длительной хронической ишемии головного мозга, и усугублением поражения церебральных структур при реперфузионном синдроме. Вероятно, такой механизм появления ишемических очагов действительно имеет место, однако, как было показано в нашей работе, возникновение их на контралатеральной стороне и значительное снижение их числа при проведении фармакологического прекондиционирования свидетельствуют о важной роли реперфузионного повреждения в появлении АПЦИО. В нашем исследовании мы получили четкую связь между числом асимптомных ишемических очагов в полушариях головного мозга и снижением КФ после КЭАЭ. Медикаментозная подготовка к операции позволила значительно уменьшить число и размеры АПЦИО как на стороне операции, так и на контралатеральной стороне, что существенно улучшило КФ пациентов в послеоперационном периоде.
Таким образом, применение медикаментозной предоперационной подготовки в виде фармакологического прекондиционирования препаратами нейропротективного ряда способно улучшить состояние ауторегуляции мозгового кровообращения, увеличить перфузию головного мозга еще до оперативного лечения, тем самым снизив степень ишемии, что при восстановлении артериального кровотока уменьшает реперфузионное повреждение тканей головного мозга. Одним из потенциальных средств фармакологического прекондиционирования может служить препарат Актовегин.


