Внедрение новых технологий в комплексную реабилитацию пациентов, перенесших инсульт, – важная задача современной медицины. Возможности нейрореабилитации в последние годы возросли в связи с применением технологии «нейроинтерфейс мозг–компьютер+экзоскелет кисти» (НМКЭ), в основе которой лежит стимуляция механизма нейропластичности [1]. Возникающие в нервной системе процессы активации двигательных структур при регулярном кинестетическом воображении целенаправленного движения (разжимания кисти), подкрепленные обратной зрительной и проприоцептивной связями, способствуют восстановлению и/или компенсации утраченной двигательной функции [2, 3]. Эффективность методики НМКЭ зависит от многих факторов, в. т.ч. от способности к полноценному выполнению ментальной задачи – кинестетическому воображению движения [4]. Уточнение факторов, влияющих на качество выполнения воображения движения, представляется весьма важным для применения методики НМКЭ [5], поскольку позволяет выявлять целевую группу пациентов с высокими предикторами эффективности.
Целью исследования было выявление предикторов эффективности нейрореабилитации больных с постинсультными двигательными нарушениями для применения процедур НМКЭ.
Материал и методы
Проведение исследования одобрено этическим комитетом МОНИКИ (протокол № 9 от 02.10.2014). Пациенты подписывали информированное согласие на участие в исследовании. Протокол исследования зарегистрирован в международном реестре клинических исследований Национального института здоровья США ClinicalTrials.gov (Identifier: NCT02325947). Исследование проведено на базе неврологического отделения ГБУЗ МО МОНИКИ им. М.Ф. Владимирского.
С целью отбора пациентов для проведения реабилитации был проведен скрининг 89 пациентов, критериям включения соответствовали 75 пациентов, распределенных на 3 группы (основная группа – 36, контрольная – 20, группа сравнения – 37). Медиана возраста участников составила 62 [53; 66] года. У всех исследуемых пациентов был диагностирован единичный очаг инсульта, подтвержденный при нейровизуализации, со сроком от 1 до 24 месяцев, медиана давности инсульта составила 8,5 [5; 16] месяцев. Тяжесть пареза в руке составила от 1 до 4 баллов по Британской шкале оценки мышечной силы (MRC-SS). Во всех группах обследуемые были сопоставимыми по тяжести двигательных и когнитивных нарушений, срокам давности перенесенного инсульта. В предыдущих клинических исследованиях показано, что в основной группе восстановление идет лучше по сравнению с контрольной [6, 7] и группой сравнения [8]. В настоящем исследовании проведен анализ основной группы с целью оценки способности к кинестетическому воображению.
НМКЭ представляет собой программно-инженерный комплекс, осуществляющий регистрацию биоэлектрической активности мозга, связанной с кинестетическим воображением целенаправленного действия (разжиманием кисти) и преобразованием его по механизму обратной связи в команду внешнему устройству – экзоскелету кисти [9].

В ходе процедуры [10] пациенту необходимо было воспроизвести три ментальные задачи на воображение: поочередное разжимание правой и левой кисти, релаксация. При этом в период воображения целенаправленного движения кисти рук должны быть неподвижными. С целью количественной оценки качества выполнения задач на воображение движений в основной группе вычислялось среднее значение среди максимальных вероятностей распознавания при выполнении трех ментальных задач. С этой целью бралось среднее значение максимальных вероятностей распознавания задач на кинестетическое воображение – раскрытие правой, левой кистей, расслабление в течение тренировки на НМКЭ. Эти величины получены классификатором в результате анализа ЭЭГ-мониторинга в процессе процедуры по методу Байеса [11]. Индекс «каппа Коэна» отражает показатель точности классификации и при идеальном распознавании равен 1 (κ=1), при случайном – менее 0,3 (κ<0,3).
Протокол исследования
Всем пациентам была проведена комплексная терапия, включившая ЛФК, массаж, физиопроцедуры по показаниям. Из них 36 пациентов были включены в основную группу и получали ежедневные тренировки при помощи НМКЭ, включившие 10 занятий по 3 сессии в день. При проведении процедуры НМКЭ осуществлена обратная связь по двум каналам: в случае правильного выполнения задачи пациентом – кинестетического воображения движения (разжимание кисти) – экзоскелет осуществлял раскрытие кисти, а в качестве обратной зрительной связи – метка в центре экрана окрашивалась в зеленый цвет. Если классификатор не распознавал выполнения задачи как соответствующего инструкции, раскрытие кисти пациента экзоскелетом не производилось, метка на экране цвет не меняла. Пациенты контрольной группы (n=20) получали 10 тренировок по 3 сессии ежедневно, без задачи на воображение, соответственно, без обратной связи, экзоскелет срабатывал в случайном режиме.
Пациенты группы сравнения (n=36) получали только стандартную терапию, включивщую ЛФК, массаж, физиопроцедуры по показаниям.
Оценка результата реабилитации
Оценка когнитивной функции до и после тренировок с НМКЭ проведена с использованием Монреальской шкалы оценки когнитивной функции (МоСА) и таблиц Шульте. Анализ динамики двигательной функции руки был проведен с применением международных шкал Fugl-Meyer Assessment scale (FM), при этом использовали раздел, отвечающий за показатели в проксимальных и дистальных отделах руки, Action Research Arm Test (ARAT), Британской шкалы оценки мышечной силы (MRC-SS), модифицированной шкалы спастичности Ашворта (MAS). С целью объективизации результата тренировок с помощью НМКЭ кроме общепринятых клинических шкал (FM, ARAT, MRC-SS) дополнительно изучали биомеханические параметры движения. Для оценки биомеханики активного движения руки перед началом комплексной реабилитации и после окончания регистрировался кинематический портрет движения руки [12, 13].
Для регистрации использовалась электромагнитная система trakStar (Ascension Techn. Corp., USA), оснащенная четырьмя датчиками, которые устанавливались на акромионе лопатки, плече, предплечье и кисти как паретичной, так и здоровой руки. По данным регистрации движений вычислялись суставные углы и ускорения. Полученные данные сопоставлялись с результатами клинических шкал оценки двигательной функции. Кинематический портрет пациента включал активные движения, которые соответствовали всем степеням свободы в руке (сгибание/разгибание и приведение/отведение кисти; сгибание/разгибание и пронация/супинация локтя; сгибание/разгибание, приведение/отведение и вращение плеча), выполняемые с удобной для конкретного пациента скоростью и максимальной амплитудой. По данным регистрации движений вычислялись суставные углы, угловые скорости и ускорения. Увеличение угловых ускорений, пропорциональное суммарному моменту мышечных сил, действующих на сустав, отражает изменение мышечной силы.
Статистическая обработка данных проводилась при помощи пакета прикладных программ Statistica 10 на персональном компьютере с помощью критериев Уилкоксона для зависимых выборок, Манна–Уитни для независимых выборок, коэффициента корреляции Спирмена.
Результаты
При анализе вероятности распознавания у всех пациентов основной группы она варьировалась от 0,4 до 0,8, случайного распознавания выявлено не было (рис.1). В зависимости от величины вероятности распознавания пациенты основной группы были разделены на 2 подгруппы: с высокой вероятностью распознавания (κ>0,56) и с низкой вероятностью распознавания (κ<0,56).
По результатам анализа исходного когнитивного уровня пациентов до начала тренировок на НМКЭ и оценки способности пациентов к кинестетическому воображению были выявлены некоторые взаимосвязи. Так, при анализе связи между значениями теста МоСА и вероятностью распознавания с помощью коэффициента ранговой корреляции Спирмена выявлена положительная высокозначимая связь, коэффициент Спирмена составил 0,5. В группе с низкой вероятностью распознавания (менее 0,56) медиана уровня когнитивной функции по МоСА составила 23 [22; 23], в группе с вероятностью распознавания более 0,56 – 26 [25; 27] (рис. 2), различие между группами было статистически значимым (р<0,05).
При анализе таблицы Шульте и вероятности распознавания установлено: в подгруппе с низким распознаванием (ниже 0,56) показатель эффективности работоспособности из теста «Таблица Шульте» был достоверно хуже по сравнению с подгруппой, где вероятность распознавания была выше 0,56 (р<0,05; рис. 3).
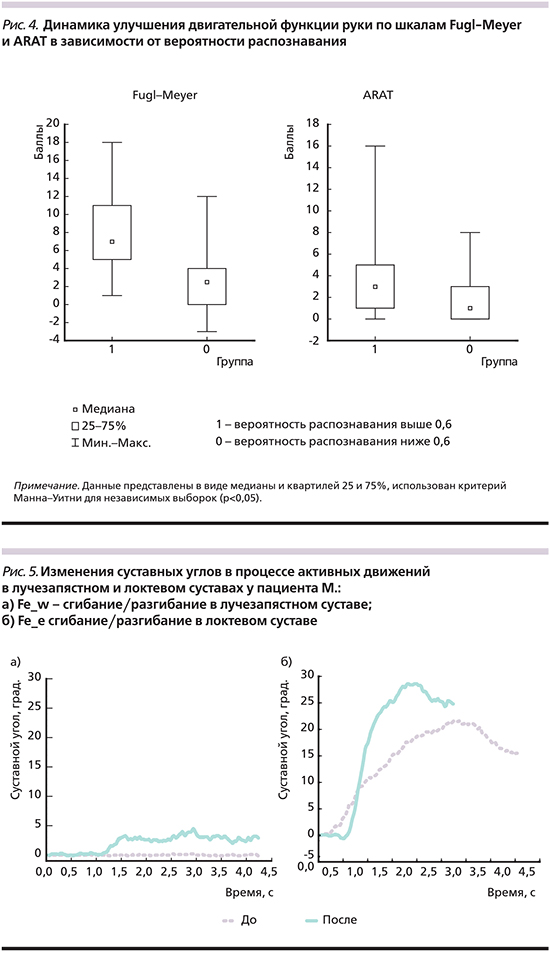
При оценке динамики изменений двигательной функции руки при помощи шкал FM и ARAT получены результаты, представленные на рис. 4.
Динамика улучшения движения руки по шкале FM и в кисти по шкале ARAT в группе с вероятностью распознавания >0,56 составила 7 [5; 11] и 3 [1; 5] соответственно, в группе с вероятностью распознавания <0,56 – 2,5 [0; 4] по FM и 1 [0; 3] по ARAT, разница между группами была статистически значимой (p<0,05).
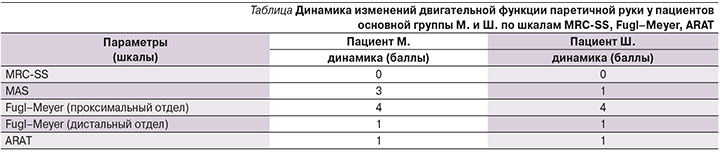
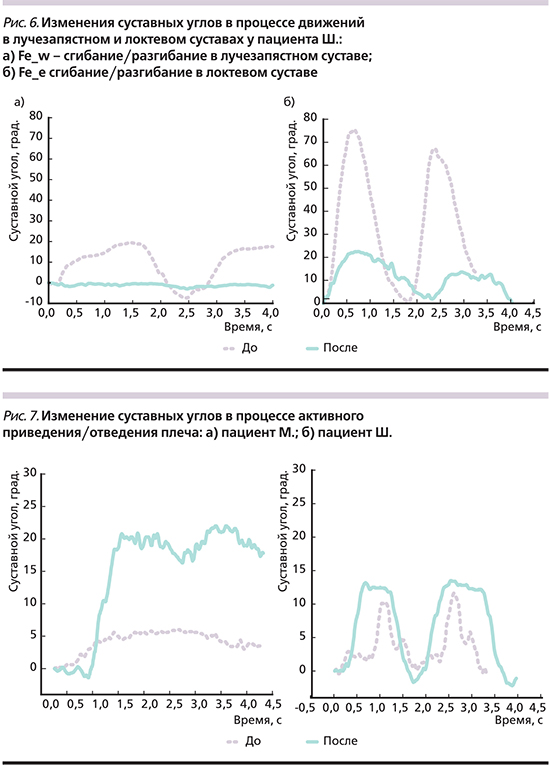
На рис. 5 представлены данные биомеханического анализа движений в паретичной руке двух пациентов – М. и Ш. основной группы. Пациенты были схожими по демографическому показателю, оба – мужчины в возрасте 68 лет после перенесенного ишемического инсульта со сроком давности 9 месяцев; степень пареза в руке по Британской шкале мышечной силы до начала тренировок на НМКЭ составила 1 балл; уровень спастичности мышц по модифицированной шкале Ашворта – 3 балла у пациента М. и 1 балл у Ш.; степень дееспособности по модифицированной шкале Рэнкина – 3-я степень у обоих.
Однако эти пациенты значительно различались по уровню когнитивной функции (по показателю МоСА пациент М. набрал 27, Ш. – 23 балла), психофизиологическим показателям (показатель эффективности работоспособности по таблице Шульте у М. составил 84 с, у Ш. – 181,6 с), наличию тревоги и депрессии (по шкале HADS у пациента М. отсутствовали достоверно выраженные клинические симптомы тревоги и депрессии, у пациента Ш. отмечена клинически выраженная тревога и депрессия). Показатели распознавания также различались: у пациента М. вероятность распознавания составила 0,7, у Ш. – 0,4.
Динамика двигательных изменений при оценке по шкалам Fugl–Meyer, ARAT, MRC-SS была одинаковой для обоих пациентов (см. таблицу).
Анализ биомеханических параметров движений паретичной конечности до и после процедуры НМКЭ показал, что у пациента М. с высокой вероятностью распознавания 0,7 появилось активное сгибание в лучезапястном суставе (рис. 5а), увеличилась амплитуда сгибания в локтевом суставе (рис. 5б), а также амплитуда отведения/приведения плеча (рис. 7а).
У пациента Ш. изначально наблюдались активные движения в лучезапястном суставе с небольшой амплитудой 15°, однако по окончании курса амплитуда движения в лучезапястном суставе снизилась до 0 (рис. 6а). Снижение амплитуды движения наблюдалось и в локтевом суставе (рис. 6б).
Биомеханический анализ отведения/приведения в плечевом суставе паретичной руки у пациента М. показал увеличение амплитуды движения почти в 4 раза относительно исходного уровня (рис. 7а), тогда как у пациента Ш. разница с исходным уровнем была небольшой (рис. 7б).
Обсуждение и выводы
Активное участие пациента в ходе тренировки с помощью нейроинтерфейса – важный аспект этого вида нейрореабилитации. Целенаправленное обучение пациента кинестетическому воображению в процессе занятий по технологии НМКЭ способствует стимуляции сохранных областей мозга, способных управлять движением.
У всех пациентов основной группы, проходивших обучение воображению движения на НМКЭ, классификатором определялась различная вероятность ЭЭГ-паттернов движения (от 0,4 до 0,8), причем у всех обследуемых показатель был выше 0,3, что указывает на отсутствие случайного распознавания в ходе процедуры (рис. 1). Способность к выполнению ментальной задачи каждого пациента была индивидуальной. Пациенты с высокой способностью к кинестетическому воображению лучше проходили обучение на НМКЭ, соответственно, результаты двигательного восстановления у таких пациентов были выше (рис. 4). Особенно наглядно это показывает биомеханический анализ движений, результаты которого представлены на рис. 5–7 для двух пациентов с разными когнитивными показателями и разной способностью к воображению движения. Необходимо отметить, что клинические шкалы оценки двигательной функции не показали динамики ее изменения в ходе процедур НМКЭ (см. таблицу). Это свидетельствует о недостаточной чувствительности шкал F-M и ARAT для оценки эффективности НМКЭ и о необходимости использования для такой оценки объективных инструментальных методов.
Обнаруженная взаимосвязь между начальным уровнем когнитивной функции и способностью к кинестетическому воображению (рис. 2) указывает на резерв когнитивных возможностей пациента для качественного выполнения ментальной задачи. Связь между показателем эффективности работоспособности и вероятностью распознавания (рис. 3) отражает способность удерживать внимание на протяжении всей 40-минутной сессии, что положительно влияет на качество тренировки. Таким образом, уровень когнитивной функции может служить критерием оценки резерва индивидуальной способности к воображению движения. Это положение позволяет предполагать, что стимуляция когнитивных функций у пациентов, перенесших инсульт, может способствовать более успешному процессу двигательной реабилитации.



