Введение
За последние десятилетия наблюдается рост числа переломов лодыжек у лиц пожилого и старческого возраста, что влечет за собой значительные экономические потери как пациентов, так и общества. Результаты эпидемиологических исследований свидетельствуют, что частота переломов лодыжек в европейских странах составляет 180–200 на 100 тыс. человек, причем 20–30% из них малоэнергетические и происходят у лиц пожилого и старческого возраста [1]. В публикациях конца XX в. утверждалось, что остеопороз (ОП) не оказывает существенного влияния на частоту переломов лодыжек [2, 3]. Однако в исследованиях 2000–2010 гг. отмечено кратное увеличение числа таких переломов у лиц пожилого и старческого возраста, связанное с системным ОП [4, 5].
Рекомендации по выбору способа лечения переломов лодыжек у лиц старше 50 лет противоречивы. Высокий риск гнойных осложнений (до 12% и более) в сочетании с риском нестабильности фиксации вследствие ОП (до 42%) послужили основой для рекомендации использовать консервативные методы лечения [6]. Появление специальных конструкций с угловой стабильностью и использование препаратов для лечения ОП в послеоперационном периоде позволяют ряду исследователей рекомендовать открытую репозицию и фиксацию как метод выбора при переломах лодыжек у пожилых пациентов [7, 8]. Достаточно перспективным является интра- или послеоперационное использование антирезорбтивных средств, а также препаратов двойного действия для улучшения остеоинтеграции и функциональных исходов остеопоротических переломов [9, 10].
Целью настоящего исследования было доказательство возможности улучшения результатов оперативного лечения остеопоротических переломов лодыжек (код AO/OTA 43,44) путем применения в послеоперационном периоде стронция ранелата в дозе 2 г ежедневно в течение 12 месяцев.
Проверялись следующие нулевые гипотезы:
- H01 – стронция ранелат в дозе 2 г ежесуточно в течение года в послеоперационном периоде не накапливается в зоне формирования костного регенерата;
- H02 – стронция ранелат в вышеуказанной дозировке не улучшает функциональное состояние оперированного голеностопного сустава.
Конечной точкой исследования было подтвержденное рентгенологически сращение перелома и удаление металлоконструкции. Промежуточные точки – рентгенографическая оценка консолидации перелома и количественная оценка функции голеностопного сустава.
Материал и методы
Работа проведена в 2013–2014 гг. в условиях Ростовского городского центра травматологии и ортопедии и кафедры травматологии и ортопедии, ЛФК и спортивной медицины ФПК и ППС РостГМУ в соответствии с разрешением этического комитета ГОУ ВПО РостГМУ. В проспективное контролируемое рандомизированное исследование включены пациенты (мужчины и женщины) в возрасте 50 и более лет с малоэнергетическими переломами 44-А3–44-В3.
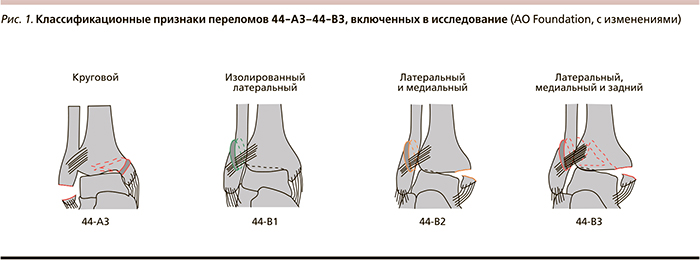
Тип перелома определен по рентгенограмме в соответствии с классификационными критериями AO (Association for Osteosynthesis) Foundation [11]. Схематическое изображение переломов приведено на рис. 1.
Описываемые переломы соответствуют кодам Международной классификации болезней 10-го пересмотра «Перелом голени, включая голеностопный сустав (S82)» S82.3–S82.6.
Признаками малоэнергетического перелома считали травмы, полученные при падениях без приложения внешнего усилия (например, обычная ходьба, прыжок с высоты не более 1/2 длины голени пациента, вставание со стула, спокойный выход из общественного транспорта).
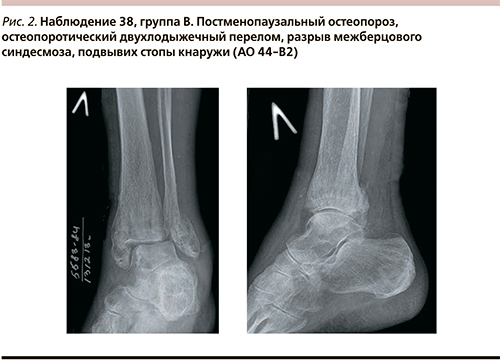
В качестве рентгенологических признаков ОП рассматривались уменьшение плотности рентгенологической тени, истончение кортикального слоя в сочетании с усилением рисунка замыкательных пластинок большеберцовой и малоберцовой костей, разрежение трабекулярного рисунка метаэпифизарной зоны (рис. 2).
Считали, что пациенты имели подтвержденный до травмы ОП при наличии в анамнезе «маркерных» переломов эпиметафиза лучевой кости, позвонков, проксимального отдела плечевой кости. Подтверждением ОП служили данные двуэнергетической рентгеновской денситометрии (ДРД), предоставленные пациентом, или сведения о длительном приеме кортикостероидов, или верифицированные эндокринные заболевания.
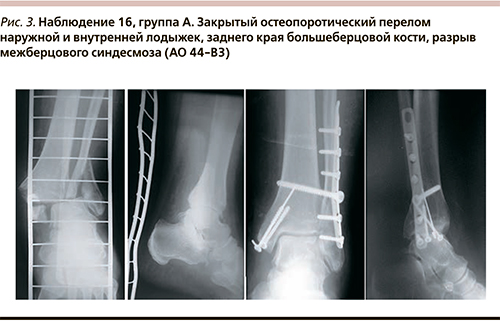
Критериями исключения были открытые переломы, подтвержденная анамнестически или данными дополнительных исследований кардиоваскулярная патология (ишемическая болезнь сердца, неконтролируемая артериальная гипертензия; облитерирующие заболевания периферических артерий, цереброваскулярные заболевания, в т.ч. инсульт в анамнезе, варикозная болезнь нижних конечностей и сведения о перенесенных флебитах, тромбофлебитах).
Включенные в исследование пациенты были распределены в две группы:
- А (контрольная) – 18 пациентов, которые в послеоперационном периоде до удаления металлоконструкций получали препараты кальция (1500 мг/сут), колекальциферол (1200 МЕ/сут);
- В (основная) – 24 пациента, которые помимо препаратов кальция и витамина D, как в группе А, до удаления металлоконструкций получали стронция ранелат (2 г 1 раз в сутки).
Распределение пациентов по группам осуществлено методом последовательных номеров, полученных из таблицы случайных чисел. В группу А включены пациенты с нечетными номерами, в группу В – с четными.
В дооперационном периоде проведены рутинное обследование, рентгенография голеностопного сустава, ультразвуковое исследование вен ног. Оперативные вмешательства выполнены в интервале 48 часов с момента получения травмы. Операция выполнена под проводниковой анестезией (бупивакаина гидрохлорида 5 мг и адреналина 5 мкг в 1 мл, до 30 мл) с седацией пациента.
Способ оперативного вмешательства избирался хирургом, но всегда включал устранение подвывиха, репозицию перелома внутренней лодыжки и фиксацию стягивающими винтами или натягивающейся петлей.
К основным целям остеосинтеза переломов наружной ложки отнесены восстановление ее длины, устранение ротационного смещения, анатомическое выравнивание суставной поверхности лодыжки по отношению к маллеолярной суставной поверхности таранной кости. Репозиция завершена фиксацией перелома 1/3-трубчатой пластиной или узкой пластиной с угловой стабильностью. При сомнениях в целостности суставной поверхности таранной кости выполнена короткая латеральная артротомия с удалением свободных фрагментов гиалинового хряща.
Состояние межберцового синдесмоза после остеосинтеза лодыжек оценено с помощью ротационной пробы и смещения наружной лодыжки с помощью однозубого крючка. При амплитуде движений более 3–4 мм выполнена трансфиксация межберцового синдесмоза винтом с обязательным контролем (интраоперационная рентгенография или электронно-оптический преобразователь; рис. 3) Операционные раны ушивались без дренирования.
Антибиотикопрофилактика осуществлена цефалоспоринами 3-го поколения в течение 48 часов. Первое внутривенное введение антибиотика выполнено за 60 минут до разреза.
В послеоперационном периоде в течение 40 дней проведена профилактика тромбоэмболических осложнений: на стационарном этапе эноксапарина натрием или далтепарина натрием (40 мг 1 раз/сут подкожно в течение периода пребывания в стационаре), в амбулаторных условиях – ривороксабаном (10 мг/сут до 45 суток) или дабигатрана этексилатом (220 мг/сут до 45 суток) в соответствии с инструкциями изготовителей.

Режим разгрузки оперированного голеностопного сустава костылями осуществлен в течение 8 недель. После стихания болей и уменьшения отека разрешались активные движения в суставе без осевой нагрузки.
Оценка функции голеностопного сустава проведена по шкале AOFAS – American Orthopaedic Foot and Ankle Society [12] за первые 7–9 дней пребывания в стационаре, затем в амбулаторном режиме при личной явке на 50–60-й день, при контрольном осмотре – через 6 месяцев и перед удалением металлоконструкций в интервале 365–400 дней от даты операции.
Качество репозиции, остеосинтеза и консолидации перелома в те же сроки осуществлено рентгенологически. Учтены величина смещения костных фрагментов, соответствие центров суставных поверхностей таранной и большеберцовой костей, симметричность рентгенологической ширины межберцового синдесмоза поврежденного и противоположного голеностопного суставов. Отмечены факты миграции металлоконструкций, изменение оптической плотности изображения метафиза большеберцовой кости.
В обеих группах при первичном остеосинтезе и в процессе удаления металлоконструкций были получены образцы костной ткани (костная стружка с перьев сверла, мелкие костные фрагменты) из области перелома. Расчет необходимого числа образцов костного вещества из области перелома для оценки накопления стронция основан на данных о средней концентрации стронция в костной ткани людей, проживающих в городах с населением 105 человек (49,0±18,4 мг/кг сухого костного вещества [13]), и сведениях об увеличении содержания стронция в тканях экспериментальных животных, которым скармливался стронция малонат [14]. Необходимое число образцов было определено в количестве не менее 18 экземпляров в каждой группе. Объем образцов составил 0,5–0,7 см3. Костные образцы готовились к электронной микроскопии общепринятыми методами [15].
Морфология поверхности костных образцов исследовалась методом сканирующей электронной микроскопии (SEM – Scanning Electron Microscope; электронный микроскоп Phillips ХL30) с детектором DX4 (EDAX). Микроэлементный анализ кости выполнен методом энергодисперсионной рентгеновской спектроскопии (EDX – Energy-dispersive X-ray spectroscopy) [16]. Исследование проведено при ускоряющем напряжении 3 киловольта для фотографирования поверхности, 25 киловольт – для получения спектров микроэлементов. Спектры получали с 5 произвольно выбранных участков каждого образца. Для анализа спектров использованы прикладные программы, результаты обработки представлены в виде весовых и атомарных процентов по всем обнаруженным элементам.
В течение месяца после перенесенного оперативного вмешательства выполнена ДРД, целью которой была оценка минеральной плотности костной ткани.
Данные накапливались в рабочих таблицах Excel, откуда были импортированы в пакет IBM SPSS Statistics 19. Рассчитывались показатели описательной статистики, проверка статистических гипотез осуществлена непараметрическим методом сравнения медиан при уровне значимости 0,05 [17].
Результаты исследования
Из 314 пациентов с переломами лодыжек в исследование были отобраны 52 (13 мужчин в возрасте 61±4,5 года; 29 женщин в возрасте 63±5,5 года) пациента, удовлетворявших критериям включения. Особенно тщательно проведена диагностика противопоказаний к назначению стронция ранелата [18]. Исследование завершили 42 пациента (группа А – 18 человек, группа В – 24 человека). Структура исследованной когорты представлена на рис. 4.
Возрастная характеристика подгрупп приведена в табл. 1.
Группы статистически достоверно не различались по возрасту (сравнение медиан для независимых выборок, значимость – 0,755).
Статистически достоверных различий между группами А и В по критерию Tscore не выявлено (Tscore А=-2,6, стандартное отклонение=0,44; Tscore Б=2,4, стандартное отклонение=0,42; значение критерия Манна–Уитни для независимых выборок – 0,415).
Все пациенты были прооперированы в течение первых 48 часов с момента госпитализации. Если ожидаемая продолжительность дооперационного периода превышала 24 часа, то после устранения основных смещений осуществлялось скелетное вытяжение за пяточную кость. Оперативное вмешательство проведено на основе принципов, изложенных в разделе «Материал и методы».
В обеих группах отмечены осложнения в ближайшем и отдаленном периодах: вторичное заживление раны – у 3 пациентов, из них у 2 в группе А; замедленная консолидация – у 1 пациента в группе А. Вторичное заживление раны не повлияло на сроки удаления металлоконструкций, при замедленной консолидации перелома металлоконструкции были удалены через 410 дней. Металлоконструкции удалялись через 350±15 дней.
Динамика показателей функциональной активности в контрольных точках приведена на рис. 5. Из диаграммы следует, что оценка функции голеностопного сустава у пациентов группы В превышала таковую у пациентов, не получавших стронция ранелат. Статистически достоверные различия возникали при измерениях, проведенных через 6 месяцев с момента операции и достигали максимума к моменту удаления металлоконструкций. Проверка гипотезы H02 по непараметрическим критериям (значение теста сравнения медиан независимых выборок=0,000) позволяет отвергнуть гипотезу H02 – стронция ранелат в вышеуказанной дозировке не улучшает функционального состояния оперированного голеностопного сустава.
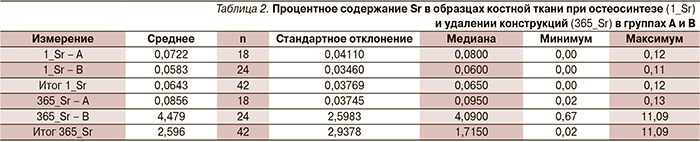
При проведении SEM и EDX образцов костной ткани из зоны переломов было установлено, что до начала лечения группы не различались по содержанию Sr (табл. 2) и кальция (табл. 3). Тест сравнения средних медиан составил 0,35 для содержания Sr и 0,30 для Са в пробах при остеосинтезе.
При удалении металлоконструкций зарегистрированы статистически достоверные различия между группами А и В по процентному содержанию Sr (Среднеегр А=0,85, Стандартное отклонениегр А=0,04; Среднеегр В=4,48, Стандартное отклонениегр В=2,0; UMann–Whitney=0,00) и Ca (Среднеегр А=29,30, Стандартное отклонениегр А=5,50; Среднеегр В=24,38, Стандартное отклонениегр В=6,60; UMann–Whitney=0,008).
Характеристические спектры от К-электронной оболочки атомов химических элементов в костных образцах (O – кислород, Mg – магний, Na – натрий, К – калий, Ca – кальций, Sr – стронций) приведены на диаграммах (рис. 4). При удалении металлоконструкций в группе А среднее процентное содержание Sr не отличалось от исходного (значение теста Колмогорова-Смирнова 0,646). В группе В зарегистрировано кратное статистически достоверное повышение процентного содержания Sr (значение теста Колмогорова–Смирнова 0,025). Таким образом, отвергнута гипотеза H01 – SrRan в количестве 2,0 г ежесуточно в течение 1 года в послеоперационном периоде не накапливается в зоне формирования костного регенерата.
Отмечена слабая отрицательная корреляция между процентным содержанием Sr и Са в образцах группы В (rSpirmen=-0,186, двусторонняя значимость – 0,384), отсутствовшая в образцах группы А.

На изображениях поверхности костных образцов как в группе А, так и в группе В, взятых при остеосинтезе, хорошо видны участки разрыхления и растрескивания костной ткани, неполной организации остеонов. Подобная картина сохраняется во втором образце, принадлежащем пациентке группы А (рис. 7).
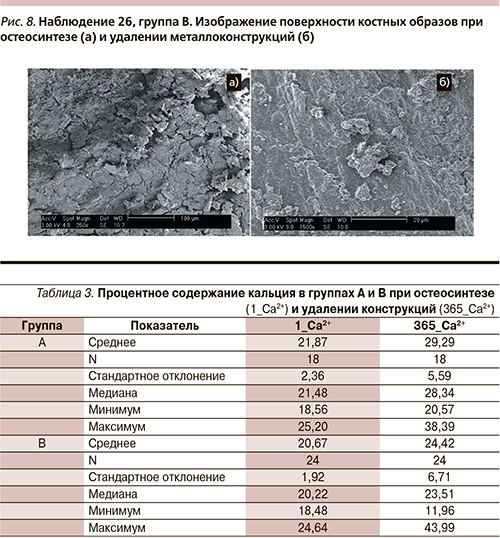
У пациентов группы В при удалении металлоконструкций в костных образцах отмечены утолщение костных балок и мембран канальцев, гипертрофия стенок канальцев. Заметно четкое возвышение гребней спайновых линий. Матрикс компактного вещества плотный, представляется аморфным за счет плотного прилегания его компонентов друг к другу (рис. 8).
Сопоставив результаты визуализации с данными, согласно которым среднее процентное содержание кальция в первой и второй пробах не различается статистически достоверно, можно предположить, что структура гидроксиапатита существенно не изменяется под влиянием Sr, что может приводить к равномерному распределению компонентов костного матрикса.
Обсуждение
На протяжении длительного времени в эпидемиологических исследованиях существовало мнение, будто ОП не служит фактором риска переломов лодыжек. Например, по данным обследования более 9000 женщин в течение 10 лет был сделан следующий вывод: в этой когорте факторами риска являются избыточная масса тела, склонность к падениям, более ранний и активный возраст. Уменьшение массы и плотности костной ткани как фактор риска не рассматривалось [19, 20]. Однако в исследованиях последнего десятилетия убедительно продемонстрирована связь между предшествующим переломом лодыжек и последующими «большими» остеопоротическими переломами [21, 22].
В представляемом исследовании остеопоротические переломы составили 16,5% среди всех переломов лодыжек, требовавших госпитализации в 2013–2014 гг. Наличие ОП подтверждено данными ДРД.
Выбор способа лечения переломов у больных пожилого и старческого возраста, имеющих ОП, представляет собой весьма неопределенную задачу. Имеющиеся публикации достаточно противоречивы – от требований ограничиваться репозицией и иммобилизацией [23] до рекомендаций отдавать предпочтение хирургическим методам лечения [24, 25]. В настоящем исследовании все пациенты были оперированы с последующей ранней активизацией. Осложнения составили 0,9%, что соответствует опубликованным данным [26, 27].
Использованный метод функциональной оценки AOFAS хорошо отражает разницу в исходах переломов в области голеностопного сустава. Возможно, что дифференцирование результатов в зависимости от тяжести перелома позволило бы более тонко сравнивать результаты между группами [28], однако такая задача в настоящем исследовании не ставилась. Функциональная оценка позволила отвергнуть гипотезу, будто использование препаратов, воздействующих на качество костной ткани, в частности стронция ранелата, не влияет на функциональный исход лечения переломов лодыжек.
Стронция ранелат является первым препаратом для лечения ОП, увеличивающим костеобразование и замедляющим остеорезорбцию [29]. Специфическое двойное действие препарата обусловлено его воздействием как на остеобласты, так и на остеокласты, что подтверждается изменениями маркеров костного метаболизма [30]. Двойное действие стронция ранелата положительно сказывается на улучшении микро-архитектоники костной ткани. На фоне терапии стронция ранелатом возможна оптимизация функциональных результатов лечения пациентов с остеопоротическими переломами костей [31].
Постмаркетинговые испытания стронция ранелата при лечении ОП и остеоартрита выявили незначительное, но достоверное увеличение частоты инфарктов у женщин, получавших препарат. Заболеваемость составила 3,24, 6,13 и 14,66 на 1000 пациенто-лет для подтвержденного, требовавшего госпитализации и летального инфаркта соответственно. Однако авторы исследования не ассоциировали прием стронция ранелата с повышением риска инфаркта миокарда, поскольку у заболевших присутствовали сочетания других значительных факторов риска [32]. Не была также установлена связь между развитием DRESS-синдрома и приемом стронция ранелата, однако при подозрении на возможные системные реакции рекомендуется прекратить прием препарата [33]. В когортном исследовании, в котором сравнивали эффективность применения алендроната и стронция ранелата, последний не ассоциировался с риском развития коронарного синдрома (частота 5,7 на 1000 человеко-лет для стронция ранелата против 6,3 для алендроната) [34].
Тем не менее при отборе пациентов мы строго придерживались предупреждения Европейского медицинского агентства (после его появления весной 2013 г.) относительно ограничений применения препарата пациентами с ишемической болезнью сердца, заболеваниями периферических сосудов, цереброваскулярными заболеваниями и неконтролируемой артериальной гипертензией. Во время исследования не были отмечены побочные эффекты или осложнения, связанные с приемом препарата.
Факт накопления стронция в костной ткани в экспериментальных условиях был неоднократно подтвержден. Доказано, что 35–45% полученного стронция встраивается в гидроксиапатит кальция, вытесняя ионы кальция. Кроме того, показано, что стронций встраивается в молекулы коллагена. Эти эффекты связаны с полученным животными количеством стронция и продолжительностью введения препарата [35]. На большом экспериментальном материале с проведением парной биопсии продемонстрировано, что образование костной ткани происходит активнее с уменьшением ремоделирования под влиянием стронция ранелата по сравнению с алендронатом [14, 36].
Результаты представляемого исследования подтверждают, что в группе В, пациенты которой получали стронция ранелат, происходит кратное достоверное увеличение содержания стронция в образцах костной ткани. Предложенная в начале исследования нулевая гипотеза, будто стронций не накапливается в зоне формирования костного регенерата, опровергнута. Изучение структуры поверхности костных образцов позволяет считать, что под влиянием стронция ранелата происходят формирование более плотного костного матрикса, увеличение толщины костных балок, восстановление структуры костных канальцев.
В конечном счете нормализация структуры костной ткани в зоне перелома приводит к статистически достоверному улучшению функции оперированного сустава при условии качественных репозиции и фиксации. Таким образом, вторая нулевая гипотеза – стронция ранелат в дозировке 2 г ежедневно не улучшает функциональное состояние оперированного голеностопного сустава – также опровергнута.
Под влиянием терапии системного ОП препаратами кальция, витамина D3 и стронция ранелатом у пациенток с малоэнергетическими переломами проксимального отдела бедра регистрировалась стабилизация показателей минеральной плотности костной ткани. Исследователи также отметили недостоверное улучшение функциональных результатов у пациенток этой группы по сравнению с контрольной [37]. Эти данные согласуются с результатами настоящего исследования.
Представленное исследование не лишено ряда ограничений. Было бы интересно сопоставить данные сканирующей электронной микроскопии с результатами световой микроскопии регенерата. Возможно, что оценка функции голеностопного сустава в зависимости от тяжести травмы и способа оперативного лечения, тяжести ОП позволила бы выработать критерии дифференцированного выбора методов лечения. Однако подобный анализ требует большего количества клинических исследований и, соответственно, затрат на их проведение.
Выводы
Оперативное лечение малоэнергетических переломов лодыжек позволяет получать хорошие клинические исходы для большинства пациентов.
Использование стронция ранелата в дозе 2 г ежесуточно в течение года в послеоперационном периоде улучшает функциональное состояние оперированного голеностопного сустава.
При соблюдении условий применения стронция ранелата улучшается структура костной ткани в зоне регенерирующей кости без побочных эффектов и осложнений.



