Введение
Сахарный диабет 2 типа (СД2) представляет серьезную медико-социальную проблему, актуальность которой обусловлена ростом распространенности заболевания и его осложнений во всем мире. По данным Международной федерации диабета (IDF), в 2014 г. число больных СД во всем мире составило 387 млн человек, 85–90% из них – это пациенты с СД2. К 2035 г. общее число больных СД, по приблизительным оценкам, увеличится в 1,5 раза и составит более 592 млн [1].
СД2 связан со значительным риском развития ишемической болезни сердца, инсульта, артериальной гипертензии, хронической болезни почек, ампутаций нижних конечностей, слепоты [2]. Лечение СД2, основной целью которого является эффективный контроль гликемии, к сожалению, не всегда успешно, что обусловлено как прогрессирующим течением заболевания и снижением функции β-клеток, так и такими нежелательными явлениями, как гипогликемия и увеличение массы тела, которые значительно ухудшают качество жизни пациентов, влияют на их приверженность к лечению и уменьшают значимость результатов снижения уровня гликемии, в первую очередь для риска развития макрососудистых осложнений СД.
Изучение патофизиологии СД2 и отсутствие «идеального» препарата для лечения этого заболевания являются ключевыми факторами в поиске новых возможностей для эффективного управления СД2. Появление нового класса пероральных сахароснижающих препаратов всегда является ярким событием в современной диабетологии. Открытие ингибиторов натрий-глюкозного ко-транспортера 2-го типа и их внедрение в клиническую практику дают врачам и пациентам дополнительные возможности для достижения целевых значений гликемии.
Роль почек в гомеостазе глюкозы
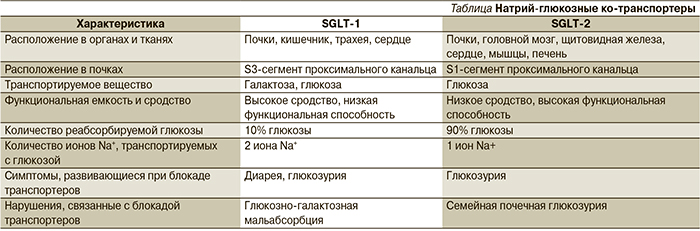
Почки играют значимую роль в поддержании баланса глюкозы в организме человека. В почечных клубочках происходит процесс фильтрации глюкозы. При уровне гликемии ≈5 ммоль/л через почки «проходят» и фильтруются в среднем 160–180 г (900 ммоль) глюкозы в сутки. В проксимальных канальцах происходит обратный захват глюкозы из первичной мочи – реабсорбция – с ее последующим поступлением в кровь. Реабсорбция глюкозы – это сложный эволюционно сложившийся механизм, направленный на поддержание энергетического баланса и сохранение основного источника энергии – глюкозы. Реабсорбция глюкозы в проксимальных канальцах осуществляется при помощи специальных белков-транспортеров – натрий глюкозных ко-транспортеров 1-го и 2-го типов (sodium glucose cotransporter-1, -2; SGLT-1 и -2). SGLT-2 располагаются в начальном отделе проксимального канальца (сегмент S 1), обладают высокой функциональной емкостью и низким сродством к глюкозе. Они отвечают за реабсорбцию 90% глюкозы, проходящей через почки. Транспорт глюкозы осуществляется вместе с ионом натрия. Натрий, проходящий через апикальную мембрану эпителиальных клеток проксимального канальца, создает электрохимический градиент, который позволяет глюкозе пассивно проникать в клетку. Далее натрий в обмен на калий возвращается в кровоток благодаря работе натрий-калиевой аденозинтрифосфатазы. Этот обмен натрия на калий изменяет градиент концентрации внутри клетки, и глюкоза диффундирует до транспортера глюкозы GLUT-2 на базолатеральной мембране, с помощью которого переносится в кровоток (рис. 1) [3, 4].
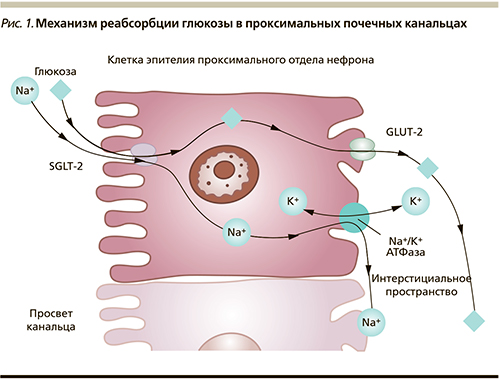
Реабсорбция 10% глюкозы происходит с участием SGLT-1, располагающихся в более дистальных отделах проксимальных канальцев (сегмент S3), обладающих низкой емкостью и высоким сродством к глюкозе. SGLT-1 также располагаются в кишечнике, где они отвечают за абсорбцию глюкозы и галактозы, поступающих с пищей. Сравнительная характеристика SGLT представлена в таблице [3, 4].
Механизмы развития глюкозурии
В почках количество реабсорбируемой глюкозы с участием транспортеров SGLT-1 и SGLT-2 равно количеству глюкозы, профильтрованной клубочками, поэтому в норме глюкоза не поступает в мочу либо определяется в минимальном количестве. Количество белков-переносчиков в апикальной мембране клеток проксимального канальца ограничено. Когда они полностью насыщаются глюкозой, достигается ее максимальная реабсорбция, а избыток глюкозы начинает экскретироваться с мочой, развивается глюкозурия. Величина, характеризующая полную загрузку системы транспорта глюкозы, называется максимальной величиной транспорта глюкозы (TmG) и отражает то количество глюкозы, которое система транспорта проксимальных канальцев способна реабсорбировать за единицу времени. У мужчин эта величина равна 375 мг/мин (2,08 ммоль/мин), а у женщин – 303 мг/мин (1,68 ммоль/мин) при расчете на 1,73 м2 поверхности тела [5]. Таким образом, глюкозурия развивается вследствие превышения максимальной величины транспорта глюкозы в клетках эпителия проксимальных канальцев, что наблюдается при увеличении количества глюкозы, проходящего через просвет проксимального канальца за единицу времени. При увеличении количества глюкозы натрий-глюкозные ко-транспортеры не справляются с нагрузкой (все белки-переносчики уже «заняты» в процессе реабсорбции), и часть глюкозы поступает в мочу, развивается глюкозурия.
Увеличение количества глюкозы, фильтруемого за единицу времени и проходящего через просвет проксимального канальца, возможно по трем причинам [3–5].
1. Повышение концентрации глюкозы крови (гипергликемия) при нормальной скорости клубочковой фильтрации (СКФ). При уровне глюкозы крови, превышающем ≈10 ммоль/л (т.н. почечный порог), почки не в состоянии реабсорбировать всю фильтруемую глюкозу. Гипергликемия в крови приводит к увеличению, соответственно, и количества фильтруемой глюкозы за единицу времени. Именно такой механизм развития глюкозурии наблюдается при СД.
2. Повышение фильтрационной нагрузки. Увеличение СКФ (гиперфильтрация) приводит к тому, что за единицу времени через проксимальные канальцы проходит большее количество ультрафильтрата, а следовательно, и глюкозы, и других веществ. При этом возможно поступление глюкозы в мочу на фоне нормальных значений уровня глюкозы крови. Такой механизм развития глюкозурии может наблюдаться, например, во время беременности и в случае единственной почки [6].
3. Отсутствие SGLT или нарушение их функции. К настоящему времени описана 21 мутация SGLT-2, которая приводит к развитию семейной почечной глюкозурии, например, в результате снижения количества SGLT-2 или уменьшения их сродства к глюкозе. Независимо от типа мутации потеря глюкозы с мочой у таких пациентов может достигать до 100 г в сутки. При этом концентрация глюкозы в крови остается нормальной вследствие повышения скорости продукции глюкозы в печени, что восполняет ее потерю с мочой. Объем плазмы и электролитный баланс остаются нормальными, поскольку жидкость и электролиты, которые не реабсорбируются в проксимальной части канальца, полностью реабсорбируются в более дистальных отделах нефрона. У таких субъектов сохраняется нормальная функция почек и мочевого пузыря, также не увеличивается частота возникновения СД или инфекций мочевыводящих путей.
Доброкачественное течение семейной почечной глюкозурии и данные о роли почек в поддержании гипергликемии при СД2 привели к поискам новых подходов к лечению СД2. Было показано, что у пациентов с СД2 парадоксально увеличивается экспрессия SGLT-2, что сопровождается повышением значения максимального транспорта и увеличением почечного порога для глюкозы. Таким образом, у пациентов с СД2 возрастает реабсорбция глюкозы в почках и глюкозурия развивается при более высоких концентрациях глюкозы в крови по сравнению со здоровыми людьми. Повышение реабсорбции в почках приводит к большему поступлению глюкозы в кровоток и поддержанию гипергликемии при СД. Хроническая гипергликемия усиливает инсулинорезистентность и способствует нарастанию дисфункции β-клеток, ухудшая течение СД2 [3].
Появление нового класса ингибиторов SGLT-2, снижающих реабсорбцию глюкозы в почках, позволяет добиваться контроля гликемии путем выведения избыточного количества глюкозы с мочой и открывает для врача и пациента дополнительные возможности в управлении заболеванием.
Дапаглифлозин – ингибитор SGLT-2
История изучения ингибиторов SGLT-2 началась в 1835 г. с открытия флоризина, выделенного из коры яблочного дерева и использовавшегося как средство для лечения малярии.
В последующем было показано, что применение флоризина приводит к развитию глюкозурии и его использовали в исследовательской деятельности для имитации симптомов диабета. Путь от флоризина, неселективного ингибитора SGLT, до современных препаратов для лечения СД2 занял более 170 лет (рис. 2) [7].
Дапаглифлозин (Форсига℗) – первый ингибитор SGLT-2, зарегистрированный в России в августе 2014 г.
В настоящее время препарат также одобрен в США и странах Европы, где успешно применяется уже на протяжении 1,5 лет (рис. 2) [8–10].
Являясь мощным (Ki: 0,55 нM)селективным обратимым ингибитором SGLT-2, дапаглифлозин снижает реабсорбцию глюкозы в почечных канальцах, что приводит к выведению глюкозы почками. Результатом действия дапаглифлозина является снижение концентрации глюкозы натощак и после приема пищи, а также снижение концентрации гликированного гемоглобина (HbA1c) у пациентов с СД2 [8].
Уникальность механизма действия дапаглифлозина заключается в том, что действие препарата не зависит от секреции инсулина, а также его эффектов, оказываемых на периферические ткани. Это делает возможным применение дапаглифлозина как в дебюте заболевания, так и у пациентов с более длительным течением заболевания, когда функция β-клеток значительно снижена. При этом выведение глюкозы (глюкозурический эффект) наблюдается уже после приема первой дозы препарата, сохраняется в течение последующих 24 часов и продолжается на протяжении всей терапии. Количество глюкозы, выводимой почками за счет этого механизма, зависит только от концентрации глюкозы в крови и от СКФ [8]. Кроме этого важным является тот факт, что фармакологическая глюкозурия, развивающаяся на фоне применения препарата, служит следствием воздействия препарата на одно из звеньев патогенеза СД2 – повышенную реабсорбцию глюкозы.
В среднем при приеме дапаглифлозина выводится примерно 70 г глюкозы в сутки, что сопровождается потерей 280 ккал [8]. Потеря калорий приводит к появлению отрицательного энергетического баланса и как следствие – к снижению массы тела. Доказанное устойчивое снижение массы тела на фоне применения дапаглифлозина является одним из его самых значимых с клинической точки зрения преимуществ, поскольку целый ряд сахароснижающих препаратов способствует увеличению массы тела у пациентов с СД2, большинство из которых уже имеют избыточную массу тела или ожирение.
Дапаглифлозин назначается в дозе 10 мг в любое время суток независимо от приема пищи. Коррекция дозы необходима только в случае тяжелой печеночной недостаточности: у таких пациентов лечение следует начинать с 5 мг и в случае хорошей переносимости доза может быть увеличена до 10 мг [8].
В России препарат зарегистрирован в настоящее время как дополнение к диете и физическим нагрузкам в качестве монотерапии, добавления к терапии метформином, к стартовой комбинации с метформином [8]. Основанием для регистрации таких показаний стала обширная доказательная база клинических исследований 3-й фазы. Клинические исследования продемонстрировали эффективность препарата в отношении снижения показателей гликемии как в монотерапии, так и в комбинации с метформином (рис. 3) [11–16].
Монотерапия: 24-недельное двойное слепое плацебо-контролируемое исследование 3-й фазы с включением параллельных групп (n=485) показало, что назначение дапаглифлозина пациентам с исходным HbA1c 7–10%, ранее не получавшим медикаментозного лечения, сопровождается статистически значимым снижением HbA1c. Снижение HbA1c через 24 недели составило -0,23% в группе плацебо и -0,89% в группе дапаглифлозина 10 мг (p<0,0001 против плацебо). Динамика у пациентов с исходным HbA1c более 9% была более выраженной и соста-вила в группе дапаглифлозина -1,4% [11].
Добавление к метформину: оценка эффективности добавления дапаглифлозина к метформину была проведена в двух многоцентровых рандомизированных двойных слепых плацебо-контролируемых исследованиях. В первом 24-недельном исследовании 546 пациентам с исходным HbA1c ≥ 7,0% и ≤10,0%, получавшим стабильную дозу метформина в дозе ≥1500 мг в сутки, к терапии были добавлены дапаглифлозин 10 мг или плацебо. Через 24 недели среднее снижение HbA1c в группе плацебо составило -0,3% (95% ДИ=-0,44; -0,16) по сравнению с -0,84% (95% ДИ=-0,98; -0,70, p<0,0001) в группе дапаглифлозина 10 мг. В группе, получавшей дапаглифлозин+метформин, скорректированное среднее снижение глюкозы плазмы натощак (ГПН) к 24-й неделе относительно исходного уровня было значимо больше по сравнению с группой монотерапии метформином (-1,3 ммоль/л по сравнению с -0,3 ммоль/л, p<0,0001). Доля пациентов, у которых был достигнут HbA1c<7%, была значимо больше в группе, получавшей дапаглифлозин+метформин, по сравнению с группой метформина (40,6% против 25,9%, p=0,0062).
В группе, получавшей дапаглифлозин+метформин, было отмечено более выраженное снижение массы тела, чем в группе монотерапии метформином (-2,89 кг и -0,89 кг соответственно, p<0,0001) [12]. По результатам долгосрочного наблюдения на 102-й неделе в группе дапаглифлозина 10 мг+метформин наблюдалось более выраженное снижение изучаемых показателей относительно исходного уровня по сравнению с группой плацебо: HbA1c -0,78% против +0,02%, p<0,0001; ГПН -24,5 мг/дл против 10,4 мг/дл, p=0,0012; масса тела -1,74 кг против +1,36 кг, p<0,0001. Преимущества, отмеченные на 24-й неделе, сохранялись вплоть до 102-й недели. Данные исследования позволяют утверждать, что терапия дапаглифлозином не только позволяет добиваться снижения показателей гликемии и массы тела, но и сохранить достигнутые результаты в течение 2 лет [13].
В другом исследовании, прямом сравнительном с производным сульфонилмочевины глипизидом, пациентам с СД2 и неадекватным контролем гликемии (HbA1c >6,5% и ≤10,0%) на фоне монотерапии метформином в дозе ≥1500 мг в сутки дополнительно назначался либо дапаглифлозин, либо глипизид. К 52-й неделе среднее снижение HbA1c относительно исходного уровня составило 0,52% в обеих группах лечения; среднее снижение HbA1c в группе дапаглифлозина было достоверно не менее значимым, чем в группе глипизида. У пациентов с СД2 обе схемы лечения обеспечивали клинически значимое снижение HbA1c, определяемое как снижение более чем на 0,5%. В группе дапаглифлозина наблюдалось небольшое дополнительное снижение вплоть до 52-й недели, тогда как в группе глипизида данный показатель изменялся в противоположную сторону. Кроме этого в группе, получавшей дапаглифлозин+метформин, среднее снижение общей массы тела относительно исходного уровня было с клинической и статистической значимостью больше, чем в группе глипизида (-3,2 и -1,2 кг соответственно, p<0,0001).
Терапия дапаглифлозином обеспечивала более выраженное уменьшение окружности талии (-2,33 см), маркера висцерального ожирения, относительно исходного уровня по сравнению с терапией глипизидом (+1,09 см; p<0,0001) [14]. По результатам долгосрочного наблюдения на 104-й неделе в группе дапаглифлозина наблюдалось более выраженное снижение изучаемых показателей относительно исходного уровня по сравнению с группой плацебо: HbA1c -0,32% против -0,14%, p=0,0211; ГПН -1,12 ммоль/л против -0,68 ммоль/л, p=0,003; масса тела -3,7 кг против + 1,4 кг, p<0,0001.
Поскольку препарат дапаглифлозин обладает инсулиннезависимым механизмом действия, его применение не связано с увеличением риска гипогликемии, что и было продемонстрировано в данном исследовании. Через 104 недели частота гипогликемий в группе дапаглифлозина была достоверно ниже, чем в группе глипизида, – 4,2% по сравнению с 45,8% (p<0,0001) [15].
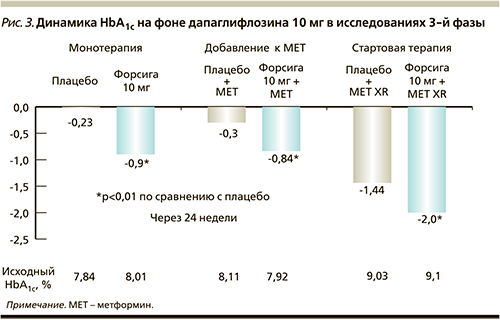
Стартовая комбинация с метформином: не менее интересными представляются и результаты исследования, в котором пациентам с СД2, ранее не получавшим медикаментозного лечения, назначалась исходно комбинация метформина пролонгированного действия (XR) и дапаглифлозина либо монотерапия дапаглифлозином 10 мг или метформином XR. Анализ сопоставимой эффективности для изменения HbA1c относительно исходного уровня (вторичная конечная точка) показал, что между группами монотерапии дапаглифлозином 10 мг и метформином XR была продемонстрирована неменьшая эффективность в отношении изменений HbA1c по сравнению с исходным уровнем – -1,45 и -1,44% соответственно. Комбинация дапаглифлозина и метформина XR была более эффективной в отношении снижения HbA1c – динамика составила 2% через 24 недели применения. В группе, получавшей дапаглифлозин+метформин XR, скорректированное среднее снижение общей массы тела относительно исходного уровня было с клинической и статистической значимостью больше, чем в группах монотерапии дапаглифлозином и метформином (-3,33 кг, -2,73, -1,36 кг соответственно; p<0,0001). В группе монотерапии дапаглифлозином снижение общей массы тела было с клинической и статистической значимостью больше, чем в группе монотерапии метформином (-2,73 кг против -1,36 кг, p<0,0001) [16].
Важным критерием при выборе препарата для лечения СД2 служит его безопасность. Стоит отметить, что дапаглифлозин обладает хорошим профилем безопасности и переносимости. Был проведен анализ объединенных данных 12 плацебо-контролируемых исследований по оценке безопасности, в который включили 1193 пациента, принимавших дапаглифлозин в дозе 10 мг, и 1393 пациента, получавших плацебо. По результатам данного анализа общая частота развития нежелательных явлений у пациентов, принимавших дапаглифлозин в дозе 10 мг, была сопоставимой с таковой в группе плацебо. Количество нежелательных явлений, приведших к отмене терапии, было небольшим и сбалансированным между группами лечения. Наиболее частыми нежелательными явлениями, приводившими к отмене терапии дапаглифлозином, были повышение концентрации креатинина в крови (0,4%), инфекции мочевыводящих путей (0,3%), тошнота (0,2%), головокружение (0,2%) и сыпь (0,2%) [8].
С учетом того что назначение дапаглифлозина приводит к развитию фармакологической глюкозурии, безусловно, возникает ряд вопросов, касающихся безопасности с точки зрения постоянного наличия повышенной концентрации глюкозы в моче. Например, поскольку глюкоза является осмотически активным веществом, встает вопрос о том, что происходит с реабсорбцией воды и развиваются ли у пациентов, принимающих ингибитор SGLT-2, полиурия и последующее снижение объема циркулирующей крови (ОЦК)? Действительно, у пациентов, получавших препарат Форсига (дапаглифлозин), наблюдалось увеличение частоты поллакиурии и полиурии, что согласуется с диуретическим эффектом препарата. По данным клинических исследований, диурез на фоне приема дапаглифлозина увеличивается в среднем на 375 мл, что по объему соответствует примерно одному дополнительному мочеиспусканию [8]. В вышеуказанном анализе безопасности 12 плацебо-контролируемых исследований явления дизурии (включая полиурию, поллакиурию) регистрировались у 2,1% пациентов, получавших препарат, и у 0,7%, получавших плацебо [17]. В краткосрочных плацебо-контролируемых исследованиях частота никтурии была несколько выше в группе дапаглифлозина 10 мг (0,5%) по сравнению с плацебо (0,3%) [17]. Нежелательные реакции, связанные со снижением ОЦК (включая сообщения об обезвоживании, гиповолемии или артериальной гипотензии), отмечены у 0,8% и 0,4% пациентов, принимавших дапаглифлозин 10 мг и плацебо соответственно; серьезные реакции отмечены менее чем у 0,2% пациентов, и они были сопоставимы в группах дапаглифлозина 10 мг и плацебо [8]. Поскольку гемоконцентрация, особенно в сочетании с другими факторами риска, может служить предрасполагающим фактором к тромбоэмболии, был выполнен анализ тромбоэмболических нежелательных явлений на основании показателей гематокрита и гемоглобина. Средние изменения значения гематокрита от исходных значений составили +2,15% в группе дапаглифлозина 10 мг по сравнению с -0,40% в группе плацебо [8]. Важно отметить, что увеличение гематокрита не сопровождалось увеличением частоты тромбоэмболий по данным анализа 12 плацебо-контролируемых исследований [18]. Тем не менее следует рекомендовать пациентам принимать достаточное количество жидкости, а также сообщать о любых признаках дегидратации, включая следующие: сильная сухость во рту или вязкая слюна, сильное чувство жажды, резкая сонливость или усталость, малый объем или отсутствие мочи. При подтвержденном снижении ОЦК рекомендуется временное прекращение приема дапаглифлозина до коррекции этого состояния. Следует отметить, что применение препарата Форсига не оказывает клинически значимого влияния на концентрации электролитов в сыворотке крови [8].
Генитальные инфекции отмечены у 4,8 и 0,9% пациентов, принимавших дапаглифлозин 10 мг и плацебо соответственно. Большинство инфекций были слабо или умеренно выраженными; курс стандартной терапии был эффективным, в связи с чем пациенты редко прекращали прием дапаглифлозина. Инфекции мочевыводящих путей отмечены несколько чаще при применении дапаглифлозина 10 мг, чем при применении плацебо (4,3% по сравнению с 3,7% соответственно), без достоверной разницы между группами. Большинство инфекций были слабо или умеренно выраженными; аналогично генитальным инфекциям курс стандартной терапии был эффективным, в связи с чем пациенты также редко прекращали применение дапаглифлозина. Частота развития пиелонефрита была редкой и сопоставимой между группами [8].
Результаты проведенных исследований свидетельствуют, что применение дапаглифлозина не оказывало отрицательного влияния на функцию почек. По данным уже упомянутого объединенного анализа 12 клинических рандомизированных плацебо-контролируемых исследований, применение дапаглифлозина было связано с транзиторным снижением расчетной СКФ (рСКФ) на первой неделе терапии и последующим увеличением этого показателя до исходных значений (82,53 мл/мин/1,73 м2) или выше. Далее показатель рСКФ оставался стабильным в течение 2 лет. На 102-й неделе в обеих группах было отмечено увеличение рСКФ, которое составило: +2,02 мл/мин/1,73 м2 в группе дапаглифлозина и +0,66 мл/мин/1,73 м2 в группе плацебо. Кроме того, через 102 недели частота нежелательных явлений, связанных с почками, составила 2% в группе дапаглифлозина и 1,6% в группе плацебо. В большинстве случаев все события были связаны с изменением лабораторных показателей, были нетяжелыми и носили обратимый характер. Серьезных нежелательных явлений отмечено не было. Также не было отмечено дисбаланса между группами в отношении серьезных нежелательных явлений, включая развитие почечной недостаточности или снижение функции почек, прогрессирование нефропатии, случаи острой нефропатии, связанной с приемом препарата [17, 18].
Стоит акцентировать внимание на следующем: в связи с механизмом действия эффективность ингибиторов SGLT-2, в частности препарата Форсига, зависит от функции почек и снижается у пациентов с почечной недостаточностью средней степени и, по всей видимости, отсутствует у пациентов с тяжелой почечной недостаточностью. Следовательно, и эта информация отражена в инструкции по медицинскому применению препарата, дапаглифлозин не рекомендовано использовать пациентам с почечной недостаточностью средней или тяжелой степени (клиренс креатинина <60 мл/мин или рСКФ <60 мл/мин/1,73 м2) [8]. Мониторинг функции почек при применении препарата Форсига рекомендуется проводить следующим образом:
- до начала терапии и не реже 1 раза в год впоследствии;
- до начала приема сопутствующих лекарственных препаратов, которые могут снижать функцию почек, и периодически впоследствии;
- при нарушении функции почек, близком к умеренному, по крайней мере 2 раза в год;
- при снижении функции почек ниже значения клиренса креатинина <60 мл/мин или оцениваемой СКФ <60 мл/мин/1,73 м2 необходимо прекратить прием дапаглифлозина [8].
У пациентов с почечной недостаточностью легкой степени необходимость в коррекции дозы отсутствует. В то же время каких-либо специальных рекомендаций по контролю функции печени перед началом терапии Форсигой, а также на протяжении приема данного препарата нет [8]. Как уже было сказано выше, терапия препаратом Форсига характеризуется низким риском развития гипогликемии, поскольку при низкой концентрации глюкозы в плазме крови увеличивается пропорция глюкозы, реабсорбируемой при помощи SGLT-1 из клубочкового фильтрата. Кроме того, ингибирование SGLT-2 не влияет на контринсулярные механизмы регуляции гомеостаза глюкозы [8].
В клинических исследованиях общая доля пациентов со злокачественными или неуточненными опухолями была схожей в группе дапаглифлозина (1,47%) и группе плацебо/препарата сравнения (1,35%). Согласно данным исследований на животных, препарат не проявлял канцерогенных или мутагенных свойств. При рассмотрении случаев развития опухолей различных систем органов относительный риск, ассоциированный с дапаглифлозином, был выше 1 для некоторых опухолей (мочевой пузырь, предстательная железа, молочная железа) и ниже 1 для других (например, кровь и лимфатическая система, яичники, мочевыделительная система), в целом без повышения риска развития опухолей, ассоциируемого с дапаглифлозином. Повышенный/пониженный риск не был статистически значимым ни для одной системы органов. С учетом отсутствия в доклинических исследованиях сведений о развитии опухолей, а также короткого латентного периода между первой экспозицией препарата и диагностикой опухоли причинно-следственная связь оценивается как маловероятная. Однако, т.к. численный дисбаланс опухолей молочной железы, мочевого пузыря и предстательной железы требует особого внимания, изучение этого вопроса будет продолжено в рамках пострегистрационных исследований [8, 17, 18].
При применении препарата Форсига следует соблюдать осторожность пациентам, для которых вызванное дапаглифлозином снижение артериального давления может представлять риск, например для пациентов с сердечно-сосудистыми заболеваниями в анамнезе, пациентов с артериальной гипотензией в анамнезе, получающих антигипертензивную терапию, или для пожилых пациентов. Важно, что терапия препаратом Форсига не сопровождалась повышением сердечно-сосудистого риска для пациентов с СД2, что подтверждено результатами анализа 19 исследований фазы 2b/3 с участием более 5000 пациентов. Первичная комбинированная конечная точка в данном анализе включала оценку частоты сердечно-сосудстой смерти, инсульта, инфаркта миокарда и госпитализации по поводу нестабильной стенокардии. Анализ показал, что на фоне применения препарата Форсига относительный риск наступления событий первичной конечной точки равен 0,819 [18]. Опыт применения препарата пациентами с сердечной недостаточностью I–II функциональных классов по классификации NYHA ограничен, и в ходе клинических исследований дапаглифлозин не применялся пациентами с сердечной недостаточностью III–IV функциональных классов по NYHA. Таким образом, препарат Форсига может быть назначен пациентам с сердечной недостаточностью с осторожностью [8].
Заключение
Итак, современные врачи-диабетологи становятся свидетелями внедрения в практику абсолютно нового инновационного инсулиннезависимого подхода в управлении СД. Обладая высокой селективностью, доказанной эффективностью в отношении показателей гликемии, а также хорошим профилем безопасности и переносимости, первый представитель класса ингибиторов SGLT-2, препарат Форсига, зарегистрированный в России, открывает новые возможности помощи широкому кругу пациентов независимо от длительности заболевания и сохранности функции β-клеток.


