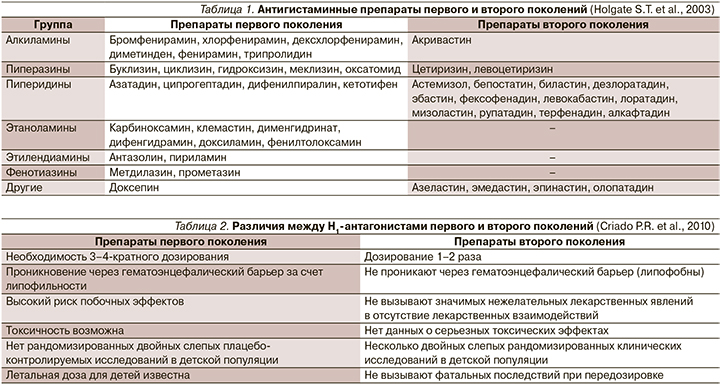
Внастоящее время антигистаминные препараты (АГП) широко представлены на фармацевтическом рынке и относятся к наиболее часто используемым лекарственным средствам для лечения аллергических заболеваний (АЗ; табл. 1) [1]. Уже давно известно, что механизм их действия далеко не исчерпывается способностью связываться с Н1-гистаминовыми рецепторами, но также характеризуется воздействием на другие медиаторы – участники аллергического воспаления [2].
Наиболее широко используемыми на сегодняшний день являются Н1-блокаторы II поколения. Опыт применения во многих странах подтвердил их безопасность и терапевтическую эффективность при различных АЗ, благодаря чему они вытесняют АГП I поколения, превосходя их по ряду параметров (табл. 2) [3]. Так, в рекомендательных документах по лечению аллергического ринита (АР) и хронической крапивницы оговаривается отказ от АГП I поколения [4, 5].
Особое место эбастина среди АГП II поколения обусловлено тем, что он является единственным представителем этой группы лекарств, для которого официально зарегистрировано две возможные терапевтические дозировки – 10 и 20 мг. Ранее определенная вариативность суточной дозы допускалась при использовании некоторых препаратов I поколения [6], которые в настоящее время в значительной степени потеряли свою актуальность. Наличие двух разрешенных дозировок эбастина дает возможность, с одной стороны, безопасно оптимизировать лечение больного, с другой – избежать излишних юридических формальностей при необходимости использования более высокой дозы.
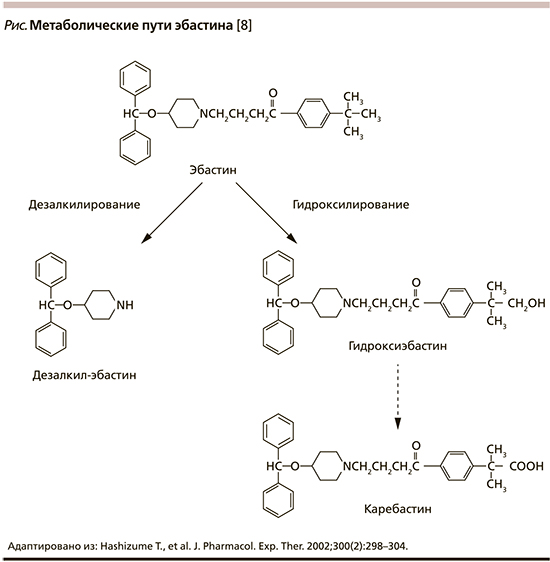
Эбастин – селективный антагонист гистаминовых Н1-рецепторов II поколения группы производных пиперидина (табл. 1). Для его создания через атом азота в структуре дифенилпиралина к пиперидиновому кольцу была присоединена длинная алифатическая боковая цепь, что обеспечило большую продолжительность действия, низкую стимулирующую активность в отношении центральных Н1-гистаминовых рецепторов, безопасность для сердечно-сосудистой системы [7]. Известно, что препарат быстро метаболизируется в кишечнике и печени до активного соединения каребастина (см. рисунок), которое и проявляет соответствующие фармакологические свойства [2, 8].
В многочисленных исследованиях показан благоприятный профиль безопасности эбастина. Так, в дозе 10 мг эбастин редко вызывает седативный эффект, поскольку связывается лишь приблизительно с 10% Н1-гистаминовых рецепторов в головном мозге, в то время как хлорфенирамин – с 50% [7]. В 5 исследованиях длительностью 2–3 недели по изучению кардиотропного действия эбастина была проведена оценка данных ЭКГ и суточного холтеровского мониторирования у 1202 обследованных [9]. Не обнаружено зависимого от дозы (от 1 до 30 мг/сут) увеличения интервала QT и, следовательно, возникновения связанного с ним синдрома полиморфной желудочковой тахикардии. По данным Е.М. Лукьяновой и соавт., препарат в 5-кратной терапевтической дозе (50 мг) не оказывает влияния на артериальное давление, частоту сердечных сокращений и слюноотделение [7]. Кроме того, J. Gispert показал отсутствие клинически значимого эффекта при удлинении интервала QT на несколько миллисекунд при случайном однократном применении препарата в дозе 500 мг (25–50-кратное превышение рекомендованной терапевтической дозы) [10].
Эбастин характкризуется высокой биодоступностью. Прием пищи не влияет на скорость наступления клинического эффекта [2].
Выраженное противоаллергическое действие начинается через 1 час после однократного приема эбастина в дозе 10 или 20 мг и продолжается в течение 48 часов. После 5-дневного курса лечения антигистаминная активность сохраняется на протяжении 72 часов, что значимо для высокой комплаентности лечения, поскольку дает возможность пропустить прием дозы эбастина без риска возобновления симптомов заболевания [2]. Значительная продолжительность действия препарата объясняется способностью его активного метаболита примерно на 98% связываться с белками сыворотки крови, образуя внеклеточное депо и медленно выделяясь из него в виде свободной формы [7].
Основной путь экскреции каребастина – через почки и в меньшей степени – с калом. Период полувыведения препарата, по-видимому, не зависит от использованной дозы и составляет 15–19 часов, что обусловливает целесообразность однократного применения в сутки при гистамин-зависимых заболеваниях [7].
Больным, страдающим тяжелой почечной и печеночной недостаточностью, эбастин следует назначать с осторожностью, т.к. в этих случаях фармакокинетический профиль каребастина изменяется из-за более медленной элиминации. Так, при почечной недостаточности период полувыведения возрастает до 23–26, при печеночной – до 27 часов [7].
Изменять режим дозирования при лечении пожилых больных не требуется, поскольку разница в фармакокинетике разовой дозы эбастина и его равновесной концентрации у лиц старше 65 лет, не имеющих патологии со стороны печени и почек, и пациентов молодого возраста отсутствует [7, 11].
Не обнаружено взаимодействия каребастина с этанолом и диазепамом, что избавляет от необходимости менять образ жизни или принимаемое по поводу других заболеваний лечение [2].
Применение эбастина с лечебной целью в настоящее время показано при АР (как сезонном, так и круглогодичном), идиопатической хронической крапивнице, аллергических заболеваниях и состояниях, обусловленных повышенным высвобождением гистамина.
В клинических исследованиях, проведенных на большом контингенте пациентов с АЗ, были показаны выраженная клиническая эффективность и благоприятный профиль безопасности препарата.
Изучение клинической эффективности эбастина при АР в двойных слепых плацебо-контролируемых исследованиях продемонстрировало увеличение терапевтического эффекта при повышении дозы с 10 до 20 мг/сут, однако хорошая переносимость препарата при этом сохранялась, а нежелательные лекарственные явления отсутствовали [2]. Обращает на себя внимание, что эбастин оказывает положительное влияние на все симптомы АР (как интермиттирующего, так и персистирующего), в т.ч. на заложенность носа, добиться контроля над которой обычно представляет наибольшую проблему. Отмечено, что эбастин в дозе 20 мг/сут улучшает сон, что косвенно свидетельствует о полноценном круглосуточном контроле симптомов заболевания [2].
О.С. Бодня и соавт. [12] представили результаты сравнительного клинического исследования эффективности, безопасности и влияния на качество жизни больных сезонным АР терапии эбастином в дозе 20 мг, а также цетиризином и лоратадином в дозах 10 мг. Анализ динамики симптомов сезонного АР в 1-й, 11-й и 21-й дни показал статистически значимое снижение их выраженности в результате лечения всеми препаратами, однако снижение частоты и выраженности симптомов АР у пациентов на фоне применения эбастина происходил быстрее и значимый клинический эффект отмечался уже к 3–4-му дню терапии. Все препараты продемонстрировали благоприятный профиль безопасности, за время проведения исследования значимых нежелательных явлений зарегистрировано не было.
Сравнительное изучение эффективности и безопасности эбастина и лоратадина при круглогодичном АР проводилось с привлечением 317 больных в возрасте 12–68 лет, имевших выраженные признаки заболевания [13]. Оценка таких показателей, как круглогодичный индекс (КИ=чихание+зуд в носу+выделения из носа) и общий носовой индекс (ОНИ=КИ+заложенность носа), показала статистически намного более выраженное улучшение при применении эбастина в дозах 10 и 20 мг по сравнению с лоратадином в дозе 10 мг по всем параметрам, кроме чихания, зуда и глазных симптомов. За 4 недели средний показатель ОНИ снижался в указанных группах на 44, 47 и 32% соответственно, при этом разница в эффективности терапии была очевидной уже через неделю после ее начала. Лечение переносилось хорошо, неблагоприятных последствий не наблюдалось.
М.В. Авксентьевой и соавт. [14] проведен клинико-экономический анализ применения при АР эбастина однократно 20 мг/сут по сравнению с лоратадином 10 мг/сут. Показано, что эбастин в большей степени снижает выраженность клинических симптомов (снижение ОНИ на 3,03±2,11 и 2,08±1,78 балла при применении эбастина и лоратадина соответственно; p<0,0001) и приводит к улучшению состояния у большего числа пациентов (82 и 65% соответственно; p<0,001). Стоимость 4-недельного лечения несколько была выше для эбастина, чем для лоратадина, но соотношение «затраты/эффективность» оказалось более благоприятным для эбастина.
Помимо способности связываться с Н1-рецепторами препарат обладает рядом дополнительных противоаллергических эффектов. Так, эбастин ингибирует высвобождение простагландина D2, лейкотриенов C4/D4 и цитокинов, таких как гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ), фактор некроза опухоли α и интерлейкин-8, клетками назальных полипов [15]. Препарат также редуцирует уровень ГМ-КСФ в назальном секрете, уменьшает назальную эозинофилию, количество эозинофилов в периферической крови и концентрацию эозинофильного катионного протеина (ЭКП) в плазме [16].
О.С. Бодня и соавт. [12] определяли уровень ЭКП в назальном лаваже до назначения фармакотерапии эбастином, цетиризином и лоратадином, а также после окончания 14-дневного курса лечения. В результате проведенного исследования отмечено, что у пациентов, получавших эбастин в дозе 20 мг, наблюдалась хотя и недостоверная, но устойчивая тенденция к снижению уровня ЭКП (на 37,9% от исходных значений), в то время как при приеме лоратадина и цетиризина в дозах 10 мг изменения в содержании ЭКП оказались невеликими.
Определенная клиническая эффективность эбастина продемонстрирована не только у больных АР, но и при бронхиальной астме.
Влияние препарата на воспаление в нижних дыхательных путях изучали T. Horiguchi et al. [17]. В исследование были включены 23 больных астмой (13 – с атопической и 10 – с неатопической), получавших 10 мг эбастина в течение 4 недель. При определении уровня сывороточного ЭКП, количества эозинофилов в периферической крови, а также функциональных параметров – пиковой скорости выдоха и степени бронхиальной гиперреактивности до начала и после окончания исследования – показано, что у пациентов с атопической БА имело место статистически значимое снижение уровня ЭКП (с 25±3 до 16,3±2,4 мг/л; р<0,0014) и числа эозинофилов в периферической крови (с 468,2±44,4 до 417,3±47,8 мм3; р<0,0253); пиковая скорость выдоха значительно повысилась у больных атопической астмой (с 410,9±16,1 до 440±19,1 л/мин; р<0,0189). Вместе с тем у пациентов с неатопической астмой эти изменения оказались незначительными, а влияния препарата на степень бронхиальной гиперреактивности отмечено не было. Таким образом, в этом небольшом пилотном исследовании была показана способность эбастина редуцировать эозинофильное воспаление в нижних дыхательных путях у больных атопической бронхиальной астмой, что нашло отражение в снижении маркеров эозинофильного воспаления и улучшении результатов дыхательных тестов.
Высокая клиническая эффективность и безопасность эбастина продемонстрированы у больных крапивницей.
При лечении острой крапивницы показана меньшая эффективность 10 мг эбастина по сравнению с 20 мг. Так, на 1-й неделе лечения с помощью дозы 10 мг полного исчезновения симптомов не удалось достичь, в то время как с помощью 20 мг оно было обеспечено 10% больных, хотя через 4 недели лечения их количество было сопоставимым (15/50 и 20/50 пациентов; p=0,2). Сходный эффект с 20 мг эбастина был продемонстрирован для 5 мг левоцетиризина, однако последний отличался худшей переносимостью [18]. Частота развития седативного эффекта, сонливости, сухости во рту, головной боли при лечении эбастином не зависела от дозы и во всех случаях была достоверно ниже, чем у пациентов, принимавших левоцетиризин [18].
Терапия хронической спонтанной крапивницы АГП II поколения в течение 2 месяцев показала сопоставимость эффективности эбастина 20 мг, цетиризина 10 мг, фексофенадина 180 мг, биластина 20 мг и дезлоратадина 5 мг [19].
В клинических рекомендациях последних лет отмечается необходимость увеличения дозы АГП II поколения для достижения значимого терапевтического эффекта [5]. Из имеющихся на фармацевтическом рынке современных АГП только для эбастина допускается удвоение дозы. Несомненный интерес представляет препарат, содержащий 20 мг эбастина в одной таблетке.
Результаты ряда исследований подтвердили эффективность и безопасность эбастина в дозе 20 мг для больных крапивницей [11]. Установлено, что подавление кожной реактивности сохраняется в течение 4 дней после прекращения лечения и это обеспечивает очень важное условие терапии крапивницы – непрерывность достигнутого эффекта даже при случайном пропуске приема препарата.
Увеличение дозы эбастина до 5-кратной при хронической спонтанной крапивнице не вызвало значимых седации и когнитивных нарушений, а также клинически значимого удлинения интервала QT [20].
Высокая эффективность эбастина описана при применении в дозе 20 мг ежедневно в течение 7 дней 22 больными холодовой крапивницей, которым проводилась провокация холодом [21]. В этом исследовании только у четверых появились волдыри после лечения эбастином, тогда как после лечения плацебо они возникли у 17 пациентов. Число больных, испытывающих умеренный или сильный кожный зуд, также снизилось до 5 после лечения эбастином, тогда как после лечения плацебо их было 18.
Однократное назначение эбастина в дозе 20 мг эффективно при дермографической крапивнице [22].
В российском исследовании [23] продемонстрирована способность эбастина в дозе 20 мг эффективно контролировать кожный зуд не только при крапивнице, но и при атопическом дерматите.
Представляют интерес полученные в эксперименте данные об ускорении зарастания пятен очаговой алопеции под влиянием эбастина [24], что авторы объясняют вмешательством препарата в патогенез эозинофильного воспаления. Несколько ранее T. Okamoto et al. показали, что в отличие от антигистаминной активности подавление синтеза провоспалительных цитокинов обусловлено самим эбастином, а не его активным метаболитом [25].
Таким образом, вышеописанные свойства эбастина обусловливают его выраженную клиническую эффективность и благоприятный профиль безопасности. В настоящее время эбастин – единственный представитель H1-блокаторов II поколения, для которого официально разрешена возможность гибкого дозирования.



