Одной из важнейших проблем терапевтической гастроэнтерологии, практики врачей скорой помощи, участковых терапевтов и даже абдоминальной хирургии является хроническая абдоминальная боль (АБ). Подходы к терапии данного патологического состояния разнообразны, а спектр фармакологических препаратов, используемых для купирования хронической АБ, достаточно широк. Тем не менее, четкого алгоритма при выборе лекарственного средства для купирования абдоминальной боли не существует, и выбор тактики лечения болевого абдоминального синдрома подчас является затруднительным в связи с многообразием причин и механизмов его развития.
Определенную сложность представляет трактовка механизмов формирования болевого синдрома при функциональных заболеваниях пищеварительной системы, т.е. хронической АБ функционального характера. Для этого в настоящее время используются Римские критерии-III, т.е. критерии третьего пересмотра положений о функциональных расстройствах пищеварительного тракта (2006) [1, 2]. Согласно этим критериям, в качестве возможных причин и механизмов развития функциональных расстройств органов пищеварения определены нарушения моторики, висцеральная гиперчувствительность внутренних органов; показана роль воспаления, а также влияния психосоциальных факторов и нарушения регуляции основных функций желудочно-кишечного тракта (ЖКТ) – центральной, периферической, гуморальной.
Кроме того, Римские критерии-III содержат классификацию функциональных гастроинтестинальных расстройств [1, 2]:
А. Пищеводные расстройства:
А1. Комок в горле.
А2. Регургитация, срыгивание.
А3. Функциональная боль за грудиной – преимущественно пищеводного генеза.
А4. Функциональное жжение за грудиной.
А5. Функциональная дисфагия.
А6. Неспецифические (неопределенные) пищеводные дисфункции.
В. Гастродуоденальные расстройства (функциональная диспепсия, аэрофагия, функциональная тошнота и рвота, постпрандиальный дистресс-синдром, эпигастральный болевой синдром).
C. Кишечные расстройства:
C1. Синдром раздраженного кишечника (СРК).
C2. Функциональное вздутие живота.
C3. Функциональный запор.
C4. Функциональная диарея.
C5. Неспецифические (неопределенные) функциональные расстройства кишечника.
D. Функциональная АБ:
D1. Синдром функциональной АБ.
D2. Неспецифическая (неопределенная) АБ.
Е. Билиарные расстройства:
Е1. Дисфункция желчного пузыря.
Е2. Дисфункция сфинктера Одди (по билиарному, панкреатическому типам).
F. Аноректальные расстройства.
G. Функциональные расстройства у детей.
Патогенетические механизмы формирования АБ крайне разнообразны, поскольку ЖКТ находится под влиянием многих регуляторных систем, таких как центральная нервная система (ЦНС), периферическая нервная система (симпатическая и парасимпатическая), энтеральная нервная система, а также нейротрансмиттеров. Нарушения процесса взаимодействия между органами ЖКТ и регуляторными системами приводят к моторным нарушениям как гипертонического, так и гипо- и даже атонического характера; также могут иметь место сочетанные варианты нарушения моторики, следствием чего является появление у пациента жалоб на АБ [3, 4]. При этом одной из наиболее частых причин развития АБ считается спазм. Следовательно, ведущими препаратами, используемыми в клинической практике с целью купирования абдоминального болевого синдрома, являются спазмолитики [5, 6] (см. таблицу).
Кроме спазмолитиков для купирования синдрома АБ используются препараты с другими точками и уровнями воздействия на регуляцию гладкомышечных сокращений ЖКТ:
- аналоги соматостатина;
- антагонисты холецистокинина;
- антагонисты 5-гидрокситриптамина-3;
- антидепрессанты;
- полный агонист периферических опиоидных рецепторов тримебутин.
В связи с разнообразием лекарственных средств купирования болевого абдоминального синдрома, а также разнообразия причин, его вызывающих, необходимо внедрять в клиническую практику новые высокотехнологичные методы обследования и лечения с целью оптимизации выбора и дифференцированного подхода к терапии. В настоящее время для адекватного подбора корригирующей терапии, учитывающего преобладающий у пациента тип нарушений моторики, возможно использование электрофизиологического метода – периферической электрогастроэнтерографии (ЭГЭГ). Данное исследование становится в настоящее время все более популярным и распространенным, о чем свидетельствует множество исследовательских работ, посвященных ЭГЭГ [10–12]. В основе метода лежат представления, согласно которым гладкомышечные ткани определенных зон ЖКТ действуют как электрические водители ритма – пейсмейкеры; от них волна деполяризации распространяется на другие отделы кишечной трубки, и именно это свойство гладкомышечной ткани определяет моторно-эвакуаторную функцию ЖКТ.
 Существует два варианта ЭГЭГ:
Существует два варианта ЭГЭГ:
Прямая ЭГЭГ, когда регистрация электрических потенциалов проводится с помощью вживленных в стенку органа электродов или со стороны слизистой оболочки с помощью электродов зонда.
Периферическая (непрямая) ЭГЭГ, когда регистрация электрической активности проводится с поверхности тела – брюшной стенки или конечностей – при помощи поверхностных электродов.
К недостаткам прямой ЭГЭГ, ограничивающим ее использование в широкой клинической практике, относятся необходимость имплантировать электроды в стенку органа и невозможность оценки биоэлектрической активности всех отделов ЖКТ одновременно.
При проведении периферической ЭГЭГ допустима регистрация электрической активности органов ЖКТ как в целом, так и в каждом отделе (желудок, двенадцатиперстная, тощая, подвздошная и толстая кишки), а также определение соотношений изменений электрической активности располагающихся рядом отделов, что отражает скоординированность работы пищеварительной трубки. Преимуществами данной методики служат ее неинвазивный характер и простота выполнения, что позволяет назначать ее так часто, как это необходимо без отрицательного влияния на психику пациента и его приверженность к обследованию.
Благодаря этому существует возможность длительного беззондового исследования моторной деятельности различных отделов ЖКТ при различных состояниях [7, 8]:
- натощак;
- после пищевой стимуляции приемом стандартного завтрака;
- после приема различных лекарственных препаратов;
- для длительного мониторинга моторно-эвакуаторной функции ЖКТ (от 2 до 48 часов), что особенно важно для диагностики функциональной патологии.
Возможность проведения многократных исследований позволяет оценивать моторно-эвакуаторную функцию ЖКТ как до, так и в процессе лечения, а также при необходимости индивидуальной коррекции терапии. У методики периферической ЭГЭГ отсутствуют противопоказания, кроме обширных гнойных поражений передней брюшной стенки.
Для проведения периферической ЭГЭГ в нашей клинике используется гастроэнтеромонитор ГЭМ-01 «Гастроскан-ГЭМ», созданный НПП «Исток-Система» (г. Фрязино). В данном устройстве оцениваемый сигнал электрической активности ЖКТ обрабатывается оригинальной программой с использованием алгоритмов быстрого преобразования Фурье и Вейвлет. Аппарат обеспечивает прием и регистрацию сигнала с накожных электродов, а также хранение, обработку и документальное представление получаемой информации.
При анализе результатов периферической ЭГЭГ оцениваются следующие параметры:
- уровень электрической активности суммарный (PS);
- уровень электрической активности по каждому из обследуемых отделов ЖКТ (Pi); при этом оценивается адекватность ответа на прием стандартного завтрака: в норме после его приема суммарная электрическая активность и электрическая активность отдельных отделов ЖКТ должны увеличиваться приблизительно в 1,5 раза;
- Р(i)/PS, %, – относительная электрическая активность каждого отдела ЖКТ, представляет собой отношение абсолютных значений электрической активности в каждом отделе Р(i) к суммарной активности PS; рассчитывается отдельно для каждого отдела ЖКТ;
- коэффициент соотношения P(i)/P(i+1) представляет собой отношение электрической активности вышележащего отдела к нижележащему;
- коэффициент ритмичности Kritm отражает ритмичность сокращений, с его помощью можно оценить характер пропульсивных сокращений каждого отдела ЖКТ.
Стандартное исследование электрической активности ЖКТ включает два этапа:
1-й – тощаковое исследование в течение 40 минут;
2-й – стандартный с исследованием электрической активности ЖКТ после стандартного завтрака (пищевая стимуляция) в течение 40 минут или модифицированный с исследованием электрической активности ЖКТ на фоне приема лекарственного средства для адекватного подбора корригирующей терапии конкретному пациенту, а также оценки ее эффективности.
С целью оценки эффективности различных спазмолитиков в купировании АБ нами были проанализированы данные ЭГЭГ пациентов с СРК, получавших лечение в клинике гастроэнтерологии кафедры пропедевтики внутренних болезней СЗГМУ им. И.И. Мечникова. Периферическая ЭГЭГ проводилась по следующей схеме:
- до начала терапии;
- после первого приема спазмолитического препарата;
- через 10 дней на фоне курсового приема спазмолитика.
Изначально у всех пациентов имели место изменения электрической активности ЖКТ по данным ЭГЭГ. Определялось повышение показателей Р(i)/PS, Kritm, P(i)/P(i+1) натощак и после пищевой стимуляции на частотах желудка, двенадцатиперстной, тонкой и толстой кишки, а также избыточное нарастание Р(i) после пищевой стимуляции. Усиление двигательной активности органов ЖКТ вызывало развитие гипермоторной дискинезии, клинически проявлявшейся АБ спастического характера; именно это определило выбор препаратов группы спазмолитиков в качестве терапии для купирования симптомов СРК у этих больных. В схемах терапии использовались следующие спазмолитические препараты: дротаверин, мебеверин, гиосцина бутилбромид (Бускопан).
В результате сравнительного анализа было установлено, что на фоне курсового приема различных препаратов спазмолитического действия отмечено снижение таких показателей, как суммарная мощность (PS) и мощность по каждому из отделов Р(i) натощак и после пищевой стимуляции, отсутствие избыточного нарастания Р(i) в верхних отделах на фоне пищевой стимуляции, а также нормализация (в данном случае – снижение) таких показателей, как Kritm, P(i)/P(i+1) натощак и после пищевой стимуляции на частотах желудка, двенадцатиперстной, тонкой и толстой кишки (рис. 1).
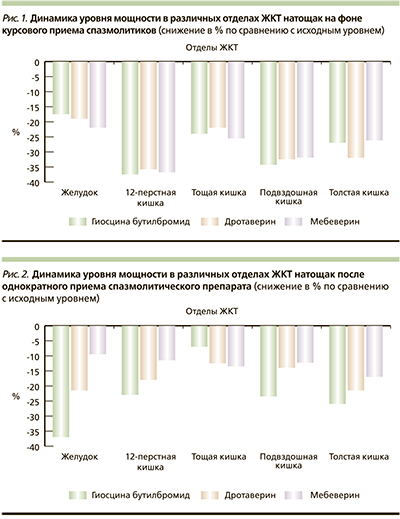 Из представленных данных (рис. 1) видно, что все препараты оказались эффективны, т.е. на фоне курсового приема имело место практически сопоставимое снижение уровня мощности сокращений в различных отделах ЖКТ (Р(i)), что свидетельствует о снижении сократительной активности, и как следствие – уменьшение выраженности/купирование абдоминального болевого синдрома спастического характера. Следует подчеркнуть, что статистически значимых различий между используемыми спазмолитиками при проведении ЭГЭГ на фоне их курсового приема выявлено не было, нежелательных побочных явлений также не наблюдалось.
Из представленных данных (рис. 1) видно, что все препараты оказались эффективны, т.е. на фоне курсового приема имело место практически сопоставимое снижение уровня мощности сокращений в различных отделах ЖКТ (Р(i)), что свидетельствует о снижении сократительной активности, и как следствие – уменьшение выраженности/купирование абдоминального болевого синдрома спастического характера. Следует подчеркнуть, что статистически значимых различий между используемыми спазмолитиками при проведении ЭГЭГ на фоне их курсового приема выявлено не было, нежелательных побочных явлений также не наблюдалось.
При анализе данных ЭГЭГ, проведенных в течение 40 минут на фоне однократного (первого) приема сравниваемых препаратов (рис. 2), имела место другая картина. Было установлено, что прием гиосцина бутилбромида приводил к более быстрому проявлению спазмолитических свойств по сравнению с другими препаратами этой группы, что выражалось в более выраженном снижении моторной активности по таким показателям, как суммарная мощность (PS) и мощность по каждому из отделов Р(i), как следствие – наблюдалось более быстрое купирование АБ.
Таким образом, при разовом приеме наибольшую спазмолитическую активность в короткий промежуток времени показал гиосцина бутилбромид. Вероятнее всего, это объясняется тем, что в основе быстрого спазмолитического эффекта данного препарата лежит воздействие уже на первом этапе развития спазма (активация М-холинорецепторов мышечного волокна), что наряду с присущим препарату ганглиоблокирующим действием обусловливает скорое наступление клинического эффекта [9, 13], не оказывая при этом (за счет высокой селективности) системных эффектов, присущих прочим препаратам холинолитического действия. Спазмолитик гиосцина бутилбромид (Бускопан) показал себя как эффективное средство терапии «по требованию» для купирования абдоминального болевого синдрома, что позволяет рекомендовать его использование для этих целей в широкой клинической практике.
Вместе с тем, принимая во внимание тот факт, что при анализе данных ЭГЭГ пациентов с СРК на фоне курсового приема не отмечено статистически достоверных различий в активности между спазмолитическими препаратами различных групп, а безопасность селективных М3-холинолитиков доказана многолетними исследованиями и опытом использования (не более 0,00000025 %
всех зарегистрированных побочных эффектов имеют антихолинергичекую природу) [14, 15], целесообразно рекомендовать продолжение терапии, направленной на купирование абдоминальной боли, с использованием гиосцина бутилбромида, т.е нет необходимости в замене спазмолитического препарата при назначении курсового лечения.
Рекомендации Национального института здравоохранения и клиниче-ского мастерства Великобритании (NICE) по диагностике и лечению СРК в первичной помощи указывают, что «...спазмолитические средства, такие как гиосцина бутилбромид, являются препаратами первой линии в диагностике и управлении общими симптомами пациентов с СРК» [16, 17], а результаты метанализа Форда, основываясь на данных об эффективности и безопасности препарата, также рекомендуют использование гиосцина бутилбромид как препарата первой линии при лечении абдоминальной боли у больных с СРК [18, 19].
Кроме того, согласно литературным данным [20, 21], использование селективных М3-холиноблокаторов со спазмолитической целью не только эффективно устраняет абдоминальный болевой синдром, но и приводит к уменьшению гиперчувствительности, а также снижению активности провоспалительных процессов в стенке кишечника, что также немаловажно с учетом различия механизмов возникновения АБ, и, кроме того, обусловливает назначение данных препаратов именно курсом.
Благодаря всем вышеперечисленным преимуществам гиосцина бутилбромида (Бускопан®), производства немецкой компании Берингер Ингельхайм, можно считать это лекарственное средство «золотым стандартом» спазмолитической терапии.



