Гранулематоз с полиангиитом (ГПА) (Вегенера) – один из АНЦА-ассоциированных васкулитов (ААВ), который обычно протекает с тяжелыми висцеральными поражениями, определяющими прогноз для большинства пациентов [1, 2]. В последние годы активно изучается проблема тромботических осложнений при ААВ. Так, по данным мировой литературы, частота развития тромботических осложнений в остром периоде ААВ значительно превышает общепопуляционную и составляет от 2 до почти 8% [5, 6], несмотря на проведение активного иммуносупрессивного лечения [3, 4]. В целом тромботические осложнения отмечаются у 8–16% больных ГПА [7], однако патогенез развития подобных сосудистых катастроф до конца не изучен [8, 9]. Предполагается, что ключевая роль в повышении риска венозных и артериальных тромбозов принадлежит генерализованной дисфункции эндотелия, однако не исключается влияние и других к настоящему моменту не установленных факторов. Нельзя исключить, что определенная доля тромботических осложнений при ААВ может быть обусловлена наличием вторичной криофибриногенемии.
Криофибриногенемия – один из видов криопротеинемии, при котором из плазмы больного можно выделить специфический преципитирующий протеин – криофибриноген. Впервые криофибриногенемия была выявлена в 1955 г. Д. Корстом у больного аденокарциномой легкого и множественными тромбофлебитами [10]. В отличие от криоглобулинов, которые определяются в сыворотке крови, криофибриноген можно выделить исключительно из плазмы при охлаждении до 4◦С в течение 7 суток [11–13].
Патогенез криофибриногенемии продолжает активно изучаться. Одна из наиболее распространенных гипотез предполагает дефект фибринолитического процесса. При этом повышается синтез в печени α1-антитрипсина, α2-макроглобулина, ингибитора активатора плазминогена-1 и замедляется лизис эуглобулинов [14–16].
В результате ингибируется плазмин, что приводит к подавлению фибринолиза. Происходит изменение структуры фибриногена, который связывается с фибрином и фибронектином и вызывает тромботические окклюзии. Однако в некоторых случаях повышение уровней α1-антитрипсина и α2-макроглобулина в плазме не наблюдается, в связи с чем выдвинута другая гипотеза. По аналогии с врожденной дисфибриногенемией мутировавший фибриноген с конформационными изменениями и нарушенной способностью связываться с тромбином может вызывать образование тромбов, например, после охлаждения [6, 15]. В результате развиваются «гипервязкость», рефлекторный спазм сосудов и стаз, возникают тромботические поражения средних и мелких сосудов [17, 18].

Распространенность криофибриногенемии в здоровой популяции колеблется от 0 до 7%, среди всех госпитализированных – от 8 до 13% [15, 23–29], однако ее частота резко возрастает в группе больных, страдающих различными ишемическими осложнениями (инсульт, инфаркт, тромбозы сосудов конечностей), и достигает 51%.
Криофибриногенемия может протекать как бессимптомно, так и с явлениями васкулопатии. Основными клиническими проявлениями считаются язвы, пурпура, сетчатое ливедо, синдром Рейно, артериальные тромбозы, дигитальный некроз, гангрена, которая впоследствии может приводить к ампутации конечности см. таблицу) [15–17, 19, 20]. Гистологически определяются гиалиновые тромбы, облитерированные просветы сосудов, утолщенные фиброзированные стенки сосудов [21]. Данных о системных проявлениях немного, чаще всего описываются артериальные тромбозы, есть единичные данные о поражении микрососудистого русла легких и почек [22].
Выделяют эссенциальную (первичную – 30–50%) и вторичную, ассоциированную с инфекционными, онкологическими, ревматическими и другими заболеваниями криофибриногенемию [6, 15, 23]. Среди заболеваний соединительной ткани чаще всего криофибриноген обнаруживают у больных системной красной волчанкой, болезнью Шегрена, системной склеродермией, при этом у таких пациентов значительно чаще развиваются тромботические осложнения. В мировой литературе имеются единичные описания криофибриногенемии, ассоциированной с ААВ [6].
Клиническое наблюдение
Больная 29 лет, менеджер, с 2004 г. впервые стала отмечать заложенность носа, боли в проекции левой гайморовой пазухи. Неоднократно обращалась к ЛОР-врачам, состояние расценивалось как обострение хронического гайморита, проводилась антибактериальная терапия без эффекта. С лета 2005 г. появилась язва на нижней трети левой голени, проводилось местное лечение без эффекта. В феврале 2006 г. развились боли в мелких суставах кистей, их гиперемия и отечность.
К началу мая отмечено почернение кожи дистальных фаланг левой кисти с резким усилением боли в этих областях. Кроме того, появились язвы на боковой поверхности языка и на слизистой оболочке неба. В июне 2006 г. при стационарном обследовании было обнаружено повышение СОЭ до 73 мм/ч, СРБ до 4 норм, а также анемия до 87 г/л (рис. 1).
Во время нахождения в стационаре развилась одышка, появились кашель с пенистой мокротой, кровохарканье. По данным компьютерной томографии органов грудной клетки – множественные инфильтраты с полостями распада. Впервые были выявлены суммарные АНЦА (специфичность не уточнена) и диагностирован ГПА, начата активная иммуносупрессивная терапия: внутривенно введено 1000 мг циклофосфамида и 4000 мг метилпреднизолона с последующим переходом на его пероральный прием в дозе 48 мг/сут. В результате массивной иммуносупрессивной терапии отмечено обратное развитие признаков васкулита, исчезновение кровохарканья, разрешение инфильтратов в легких, однако площадь язвенно-некротических дефектов увеличивалась. В сентябре 2006 г. в связи с распространяющимися некрозами на нижних и верхних конечностях и восходящей гангреной выполнена ампутация обеих ног – слева выше колена, справа сохранена верхняя треть голени, также ампутированы дистальные фаланги пальцев кистей. По данным гистологического исследования – множественные тромбозы мелких сосудов. После выписки из стационара цитостатических препаратов не получала, рекомендовано постепенное снижение дозы глюкокортикоидов, на фоне которого, однако, возник рецидив: в октябре 2009 г. появились кровянистые корочки в носу, вновь образовались язвы на культе правой голени, ягодицах, возникли боли в области верхней челюсти слева. В феврале 2010 г. больная впервые госпитализирована в клинику им. Е.М. Тареева. При поступлении выраженное язвенно-некротическое поражение культей ног, ягодиц, рук. Выявлена высокая лабораторная активность заболевания: увеличение СОЭ до 37 мм/ч, СРБ до 4,5 норм, анемия до 85 г/л, лейкоцитоз, протеинурия до 1,2 г/сут, микрогематурия. При компьютерной томографии – поражение верхнечелюстных пазух и орбит, инфильтраты с формированием полостей распада в легких (рис. 2).
Выявлено повышение титра АНЦА к протеиназе-3 более 100 МЕ/мл. Высокая клинико-лабораторная активность болезни обусловила проведение массивного иммуносупрессивного лечения. Выполнено два сеанса сочетанной «пульс-терапии» метилпреднизолоном и циклофосфамидом в дозах 1500 и 500 мг соответственно. Доза перорального метилпреднизолона была увеличена до 24 мг/сут.
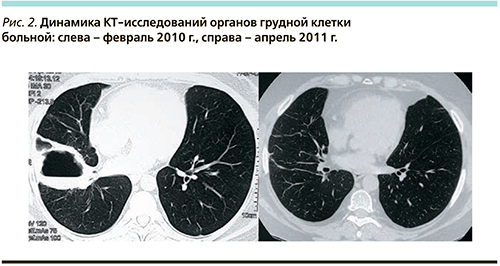
Отмечено снижение лабораторной активности заболевания, однако по-прежнему сохранялись крайне выраженные кожные поражения. При целенаправленном исследовании впервые выявлена криофибриногенемия в отсутствие криоглобулинемии. Начато лечение фраксипарином с быстрой положительной динамикой со стороны кожных поражений: к 4-му месяцу лечения отмечена полная эпителизация кожных дефектов. В дальнейшем больная была переведена на пероральный прием варфарина с поддержанием целевого МНО от 2 до 3. С учетом сохранения ремиссии основного заболевания с марта 2012 г. циклофосфамид заменен на азатиоприн, который больная принимает в настоящий момент в дозе 50 мг/сут, дозу метилпреднилозона удалось снизить до 2 мг/сут; продолжает принимать варфарин, новых кожных поражений нет. На компьютерной термограмме легких – отчетливая положительная динамика в виде исчезновения полости распада (рис. 2).
Таким образом, данное клиническое наблюдение демонстрирует, насколько наличие криофибриногенемии может изменить течение АНЦА-ассоциированного васкулита.
Мировой опыт лечения криофибриногенемической васкулопатии ограничен. В отдельных наблюдениях при нетяжелом течении показано, что симптоматического лечения (например, отмена сосудосуживающих препаратов) и изменения образа жизни больного (отказ от курения) достаточно для исчезновения клинических проявлений криофибриногенемии [15, 19, 20]. Есть описание единичных наблюдений, подтверждающих эффективность тромболитиков при лечении тяжелых форм [16, 17, 20, 30]. Некоторое время назад обнадеживающие результаты показывал станазолол (анаболический гормон) [31–35]. Плазма- и криоферез можно использовать при высоком риске потери конечности как средство спасения, однако эти методы эффективны только на непродолжительный срок, после которого достаточно высок риск рецидива [15, 36–38]. Использо-вание антикоагулянтов (гепарин или антагонисты витамина К) ограничивается случаями венозных тромбозов. В отдельных наблюдениях была показана эффективность применения гепарина [6, 19, 39], в других отмечено прогрессирование симптомов [15, 16, 19]. Изучалось применение глюкокортикоидов в сочетании с низкими дозами аспирина [15], амлодипина [16] при средней тяжести течения, однако однозначно обнадеживающих результатов получено не было.
При вторичном генезе криофибри-ногенемии часто эффективно применение глюкокортикоидов в сочетании с цитостатиками (азатиоприн, хлорамбуцил) [15–17, 19, 20]. Но при отмене или снижении доз иммуносупрессивного лечения в 40–76% случаев в течение 6 месяцев происходит рецидив [15, 16, 19]. К тому же активная иммуносупрессивная терапия не всегда позволяет контролировать проявления криофибриногенемии, что и демонстрирует наше клиническое наблюдение.
Пациенты с криофибриногенемией должны длительное время находиться под наблюдением врача и проходить регулярные обследования в связи с риском рецидива, а также для исключения развития лимфомы [16, 17]. В одном из проспективных исследований течения эссенциальной криофибриногенемии у 23 больных выявлено 11 случаев развития лимфом (6 Т- и 5 B-лимфом) [19]. У больных, у которых впоследствии развилась лимфома, изначально отмечено более тяжелое течение криофибриногенемии: некроз кожи, развитие гангрены, почечных повреждений (почечная недостаточность, протеинурия и/или гематурия), невритов и более высокая частота рецидивов, несмотря на лечение [19].
Таким образом, криофибриногенемия является редким и нередко нераспознанным заболеванием, которое может приводить к инвалидизации больного и резкому снижению качества жизни. При наличии симптомов криопатии необходимо исключать наличие данного феномена. Подбор адекватного лечения позволяет избегать прогрессирования тяжелых осложнений и нередко спасти жизнь больного.


