Эпидемия ожирения находится на подъеме в течение последних четырех десятилетий и не проявляет никаких признаков ослабления. Ожирение является одной из наиболее важных проблем общественного здравоохранения из-за своих общих ассоциаций со многими хроническими заболеваниями, включая метаболический синдром, сахарный диабет 2 типа, сердечно-сосудистые заболевания, дислипидемию [1, 2]. Сексуальная дисфункция тоже может быть связана с ожирением, однако данное нарушение редко обсуждается, даже несмотря на то что сексуальные нарушения оказывают выраженное негативное влияние на качество жизни и психологическое состояние как самого мужчины, так и его сексуального партнера. Наиболее распространенная проблема– эректильная дисфункция (ЭД), которая определяется «как неспособность достигать или поддерживать эрекцию, достаточную для совершения полового акта; встречающаяся в 50 % и более случаев половых контактов» [3]. Результаты исследований показали, что ЭД в три раза чаще встречается среди мужчин с ожирением [4–9].
Однако патофизиологическая связь между данными состояниями еще недостаточно изучена. Известно, что висцеральное ожирение приводит к развитию следующих отклонений: повышению активности воспалительных реакций, что приводит к дисфункции эндотелия; снижению уровня тестостерона в плазме, что способствует развитию гипогонадизма и повышает риск развития сосудистой патологии. В свою очередь эндотелиальная дисфункция и дефицит андрогенов приводят к развитию ЭД [10].
Липотоксичность и эндотелиальная дисфункция
Хорошо известна роль эндотелия в физиологии эректильной функции, и не секрет, что любой фактор, способствующий дисфункции эндотелия, безусловно, вносит значительный вклад и в сексуальную функцию. Это подтверждается тем фактом, что гемодинамика полового члена зависит от целостности сосудистого русла. Так, Esposito и соавт. [11] предположили, что у мужчин с ожирением эндотелиальная дисфункция может приводить к развитию ЭД, т к. уменьшается кровоток и нарушается агрегация тромбоцитов. Кроме того, снижается активность оксида азота, что влияет на релаксацию гладкой мускулатуры.
Так, частые союзники ожирения – инсулинорезистентность, гипергликемия, высокая концентрация свободных жирных кислот (СЖК) и хроническое воспаление – приводят к повреждению эндотелия и атеросклерозу. Эндотелиальная дисфункция приводит к снижению уровня оксида азота, который играет важную роль в поддержании целостности сосудистого русла [12–14]. Оксид азота замедляет развитие атеросклероза путем ингибирования адгезии тромбоцитов и лейкоцитов к стенке сосуда, а также снижает пролиферацию гладкой мускулатуры сосудов [14].
Помимо повышения уровня триглицеридов и холестерина у больных ожирением в сыворотке наблюдается повышенные уровня СЖК, что может приводить к развитию липотоксичности – патологического изменения в клетках или органах, подвергшихся воздействию повышенного уровня жирных кислот в крови или тканях (Unger, 2003). Этот процесс наносит непоправимый вред клеточному гомеостазу и жизнеспособности клеток.
Связанное с дислипидемией повышение уровня СЖК вызывает дисфункцию эндотелия за счет увеличения производства свободных радикалов путем активации протеинкиназы С, в итоге приводя к снижению активности NO-синтазы [14]. Ожирение также может способствовать увеличению жесткости артерий [13]. Гиперинсулинемия и гипергликемия локально активируют систему ренин-альдостерон-ангиотензин, что вызывает повышенную экспрессию рецепторов к ангиотензину-1, а также последующий сосудистый фиброз и гипертрофию [13]. Эти вышеупомянутые процессы демонстрируют зависимость между ожирением и эндотелиальной дисфункцией.
Гипогонадизм и лептин
Существует множество доказательств, согласно которым тестостерон не только играет для мужчин важную роль в аспектах сексуального здоровья, но и оказывает влияние на мышцы, костную систему, эритропоэз и даже на уровень глюкозы и липидный обмен [15]. Низкий уровень тестостерона в значительной степени связан c ожирением [16–19].
Связующим звеном между гипогонадизмом и ожирением может быть лептин [20, 21]. Напомним, что лептин – это белок, относящийся к цитокинам, синтезируется в основном адипоцитами и участвует в регуляции потребления и утилизации энергии [22]. Ряд исследований продемонстрировал, что сывороточный лептин напрямую связан с индексом массы тела [21, 22] и обратно коррелирует с уровнем общего тестостерона [23, 24].
Комплексный подход к лечению ЭД
Основную роль в лечении ЭД у мужчин с ожирением наравне с препаратами, направленными на нормализацию эрекции, должна занимать терапия, способствующая снижению массы тела. Лечение ЭД и ожирения необходимо проводить одномоментно, т.к. одновременное существование этих двух патологий поддерживает депрессивное состояние, что значительно ухудшает прогноз лечения. Поэтому мужчинам с ожирением и ЭД необходимо комбинированное лечение, направленное как на снижение массы тела, так и на сексуальную дисфункцию.
Известно, что снижение массы тела может замедлять или останавливать снижение уровня тестостерона и глобулина, связывающего половые гормоны. Так, Niskanen и соавт. показали, что снижение массы тела у мужчин с ожирением в течение 12 месяцев увеличивает уровень свободного тестостерона и снижает риск гипогонадизма [25].
Одним из препаратов выбора для больных ожирением является сибутрамин – препарат, механизм действия которого обусловлен селективным ингибированием обратного захвата серотонина и норадреналина и в меньшей степени – допамина. Данный препарат ускоряет наступление и пролонгирует чувство насыщения, что приводит к уменьшению потребления пищи. Самым изученным препаратом в РФ, содержащим сибутрамин, в настоящее время является Редуксин®, комплексный препарат, в состав которого входят два активных вещества – сибутрамин и микрокристаллическая целлюлоза. Терапия препаратом Редуксин® позволяет большинству пациентов (56 %) добиваться клинически значимого снижения массы тела (≥ 5 %) уже после 12 недель лечения. При этом 20 % пациентов удалось снизить массу тела более чем на 10 % от исходного [26]. Однако влияние сибутрамина на уровни СЖК и лептина мало изучено. Так, Х. Gao и соавт. показали достоверное снижение уровня СЖК в группе пациентов, получавших сибутрамин, к тому же авторы отметили улучшение показателей гликемии, липидного профиля и индекса HOMA-IR – Homeostasis Model Assessment of Insulin Resistance [27].
Также на базе Московского государственного медико-стоматологического университета было проведено исследование «Влияние сибутрамина на половую функцию у мужчин с ожирением», в результате которого авторы пришли к выводу, что терапия сибутрамином в сочетании с диетотерапией способствует увеличению содержания тестостерона, что приводит к улучшению эректильной функции, повышает либидо и улучшает андрогенный статус мужчин с ожирением [28].
Перспективным направлением является воздействие на различные звенья этиопатогенеза ЭД путем комбинированной терапии и применения растительных препаратов [29]. К одним из таких препаратов относится Райлис® – комплексное средство растительного происхождения (порошок корней женьшеня настоящего, женьшеня ложного, астрагала перепончатого, кодонопсиса мелковолосистого и экстракта травы горянки) для лечения ЭД. Так, проведенное исследование на кафедре урологии Московского государственного медико-стоматологического университета показало эффективность Райлиса при лечении ЭД легкой и средней тяжести. Кроме того, было отмечено, что помимо улучшения показателей копулятивного цикла в целом произошло значимое увеличение психогенной и эректильной составляющих. Согласно данным опросников, результаты применения Райлиса можно считать положительными во всех случаях [30].
Таким образом, целью нашего исследование стало определение эффективности комплексного подхода к лечению ЭД у мужчин с ожирением.
Материал и методы
В настоящем исследовании использованы данные обследования больных, выполненного на базе кафедры эндокринологии и диабетологии Российской медицинской академии последипломного образования (РМАПО), а также кафедры урологии РМАПО. Обследование больных включило общий осмотр, измерение массы тела и определение индекса массы тела (ИМТ), измерение окружности талии и окружности бедер, комплекс биохимических исследований сыворотки крови и гормонального профиля, заполнение опросника «Международный индекс эректильной дисфункции-5 (МИЭФ-5)», опросника «Симптомы старения мужчины» (анкета AMS).
Критериями включения в исследование стали следующие параметры: возраст 30–60 лет, ИМТ более 30 кг/м2, пациенты, набравшие при анкетировании с помощью шкалы МИЭФ-5 менее 22 баллов. В результате была сформирована группа из 69 больных ожирением и ЭД. Средний их возраст составил 46,0 ± 7,4 года.
Согласно задачам исследования, больные, включенные в исследование, были разделены на 3 группы.

В группу I включены 17 пациентов, получавших Редуксин® (сибутрамин + микрокристаллическая целлюлоза) в течение 24 недель и в течение 12 недель – препарат, содержащий комплекс биологически активных компонентов, предназначенный для лечения ЭД (Райлис®).
В группу II вошли 22 пациента, получавших Редуксин® в течение 24 недель.
В группу III были включены 30 пациентов, которым была рекомендована программа снижения веса на основе низкокалорийной диеты и увеличения физической нагрузки.
Выделенные группы были сопоставимыми по возрасту, выраженности ожирения, сопутствующей патологии и получаемой по этому поводу медикаментозной терапии.
Для анализа использовался пакет статистических данных SPSS.
Результаты
Исходно основная и контрольная группы были сопоставимы по выраженности и продолжительности нарушений половой функции (U-критерий Манна–Уитни, р > 0,05) и их распространенности (точный критерий Фишера, р > 0,05).
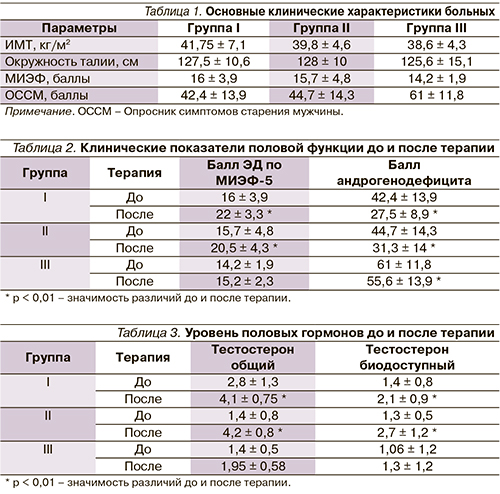
Основные клинические характеристики больных по группам представлены в табл. 1.
Все пациенты страдали выраженным абдоминальным ожирением. По данным анкетирования, во всех группах была выявлена ЭД средней степени тяжести (11–15 баллов), по данным ОССМ – средневыраженный андрогенодефицит в I и II группах и выраженный андрогенодефицит – в III.
Эффективность терапии оценивали через 6 месяцев лечения. Снижение ИМТ в среднем составило в группе I 6 ± 0,35 кг/м2, в группе II – 3,2 ± 0,1, в группе III – 0,7 ± 0,2 кг/м2. Как видно, наиболее выраженное снижение массы тела было отмечено в группе, находившейся на комбинированной терапии. Мы это связываем с тем, что компоненты Райлиса® оказывают общетонизирующее и биостимулирующее действие на организм мужчины.
Комбинированная терапия и монотерапия сибутрамином сопровождались статистически значимым улучшением клинических показателей половой функции (табл. 2).
Как видно из представленных в табл. 2 данных, балл по шкале МИЭФ-5 увеличился на фоне терапии сибутрамином и Райлисом и монотерапии сибутрамином с 16 ± 3,9 до 22 ± 3,3 и с 15,7 ± 4,8 до 20,5 ± 4,3 соответственно; в контрольной группе на фоне диетотерапии повышение балла эректильной функции с 14,2 ± 1,9 до 15,2 ± 2,3 не было достоверным (p = 0,09).
Выраженность симптомов андрогенодефицита по балльной шкале ОССМ достоверно (p < 0,01) уменьшилась во всех трех группах, но наиболее выраженное снижение отмечено в группе на комбинированной терапии.
При исследовании гормонального статуса (табл. 3) выявлено статистически значимое повышение уровня общего тестостерона и биодоступного тестостерона как в I, так и во II группе (p < 0,01).
В то время как у пациентов, находящихся на программе по снижению массы тела, уровень общего тестостерона повысился с 1,4 ± 0,5 до 1,95 ± 0,58 нмоль/л (p = 0,06) и биодоступный – с 1,06 ± 1,2 до 1,3 ± 1,2 нмоль/л (p = 0,12), в контрольной группе на фоне диетотерапии уровень биодоступного тестостерона возрос недостоверно, что объясняет отсутствие достоверного улучшения половой функции в контрольной группе, т.к. именно биодоступный тестостерон обуславливает клинические эффекты. При этом в группах I и II была выявлена достоверная прямая умеренная корреляция между снижением массы тела и увеличением уровня общего тестостерона (I – r = 0,36; р = 0,005; II – r = 0,5; р = 0,005) и прямая умеренная корреляция между снижением массы тела и увеличением уровня свободного тестостерона (I – r = 0,4; р < 0,001; II – r = 0,51; р = 0,005), что демонстрирует положительное влияние снижения массы тела на содержание андрогенов. Кроме того, была выявлена обратная умеренная корреляция между снижением массы тела и баллом андрогенного дефицита, оцененного по шкале ОССМ (I – r = -0,3; р = 0,013; II – r = -0,27; р = 0,005 ), что подтверждает положительное влияние снижения массы тела не только на содержание андрогенов, но и на соматический статус и половую функцию.
Далее, следуя цели нашего исследования, мы проанализировали корреляцию некоторых СЖК и лептина с половыми гормонами, с ЭД и выраженностью симптомов андрогенодефицита.
Связующим звеном между гипогонадизмом и ожирением может быть лептин. Нами была выявлена достоверная обратная корреляция между лептином и уровнем свободного тестостерона: r = -0,443, p < 0,05. Лептин имел также выраженную обратную корреляцию с баллами МИЭФ-5 (r = -0,902, p < 0,001) и прямую корреляцию с баллом андрогенного дефицита (r = 0,510, p < 0,005). В группах I и II отмечено достоверное (p < 0,001) уменьшение концентрации лептина в I группе с 41,3 ± 13,8 до 15,7 ± 9,5 и с 35,8 ± 16 до 21,9 ± 12 после 6 месяцев лечения. В контрольной группе уровень лептина увеличился с 54,2 ± 23,6 до 65,90 ± 24,2.

Известно, что на фоне ожирения образуется большое количество СЖК, обладающих потенциалом токсичности и реализующих метаболические нарушения в органах-мишенях. Так, мы выявили обратную корреляцию между уровнями линолевой (r = -0,487, p < 0,01), стеариновой (r = -0,721 p < 0,05), олеиновой (r = -0,888 p < 0,01) кислот и содержанием свободного тестостерона. К тому же была выявлена положительная корреляция между баллом МИЭФ-5 и уровнями стеариновой и линолевой кислот (p = 0,069, p = 0,042 соответственно).
В нашем исследовании через 24 недели терапии в группах I и II отмечено достоверное уменьшение концентрации СЖК (рис. 1–3). В контрольной группе, напротив, достоверного изменения уровня СЖК до начала программы снижения массы тела и через 24 недели наблюдения выявлено не было (рис. 4).
Обсуждение
Несмотря на наличие множества работ, патогенез нарушения половой функции, обусловленный ожирением, полностью не изучен, по-прежнему предметом дискуссии остается проблема определения основных патогенетических звеньев. Важным моментом для изучения является наличие возможного положительного эффекта терапии, направленной на снижение массы тела, при нарушениях половой функции у мужчин с ожирением.
В итоге анализа результатов лечения больных исследуемых групп мы пришли к следующему заключению: терапия больных ЭД и ожирением сибутрамином является эффективным методом лечения. Во всех случаях назначения сибутрамина удалось увеличить суммарный балл МИЭФ на 3–12 баллов. Причем в группе на комплексной терапии увеличение балла МИЭФ-5 было незначительно выше – с 16 ± 3,9 до 22 ± 3,3. Что касается балла выраженности симптомов андрогенодефицита, то в I группе он снизился на 15 баллов, в то время как в группах II и III – на 13 и 6 баллов соответственно. Это позволяет сделать вывод: комплексная терапия, включающая сибутрамином + микрокристаллическую целлюлозу (Редуксин®) и Райлис® эффективнее, чем монотерапия препаратом, содержащим сибутрамин. Однако, учитывая положительного результата и в I и во II группе, можно сделать вывод, согласно которому терапия ЭД при ожирении с помощью сибутрамина является патогенетической.
Поскольку влияние лептина и СЖК на эректильную функцию мало изучено, мы оценили роль данных показателей, их взаимосвязь с половыми гормонами и их изменения на фоне лечения. Известно, что связующим звеном между снижением уровня тестостерона и ожирением может быть белок лептин, синтезируемый адипоцитами.
В исследовании была выявлена обратная корреляция между лептином и уровнем свободного тестостерона (r = -0,443, p ≤ 0,05). Наибольшее снижение концентрации лептина было отмечено в группе, получавшей комплексную терапию, в которой также было выявлено более выраженное повышение балла МИЭФ-5.
Снижение концентрации лептина и СЖК, по-видимому, снижает негативное влияние липотоксичности на эндотелий, что обеспечивает улучшение эректильной функции.
Таким образом, полученные данные свидетельствуют о положительном влиянии снижения массы тела и как следствие – уменьшении влияния феномена липотоксичности на андрогенный статус мужчин с ожирением. Нами было показано, что программа по снижению веса недостаточно эффективна и что мужчинам с ожирением и ЭД необходимо проводить лекарственную терапию. Однако добавление к терапии препарата, направленного на улучшение эректильной функции, привело к незначительному отличию в баллах МИЭФ-5 между группами. Таким образом, терапия препаратом, содержащим сибутрамин и микрокристаллическую целлюлозу (Редуксин®), оказалась высокоэффективной и достаточно безопасной при лечении мужчин с ожирением и нарушением половой функции.
Заключение
Ожирение – сложное расстройство, состоящее из многочисленных взаимосвязанных патофизиологических процессов, включая дислипидемию, гипергликемии, инсулинорезистентость, липотоксичность и эндотелиальную дисфункцию. К тому же ожирение связано с рядом урологических заболеваний, включая почечнокаменную болезнь, доброкачественную гиперплазию предстательной железы, ЭД, мужское бесплодие [31], приводящих к снижению качества жизни и долголетия.
Понимание патогенеза влияния повышенной концентрации СЖК и лептина на развитие ЭД у мужчин с ожирением позволит разработать новые методы лечения и профилактики данного расстройства.
Таким образом, опыт отечественных и зарубежных исследователей по этиологии, патогенезу и терапии ЭД на фоне ожирения свидетельствует о значительном прогрессе в плане выявления механизмов развития патологических процессов и способов их коррекции. Вместе с тем некоторые лечебные алгоритмы терапии нарушений половой функции у больных ожирением требуют дальнейшего усовершенствования и уточнения.



