Эректильная дисфункция (ЭД, ранее – импотенция), согласно современному определению, – это неспособность достигать и/или поддерживать эрекцию, достаточную для совершения полового акта (Конференция NIH, 1993) [1]. Нормальная эректильная функция – это баланс между психологическими, гормональными, неврологическими, сосудистыми и анатомическими факторами.
Таким образом, изменения в одном или нескольких этих факторах могут приводить к нарушению эрекции.
Распространенность ЭД крайне высока и, согласно данным современных популяционных исследований, будет только увеличиваться. По данным Массачусетского исследования по изучению вопросов старения мужчин (ММАS), более 50 % мужчин старше 40 лет имеют ЭД различной степени выраженности, причем с возрастом их количество увеличивается и доходит до 67 % к 70 годам [2].
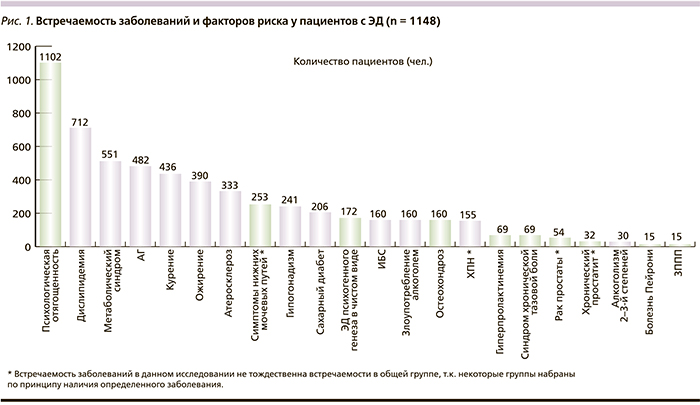
В ходе эпидемиологических наблюдений на основе проведения анкетирования среди 1465 мужчин, обратившихся в ФГБУ «НИИ урологии» в период с 1997 по 2009 г. (средний возраст – 48,7 ± 11,4 года), ЭД была выявлена в 53,6 % случаев, что свидетельствует о том, что среди пациентов, посещающих урологические клиники, расстройства эрекции представляют часто встречаемую жалобу [3]. Комплексное обследование выборки пациентов из общей группы в составе 1148 человек позволило выявить заболевания и факторы риска, которые могли бы быть возможными этиологическими факторами развития ЭД (рис. 1). Данные приведены в порядке убывания частоты встречаемости. Как видно из приведенного рисунка, сахарный диабет (СД) встречался у 206 пациентов с ЭД, что составило 18 % из общей выборки. Сахарным диабетом 1 типа (СД1) страдали 39 пациентов (18,9 % всех больных СД), СД 2 типа (СД2) выявлен у 167 (81,1 %) пациентов. Таким образом, по нашим наблюдениям, встречаемость СД2 у пациентов с ЭД в 4,3 раза чаще, чем СД1. Полученные нами результаты исследования вполне согласуются с общепопуляционными данными по встречаемости СД у мужчин с сексуальными нарушениями [4].
Проблема ЭД у пациентов с СД, бесспорно, крайне актуальна с учетом высокой его распространенности во всем мире, растущей заболеваемости СД, в последние годы носящей характер эпидемии. В 2012 г. количество пациентов с СД в мире составило более 371 млн, к 2030-м ожидается прирост пациентов, по скромным подсчетам, до 552 млн [5, 6]. Эректильная дисфункция – одно из наиболее часто встречающихся состояний, ассоциированных с СД у мужчин. По данным эпидемиологических исследований, распространенность ЭД у мужчин с СД составляет 28–75 % и варьирует в зависимости от возраста пациента и стажа СД [7]. Наличие ЭД значительно ухудшает качество жизни не только мужчины, но и семейной пары, а также является причиной развития депрессии, негативно влияющей и на возможность достижения компенсации углеводного обмена. В качестве патогенетических механизмов, лежащих в основе ЭД у пациентов с СД, в настоящее время рассматривают ангиопатию (микро- и макро-), нейропатию, инсулинорезистентность и гипогонадизм [4]. Влияние данных факторов на ЭД комплексное и сочетанное. Эректильная дисфункция носит, как правило, смешанный характер.
В нашем исследовании все пациенты с СД имели смешанную форму органической ЭД с поражением как сосудистого аппарата (преимущественно артериогенная), так и нейрогенной системы регуляции эрекции.
В ходе исследования применялся метод ультразвуковой фармакодопплерографии сосудов полового члена, в ходе которого было выявлено снижение пиковой систолической скорости кровотока по кавернозным артериям, а также метод электромиографии полового члена с накожным наложением электродов в сочетании с достаточно простым методом определения чувствительности полового члена (температурной, тактильной, вибрационной) с использованием прибора «Тиотерм», монофиламента и камертона (метод Калинченко–Роживанова). Мы также отметили снижение уровня свободного тестостерона (расчитанный по формуле) у пациентов как с СД1, так и с СД2. При этом уровень свободного тестостерона был ниже у пациентов с СД2 (p < 0,005) (табл. 1), что связано в первую очередь с преобладанием «возрастных» пациентов в группе с СД2 [8].
Артериогенный компонент ЭД при СД (диабетическую ангиопатию) условно можно разделить на микро- и макроангиопатию, по сути представляющие собой разные стадии повреждения сосудистой стенки. В основе сосудистой дисфункции при СД в настоящее вре-мя рассматривают дисфункцию эндо-телия (эндотелиальную дисфункцию).
Этому во многом способствовала оценка роли оксида азота (NO) как универсального вазодилататора [9]. NO образуется в эндотелиальной ткани синусоидальных пространств кавернозных тел из аминокислоты L-аргинина при помощи фермента NO-синтазы (NOS) [10]. Свой вазодилатирующий и эректогенный эффекты NO оказывает посредством активации гуанилатциклазы и увеличения концентрации циклического гуанозинмонофосфата (цГМФ) в гладкомышечной ткани сосудов и кавернозных тел полового члена. Циклический гуанозинмонофосфат активирует определенные внутриклеточные протеинкиназы, которые, фосфорилируя рецепторные белки, блокируют кальциевые каналы, снижая таким образом количество свободного внутриклеточного кальция. Это приводит к гиперполяризации и релаксации гладких мышц. Активность данного проэректильного механизма ограничивается фосфодиэстеразой 5 типа (ФДЭ5), ферментом, катализирующим распад цГМФ до неактивного ГМФ. Ингибиторы ФДЭ5 (силденафил, варденафил, тадалафил, уденафил) являются специфическими ингибиторами данного фермента. Их действие основано на пролонгировании эффекта внутриклеточного цГМФ и, таким образом, продлении эрекции.

Разработка и внедрение в клиническую практику ингибиторов ФДЭ5 были одними из главных достижений в лечении ЭД. Их использование существенно изменило алгоритм лечения. В настоящее время они используются в качестве препаратов первой линии в терапии расстройств эрекции. Однако, несмотря на высокую эффективность ингибиторов ФДЭ5, некоторая часть пациентов все-таки не отвечает на общепринятую терапию. Отсутствие реакции может быть вызвано снижением концентрации NO по причине дисфункции эндотелия. Сахарный диабет и его сосудистые и нейрогенные осложнения, артериальная гипертония, дислипидемия (по сути – клинические и лабораторные проявления метаболического синдрома), а также гипогонадизм являются основными заболеваниями, так или иначе ассоциированными с эндотелиальной дисфункцией. Именно эти пациенты, как правило, плохо отвечают на терапию ингибиторами ФДЭ5 [11]. Патогенетической предпосылкой отсутствия реакции на ингибиторы ФДЭ5 для этой группы больных может быть повышенная свободнорадикальная активность (окислительный стресс) и вызванное ей снижение концентрации NO.
Несостоятельность антиоксидантной системы организма, при которой клетки подвергаются воздействию чрезмерных уровней или молекулярного кислорода, или его активных форм (свободных радикалов), приводит к развитию окислительного стресса. Свободные радикалы – нестабильные атомы и соединения, действующие как агрессивные окислители и в результате повреждающие жизненно важные структуры организма. Свободные радикалы образуются при воздействии неблагоприятных факторов окружающей среды (плохая экология, курение, хроническая интоксикация). Кроме того, выработка свободных радикалов может увеличиваться при СД и инсулинорезистентности, артериальной гипертонии, возрастном снижении половых гормонов как у мужчин, так и у женщин (т.е. тех заболеваниях, при которых имеет место эндотелиальная дисфункция). Основным среди свободных радикалов является супероксид (О2-), который образуется при окислении молекулярного кислорода [12]. Среди других свободных радикалов можно выделить перекись водорода (Н2О2), хлорноватистую кислоту (НОСl), пероксинитрит (ONOO-) и др. Источником свободных радикалов в организме человека служат эндотелий сосудов, а также клетки крови (тромбоциты и лейкоциты) [13].
Окислительный стресс возникает при нарастающем поступлении и/или нарастающем образовании in vivo свободных радикалов и преобладании окислительных реакций над восстановительными. Образование свободных радикалов и свободнорадикальные реакции – физиологический процесс, неизбежно приобретающий патофизиологические черты с течением жизни человека. Физиологичность заключается в том, что некоторые свободные радикалы (активные формы кислорода, перекиси) закономерно образуются при окислении жирных кислот как энергетического субстрата и в норме нейтрализуются антиоксидантной системой; при перекисном окислении липидов – необходимом процессе в обновлении фосфолипидных клеточных мембран; при индуцированном локальном окислительном стрессе (при контакте иммунокомпетентных клеток с антигеном с целью его разрушения). Физиологичность свободнорадикального окисления прекращается при лавинообразном нарастании окислительных процессов. Так, например, при инсулинорезистентности и невозможности использования глюкозы как субстрата для выработки аденозинтрифосфата в инсулинзависимых тканях (печень, мышцы, жировая ткань) происходит переход исключительно на окисление жирных кислот, что в конечном итоге приводит к нарастанию свободнорадикальной активности и истощению антиоксидантной системы. При СД гипергликемия приводит к «глюкозотоксичности». При этом усиленное гликирование тканей – это не что иное, как окисление субстратов глюкозой (глюкоза выступает как свободный радикал) [14].
Окислительный стресс в результате «глюкозотоксичности» и нарушение энергетического обмена у пациентов с СД лежат в основе развития диабетической полинейропатии – наиболее частого и самого раннего осложнения СД. Известно, что у 7,5 % больных с впервые выявленным СД2 уже имеются клинические и лабораторные проявления диабетической полинейропатии [15]. При этом, согласно данным некоторых исследований, нейрогенная форма ЭД у пациентов с СД является наиболее ранним признаком поражения нервной ткани и возникает раньше первых клинических проявлений дистальной диабетической нейропатии. Взаимодействие между NO и свободными радикалами служит одним из основных механизмов, участвующих в патофизиологии ЭД [16]. NO взаимодействует с супероксидом (О2-) до образования пероксинитрита (OONO-), который, как сообщается, играет центральную роль в атерогенезе [13]. Пероксинитрит в свою очередь подавляет активность супероксиддисмутазы – основного антиокислительного фермента, инактивирующего супероксид, что приводит к снижению элиминации супероксида, еще больше увеличивает формирование пероксинитрита и уменьшает концентрацию имеющегося NO. Пероксинитрит, так же как и NO, вызывает расслабление гладкомышечной ткани сосудов и кавернозных тел, но его вазодилатирующий эффект намного ниже, чем у NO.

В результате эксперимента M.A. Khan и соавт. (2001), исследовавшие влияние NO и OONO- на кавернозные тела кроликов, выявили, что релаксация гладкомышечной ткани кавернозных тел, вызываемая NO, более эффективна по сравнению с релаксацией, стимулированной OONO-. При этом гладкомышечная ткань после релаксирующего эффекта NO практически моментально возвращается к исходному напряжению, тогда как после действия OONO- ткани были не в состоянии восстановить свое первоначальное напряжение. Нарушение этого механизма в конечном счете приводит к неэффективной релаксации кавернозной ткани и развитию ЭД [17].
В норме NO ингибирует экспрессию клетками крови адгезивных молекул. Снижение концентрации NO приводит к повышению адгезии тромбоцитов и лейкоцитов к стенкам сосудов, которые в свою очередь производят множество вазоконстрикторов (тромбоксан А2, лейкотриены, серотонин) [18]. Таким образом, чрезмерная продукция супероксида и других свободных радикалов в результате окислительного стресса способствует угнетению NO, что является центральным механизмом развития ЭД. Антиоксидантная терапия, направленная на купирование последствий окислительного стресса, может быть ключом к решению проблемы неэффективности терапии ингибиторами ФДЭ5 при ЭД у пациентов с СД в качестве комплексной терапии.
Одним из наиболее мощных природных антиоксидантов является альфа-липоевая (тиоктовая) кислота. Изначально она была известна как незаменимый биохимический кофактор для митохондриальных ферментов. Однако в последнее десятилетие было обнаружено, что альфа-липоевая кислота и промежуточный продукт ее обмена – дигидролипоевая кислота – являются мощными антиоксидантами. В связи с тем что тиоктовая кислота является как жиро-, так и водорастворимым субстратом, она обладает способностью к воздействию на оксидативный стресс в клеточных мембранах и в цитозоле. Было также установлено, что альфа-липоевая кислота – необходимый компонент в рецикле основных антиоксидантов, таких как витамин Е и глутатион [14].
Клиническая эффективность альфа-липоевой кислоты хорошо изучена на здоровых добровольцах и больных СД в целом ряде исследований на различных дозах препарата [19, 20]. Ее роль в лечении диабетической нейропатии объясняется возможностью предупреждать подавление активности нейрональной NO-синтазы, усиливать кровоток в эндоневрии, снижать ишемию нервной ткани и увеличивать импульс проведения по нерву. В экспериментальной работе Keegan и соавт. 1999 г. положительно оценивалась роль альфа-липоевой кислоты для профилактики дисфункции кавернозной ткани в естественных условиях на модели крыс с СД [21]. Клиническая эффективность применения препарата альфа-липоевой кислоты пациентами с ЭД на фоне СД изучалась в исследовании Mitkov и соавт. [7]. В исследовании была показана положительная роль альфа-липоевой кислоты в отношении компонентов ЭД, а также снижение индекса массы тела и улучшение биохимических параметров (снижение уровня гликированного гемоглобина, общего холестерина, триглицеридов, повышение липопротеидов высокой плотности.
В России имеется несколько препаратов альфа-липоевой кислоты, но наибольший практический опыт накоплен по препарату Эспа-липон, который одним из первых появился на российском рынке (1995) и отлично зарекомендовал себя с позиции эффективности. Мы в свою очередь в рамках работы, проведенной в ФГБУ «НИИ урологии» Минздрава России, на группе пациентов с ЭД и СД2 изучали эффективность применения Эспа-липона в дозе 600 мг в сутки в отношении эректильной функции, полового влечения и других клинически значимых симптомов андрогенного дефицита. В исследование были включены 86 мужчин с СД2, имевших жалобы на нарушение эрекции. Средний возраст пациентов составил 51 год (43–59) (данные представлены в виде медианы и границ интерквартильных отрезков). Пациенты были в свою очередь разделены на две группы. Основную группу составили 52 пациента, которым была назначена терапия, в группу контроля вошли 34 пациента. Оценка эффективности лечения проводилась спустя 12 недель с момента назначения препарата. Все пациенты на момент включения в исследование были компенсированы в отношении углеводного обмена (HbA1c < 7 %).
В качестве методов оценки эффективности проводимой терапии использовались валидизированные опросники: Международный индекс эректильной функции 5 (МИЭФ-5) и Aging Male Simptoms (AMS) по Heinemann. Результаты исследования представлены на рис. 2 и 3. Мы получили достоверное повышение баллов по опроснику МИЭФ-5 с 18 (13–21) до 22 (20–24) и снижение баллов по опроснику AMS c 42 (35–44) до 33 (29–34) в группе пациентов, получавших терапию Эспа-липоном, по сравнению с контрольной группой, где достоверных изменений баллов по опросникам получено не было.
С учетом положительного патогенетического воздействия тиоктовой кислоты на эндотелий кавернозных артерий, а также кавернозных нервов открывается новое окно терапевтических возможностей ее применения в лечении ЭД, ассоциированной с СД, и других форм нарушения эрекции с учетом общих механизмов развития ЭД.



