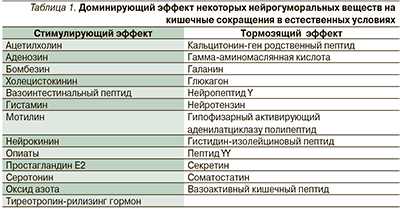
Косновным классам рецепторов, участвующих в регуляции моторно-эвакуаторной функции желудочно-кишечного тракта (ЖКТ), относятся холинергические, адренергические, дофаминергические, серотониновые, мотилиновые и холецистокининовые. Препараты, используемые при депрессивных и тревожных расстройствах, панических атаках и других вегетативных дисфункциях, действуют на аналогичные рецепторы, отвечающие за моторно-эвакуаторную функцию ЖКТ. Регулирование гладкой мускулатуры и подвижности кишечника происходит на нескольких уровнях. Гормоны и нейротрансмиттеры являются доминирующими компонентами регулирующей системы, прямо или опосредованно воздействующими на гладкомышечные клетки. Постпрандиальный эндокринный ответ включает выработку инсулина, нейротензина, холецистокинина (ХЦК), гастрина, глюкагоноподобных пептидов (ГПП-1 и ГПП-2) и глюкозозависимого инсулинотропного полипептида (ГИП), ранее известного как желудочный ингибиторный пептид [1]. Данные об эффектах нейромедиаторов и гормонов представлены в табл. 1. Например, ХЦК выделяется в проксимальных отделах тонкой кишки, вызывая сокращение мышечных клеток желчного пузыря и опосредованную ГИП-релаксацию мышц клеток сфинктера Одди.
 В настоящей статье хотим уделить особое внимание серотонинергическим рецепторам – одним из важных регуляторов кишечной перистальтики. Серотонин, или 5-гидрокситриптамин (5-HT), – моноаминовый нейромедиатор, являющийся главным посредником в физиологии психологического состояния и настроения человека, а также одним из регуляторов функции сосудов и желудочно-кишечной моторики. 5-HT представлен в тромбоцитах, ЖКТ и центральной нервной системе (ЦНС) человека и животных [2–5]. Он вырабатывается в организме человека из триптофана, поступающего с пищей (необходим для непосредственного синтеза серотонина в синапсах) или образующегося в результате белкового катаболизма, стимулированного гиперинсулинемией в ответ на поступление глюкозы.
В настоящей статье хотим уделить особое внимание серотонинергическим рецепторам – одним из важных регуляторов кишечной перистальтики. Серотонин, или 5-гидрокситриптамин (5-HT), – моноаминовый нейромедиатор, являющийся главным посредником в физиологии психологического состояния и настроения человека, а также одним из регуляторов функции сосудов и желудочно-кишечной моторики. 5-HT представлен в тромбоцитах, ЖКТ и центральной нервной системе (ЦНС) человека и животных [2–5]. Он вырабатывается в организме человека из триптофана, поступающего с пищей (необходим для непосредственного синтеза серотонина в синапсах) или образующегося в результате белкового катаболизма, стимулированного гиперинсулинемией в ответ на поступление глюкозы.
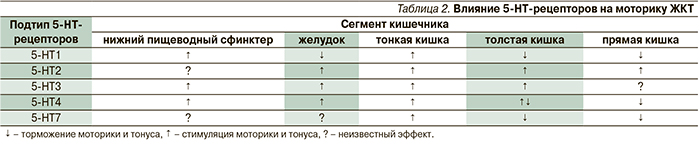
На основании биохимических и фармакологических критериев 5-HT-рецепторы подразделяются на 7 основных подтипов, 5 из которых локализуются в кишечных нейронах, энтерохромаффинных клетках (ЭХК) и гладкой мускулатуре ЖКТ: 5-HT1, -HT2, -HT3, -НТ4 и 5-HT7 [6, 7]. Около 80 % от общего количества 5-НТ-рецепторов (несколько подтипов) находятся в ЭХК кишечника, где они принимают участие в кишечной перистальтике [3, 8]. За исключением 5-HT3 (лиганд-управляемые ионные каналы), все остальные 5-HT рецепторы относятся к G-белоксопряженным, активирующим внутриклеточные реакции второго каскада, стимулируя возбуждающие или тормозные реакции в ЖКТ [7]. Серотонин характеризуется хорошо изученным влиянием на кишечную моторику, секрецию и сенситивность через центральные и периферические нейромедиаторные пути, что делает препараты, воздействующие на его метаболизм, ключевыми в лечении моторных нарушений ЖКТ [9]. Преимущественно (90 %) серотонин высвобождается из ЭХК в ответ на химическое или механическое раздражение слизистой оболочки [10] и в экспериментальных моделях стресса [11]. Кроме того, он синтезируется и хранится в нейронах кишечника (10 %).
5-HT выделяется в кровь после приема пищи и в ответ на изменения давления на кишечную стенку, затем он поступает в просвет и далее – в стенки кишечника из базолатерального депо ЭХК [12]. 5-HT стимулирует круговые и продольные мышцы в желудке, двенадцатиперстной кишке и тощей кишке человека [13]. Важно подчеркнуть стратегическое расположение ЭХК в непосредственной близости от сенсорных нервных окончаний слизистой оболочки кишечника, интерганглионарных нейронов, синапсов двигательных возбуждающих и тормозных нейронов. Серотонин увеличивает амплитуду сокращений мышц желудка, двенадцатиперстной, тощей и подвздошной кишки [14]. В тонкой кишке он стимулирует круговые сокращения в течение первой манометрической фазы; вызываемые сокращения распространяются, становятся более частыми и активируют быстрые моторные комплексы [15]. В толстой кишке серотонин стимулирует моторику на протяжении всей ее длины, вызывая фазовые сокращения, но не гигантские двигательные комплексы [16].
Кишечные гладкомышечные ритмические колебания определяются спонтанной активностью интерстициальных клеток Кахаля, выполняющих функцию своеобразного «кардиостимулятора» для клеток ЖКТ [17–20]. «Кишечная нервная система» состоит из полуавтономных эффекторных систем, связанных с центральной вегетативной системой. При высвобождении серотонина из ЭХК происходит инициация вагусных рефлексов – перистальтических, выделительных, сосудорасширяющих, ноцицептивных. Парасимпатический и симпатический отделы вегетативной нервной системы формируют кишечную нервную систему через афферентные и эфферентные связи. Текущие двунаправленные отношения «ЦНС–ЖКТ» с участием 5-HT оказывают существенное влияние на эффекторные системы. Нарушенная 5-HT-трансмиссия может приводить к возникновению как кишечных, так и внекишечных симптомов синдрома раздраженной кишки (СРК) [11].
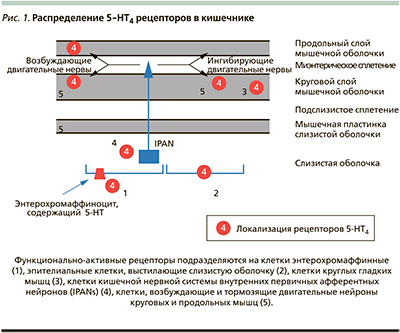 Участие различных 5-HT-рецепторов в функциональной перистальтической активности ЖКТ выглядит следующим образом: 5-HT3 – 65 %, 5-НТ4 – 85 % и 5-HT7 – 40 %. В сочетании антагонисты этих рецепторов способны уменьшать перистальтическую активность кишечника примерно на 16 % (5-HT3 + 5-HT4), 70 % (5-HT3 + 5-HT7) и на 87 % (5-HT4 + 5-HT7); одновременное введение всех трех антагонистов неизбежно блокирует всю перистальтическую активности. Таким образом, 5-HT-рецепторы играют ключевую роль в модуляции кишечной перистальтики, причем функционально наиболее важен в этом отношении подтип 5-HT4, а 5-HT3- и 5-HT7-рецепторы играют несколько менее активную роль, что отражено в табл. 2 и на рис. 1 [21].
Участие различных 5-HT-рецепторов в функциональной перистальтической активности ЖКТ выглядит следующим образом: 5-HT3 – 65 %, 5-НТ4 – 85 % и 5-HT7 – 40 %. В сочетании антагонисты этих рецепторов способны уменьшать перистальтическую активность кишечника примерно на 16 % (5-HT3 + 5-HT4), 70 % (5-HT3 + 5-HT7) и на 87 % (5-HT4 + 5-HT7); одновременное введение всех трех антагонистов неизбежно блокирует всю перистальтическую активности. Таким образом, 5-HT-рецепторы играют ключевую роль в модуляции кишечной перистальтики, причем функционально наиболее важен в этом отношении подтип 5-HT4, а 5-HT3- и 5-HT7-рецепторы играют несколько менее активную роль, что отражено в табл. 2 и на рис. 1 [21].
Агонисты 5-HT4-рецепторов стали доступными с внедрением в клиническую практику метоклопрамида в 1964 г.
Этот препарат, являющийся антагонистом дофаминовых D2- и 5-HT3-рецепторов, а также агонистом 5-HT4-рецепторов, до сих пор широко используется во всем мире. Его успех привел к разработке альтернативных молекул, не влияющих на D2-рецепторы, что позволяет устранять такие неблагоприятные явления, как акатизия и экстрапирамидные двигательные расстройства.
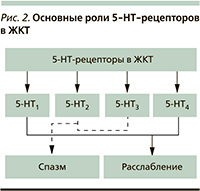
Серотониновые рецепторы, в частности 5-HT3 и 5-НТ4, участвуют в сенсорных и рефлекторных реакциях на раздражители при гастроинтестинальных расстройствах, обусловливая такие проявления, как рвота, запор или диарея, нарушения пищевого поведения, боли в животе, измененные сенсомоторных рефлексы [22]. Было высказано предположение, будто селективные ингибиторы обратного захвата серотонина (СИОЗС) могут влиять на функцию 5-HT3-рецепторов, а также способны ослабить симптоматику СРК и сопутствующей депрессии у пациентов. Действительно, по данным многочисленных исследований, трициклические антидепрессанты (амитриптилин, мелипрамин), некоторые СИОЗС (флуоксетин, пароксетин, циталопрам) и СИОЗСН (селективные ингибиторы обратного захвата серотонина и норадреналина), такие как дулоксетин, снижают выраженность симптомов СРК [23–26]. Долгосрочные побочные явления при лечении антидепрессантами связаны с антихолинергическим, серотонинергическим, седативным, антигистаминным и α-адренергическим эффектами, оказывающими различное воздействие на функции ЖКТ, что, несомненно, должно учитываться при выборе подхода к лечению серотонинергическими препаратами [27] (рис. 2).
Как указывалось выше, 5-HT1-, 5-HT3-, и 5-НТ4-рецепторы играют важную роль в регуляции двигательных и секреторных функций ЖКТ. Данные о лекарственных средствах, взаимодействующих с 5-HT-рецепторами, локализующимися в ЖКТ, представлены в табл. 3. Например, активация кишечных 5-HT4-ецепторов ассоциируется с прокинетическим действием, увеличением числа дефекаций, а также со снижением времени кишечного транзита [28, 29]. Блокада 5НТ3-рцепторов, в частности, противорвотными средствами, такими как ондансетрон, приводит к запорам [30]. В течение последнего десятилетия были разработаны блокаторы 5-НТ3-рецепторов алосетрон и силансетрон, испытанные при СРК с диареей. Недавний систематический обзор и мета-анализ 11 рандомизированных плацебо-контролируемых клинических испытаний этих двух препаратов подтвердили их терапевтическую эффективность [31]. Однако развитие при их применении ряда редких, но тяжелых побочных явлений, включая ишемический колит, привело к тому, что производство алосетрона и исследования по силансетрону были приостановлены [32]. Сегодня алосетрон доступен в США только по строгим показаниям для пациенток с тяжелым резистентным СРК с диареей, не ответившим на первую или вторую линии терапии.
5-HT4-агонисты доказали свой терапевтический потенциал в лечении больных с нарушениями моторики ЖКТ. Препараты с отсутствием селективности в отношении 5-HT4-рецепторов, такие как цизаприд и тегасерод, имеют в гастроэнтерологической практике ограниченный клинический успех и могут вызывать неблагоприятные кардиоваскулярные явления. Систематический обзор и мета-анализ показали, что тегасерод превосходит плацебо при лечении запоров, в т.ч. при СРК. Большинство исследований тегасерода проведено на женщинах, поэтому первоначально препарат был одобрен для лечения СРК с запорами именно у этой категории больных. В последующем маркетинг тегасерода был приостановлен из-за роста числа сообщений о сердечно-сосудистых и цереброваскулярных событиях на фоне его приема [6].
 Важным событием в клинической фармакологии стало создание селективного лиганда 5-HT4-рецепторов – прукалоприда. Селективность этого нового препарата выгодно отличает его от предшественников, т.к. сводит к минимуму риск побочных явлений. Селективный агонист 5-HT4-рецепторов прукалоприд является инновационным препаратом с привлекательным профилем безопасности в лечении пациентов, страдающих гипомоторными расстройствами ЖКТ [33]. Прукалоприд имеет высокие сродство и селективность к 5-HT4-рецепторам ЖКТ. Эффективность и безопасность препарата при хронических запорах были оценены в нескольких крупных и долгосрочных исследованях [33–35]. В целом прием прукалоприда приводил к значительному повышению удовлетворенности пациентов результатами лечении по опроснику качества жизни при запорах (Patient Assessment of Constipation Quality of Life questionnaire – PAC-QOL). Доля получавших прукалоприд (2 мг/сут) больных, отметивших по 5-балльной шкале PAC-QOL улучшение на 1 балл и более, составила 45,3 % по сравнению с 21,3 % среди получавших плацебо (р ≤ 0,001), хотя число респондеров почти во всех исследованиях было менее 50 %.
Важным событием в клинической фармакологии стало создание селективного лиганда 5-HT4-рецепторов – прукалоприда. Селективность этого нового препарата выгодно отличает его от предшественников, т.к. сводит к минимуму риск побочных явлений. Селективный агонист 5-HT4-рецепторов прукалоприд является инновационным препаратом с привлекательным профилем безопасности в лечении пациентов, страдающих гипомоторными расстройствами ЖКТ [33]. Прукалоприд имеет высокие сродство и селективность к 5-HT4-рецепторам ЖКТ. Эффективность и безопасность препарата при хронических запорах были оценены в нескольких крупных и долгосрочных исследованях [33–35]. В целом прием прукалоприда приводил к значительному повышению удовлетворенности пациентов результатами лечении по опроснику качества жизни при запорах (Patient Assessment of Constipation Quality of Life questionnaire – PAC-QOL). Доля получавших прукалоприд (2 мг/сут) больных, отметивших по 5-балльной шкале PAC-QOL улучшение на 1 балл и более, составила 45,3 % по сравнению с 21,3 % среди получавших плацебо (р ≤ 0,001), хотя число респондеров почти во всех исследованиях было менее 50 %.
В ходе других испытаний – PRU-USA-11 и PRU-USA-13 – существенного различия между прукалопридом и плацебо выявлено не было по всем суррогатным точкам. Общая частота нежелательных явлений была достоверно выше у пациентов, получавших прукалоприд (72 против 59 % в группе плацебо). К неблагоприятным явлениям, о которых наиболее часто сообщали пациенты, получавшие прукалоприд, отнесены головная боль (до 30 %), тошнота (до 24 %), диарея (до 5 %),
боли в животе и метеоризм (до 23 %), головокружение (до 5 %) и инфекции верхних дыхательных путей [36]. R. Cinca и соавт. сравнили эффективность, безопасность и влияние макрогола и прукалоприда на качество жизни 240 женщин с хроническими запорами, которым другие слабительные не обеспечивали адекватную помощь. Макрогол оказался более эффективным и переносился лучше, чем прукалоприд [37]. Полученные данные позволяют сделать следующий вывод: женщинам от 18 до 75 лет прукалоприд может назначать врач, имеющий опыт в лечении хронических запоров, в том случае если другие слабительные средства оказались неэффективными.
Важно знать, что не всегда у пациентов имеет место дефицит серотонина, в ряде случаев врач может сталкиваться с его избытком. У беспокойных гастроэнтерологических пациентов с повышенным содержанием серотонина развивается аэрофагия, что вызывает увеличение воздушного пузыря в желудке и приводит к раздражению рецепторного аппарата [38]. Повышенный уровень серотонина обусловливает частую тошноту и рвоту вследствие активации блуждающего нерва, диарею или спастический запор, гастроинтестинальные панические атаки, головную боль, тремор, гипергидроз, волнение и тревогу, сердцебиение, нестабильное артериальное давление, бессонницу.
Серотонин не только играет важную роль в регуляции функций ЖКТ, усиливая его перистальтику и секреторную активность, но и является фактором роста для некоторых видов симбиотических микроорганизмов, усиливает бактериальный метаболизм в толстой кишке. Сами бактерии толстой кишки также вносят некоторый вклад в секрецию серотонина кишечником, поскольку многие виды симбиотических микроорганизмов обладают способностью декарбоксилировать триптофан. При дисбиозе и ряде других заболеваний толстой кишки продукция серотонина кишечником значительно снижается. Массивное высвобождение серотонина из погибающих клеток слизистой оболочки желудка и кишечника при воздействии цитотоксических химиопрепаратов служит одной из причин возникновения тошноты и рвоты, диареи при химиотерапии злокачественных опухолей [39, 40].

Трудно переоценить роль серотонина в организме человека. В передней части мозга под воздействием серотонина стимулируются области, ответственные за процесс познавательной активности, а повышение серотонинергической активности создает в коре головного мозга ощущение подъема настроения. Поступающий в спинной мозг серотонин положительно влияет на двигательную активность и тонус мышц; это состояние можно охарактеризовать фразой «горы сверну». Кроме настроения серотонин «отвечает» за самообладание или эмоциональную устойчивость. Серотонин контролирует восприимчивость мозговых рецепторов к стрессовым гормонам адреналину и норадреналину.
У людей с пониженным уровнем серотонина малейшие поводы вызывают сильную стрессовую реакцию. Отдельные исследователи считают, что доминирование особи в социальной иерархии обусловлено именно высоким уровнем серотонина [39, 40].
Заключение
Когда в организм поступает пища, в т.ч. содержащая триптофан, увеличивается выработка серотонина, что повышает настроение. Мозг быстро улавливает связь между этими явлениями и в случае депрессии (серотонинового голодания) незамедлительно «требует» дополнительного поступления пищи с триптофаном или глюкозой. Наиболее богаты триптофаном продукты, почти целиком состоящие из углеводов, например хлеб, бананы, шоколад, инжир, курага, финики, изюм, арбузы и т.п. Перечисленные продукты давно известны и как регуляторы кишечной перистальтики. А их дефицит в питании приводит к депрессиям и проблемам со стороны желудочно-кишечного тракта, что можно часто наблюдать у людей, соблюдающих строгую низкокалорийную диету. Поэтому, прежде чем назначать пациенту лекарственные препараты, повышающие уровень серотонина, необходимо уточнить причину его дефицита. Знания о деталях функционирования серотониновых рецепторов, несомненно найдут применение в лечении пациентов некардиотоксичными аналогами серотонина или препаратами и пищевыми продуктами, повышающими его уровень, такими как шоколад [41]. Препараты, повышающие уровень серотонина в синаптической щели и способствующие усилению его эффектов, относятся к группе антидепрессантов. Сегодня они остаются одними из наиболее широко назначаемых врачами общей медицинской практики лекарственных средств во многих странах мира, в т.ч. Европы и Северной Америки. Своевременное назначение антидепрессантов как в монотерапии, так и в схемах лечения различных заболеваний позволяет повышать эффективность лечения основной болезни и улучшать качество жизни пациентов, особенно больных гастроэнтерологического профиля.



