Всовременной и особенно отечественной литературе существует много указаний на проблемы с безопасностью антидепрессивной терапии [1]. Так, сообщается, что даже при применении «наиболее легкопереносимых антидепрессантов у больных легкими и умеренно выраженными депрессиями» разнородные побочные эффекты отмечаются у 80% больных. Плохая переносимость антидепрессивной терапии отмечается у больных дистимией, соматизированными, тревожными и истерическими депрессиями [2, 3]. Подчеркивается, что побочные эффекты неблагоприятно влияют на исходы терапии при лечении первых легких и среднетяжелых депрессивных состояний [2] из-за высоких требований к качеству жизни пациентов [4], опасности усиления социальной дезадаптации и даже самих симптомов депрессии [5].
Сообщается, что переносимость антидепрессивной терапии хуже у лиц старше 45 лет с высоким уровнем тревоги и соматизации, истероидным и сенситивным (астено-невротическим) типами личностной акцентуации, дефицитом массы тела [2], отрицательными реакциями на плацебо в анамнезе [6]. Указывается, что плохая переносимость антидепрессивной терапии связана с изначально негативным отношением к психиатрии со стороны общественного мнения, малой информированностью о собственной болезни и рекомендуемой врачом терапии, неудовлетворительным опытом предыдущего лечения и т.д. [2, 7].
Сама возможность выявить антидепрессанты, отличающиеся лучшей переносимостью, ставится под сомнение. Сообщается, что спектр неблагоприятных явлений препаратов слабо связан с их механизмом действия. Эти явления носят неспецифически вероятностный характер и потому почти непредсказуемы [8]. И все же в большинстве публикаций ставится вопрос о выявлении антидепрессантов, обладающих преимуществом в плане переносимости. Причем этот вопрос решается в духе противопоставления старого и нового. Так, сравнивают переносимость разных поколений препаратов. И в подавляющем большинстве случаев находят, что «новые» антидепрессанты явно лучше «старых» [9–12]. И лишь единичные статьи сообщают об одинаковом количестве побочных эффектов у рассматриваемых препаратов [13].
Представленный подход к проблеме самым серьезным образом отражается на практике применения антидепрессантов. Эти препараты очень редко назначают больным депрессиями, которые наблюдаются вне психиатрических учреждений [14]. Что же касается психиатрии, то опасения, связанные с переносимостью антидепрессантов, напрямую влияют не на частоту применения, а на суточные дозы «старых» и «новых» препаратов. В частности, данные крупной анкетной программы ЦИРКАДИАН-I свидетельствуют о том, что практически все «старые» препараты: трициклические – ТЦА (амитриптилин, кломипрамин, имипрамин, пипофезин), и обратимые ингибиторы моноамиоксидазы типа «А» – ОИМАО-А (пирлиндол), назначаются очень «экономно» (табл. 1) [15].
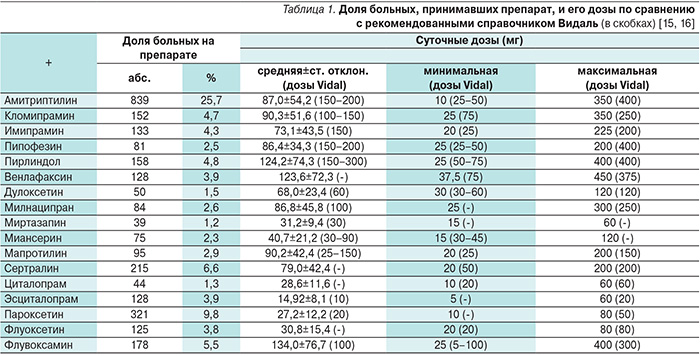
Действительно, средние и минимальные суточные дозировки перечисленных антидепрессантов значительно ниже оптимальных и начальных соответственно [16]. Дозы практически всех «новых» препаратов (венлафаксин, дулоксетин, миртазапин, миансерин, сертралин, циталопрам, эсциталопрам, пароксетин, флуоксетин, флувоксамин) гораздо ближе к рекомендованным (табл. 1). Эта закономерность распространяется прежде всего на средние дозировки. Они приближаются к оптимальным или хотя бы находятся в диапазоне между рекомендованными начальными и максимальными (табл. 1). Более того, допускается даже значительное превышение предельно допустимых суточных доз (венлафаксин, милнаципран, эсциталопрам, пароксетин, флувоксамин). И все же опасения, связанные с переносимостью антидепрессантов, сохраняются даже в отношении «новых» препаратов. Так, минимальные суточные дозы у некоторых из них (венлафаксин, миансерин, сертралин, циталопрам, флувоксамин) оказались ниже начальных (табл. 1).
Очевидно, что использование антидепрессантов в неадекватных дозировках ведет к существенному снижению эффективности терапии. И если в создавшейся ситуации ничего не менять, опасения относительно переносимости этих препаратов будут способствовать отказу от их назначения вне психиатрии и неблагоприятно влиять на результаты лечения в специализированных психиатрических учреждениях. Понятно также, что в создавшейся ситуации необходим не спор о том, какие антидепрессанты лучше, «новые» или «старые», а обстоятельный анализ соотношений между патогенезом психических расстройств и особенностями терапевтических и побочных эффектов.
Так, в настоящее время считается установленным, что ключевые проявления депрессии связаны со снижением активности дофаминовых (ДА), норадреналиновых (НА) и серотониновых (СЕ) нейронов (табл. 2).
Что же касается тревоги, то в основе ее патогенеза лежит снижение активности двух тормозящих систем: гамкергической (ГАМК) и серотониновой (СЕ) (табл. 3).

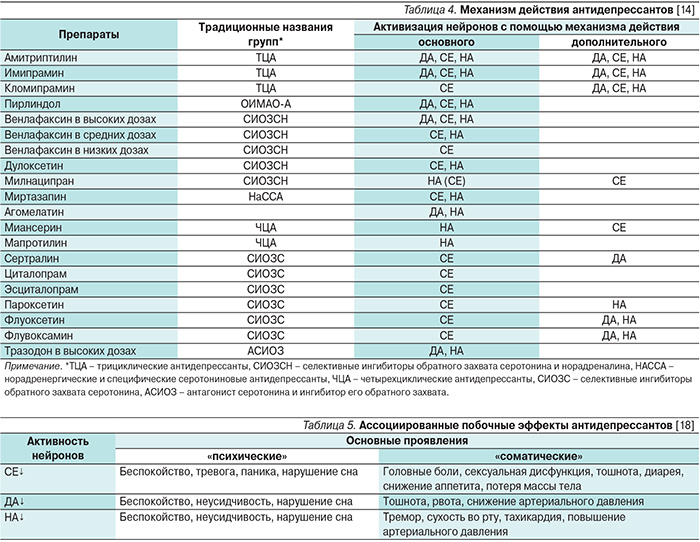
Переходя к характеристике терапевтических эффектов антидепрессантов, укажем, что все они (вне зависимости от конкретных механизмов, ингибирования ферментов или влияния на рецепторы) обусловлены стимуляцией ДА, НА и СЕ нейронов (табл. 4).
Причем на это направлены как основные (наиболее выраженные), так и дополнительные (значительно более слабые) фармакологические свойства препаратов.
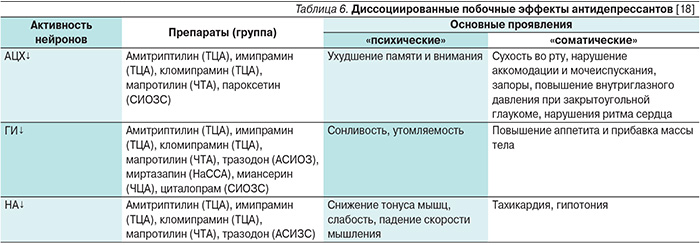
При сопоставлении данных табл. 2–4 становится очевидным, что для лечения депрессий от антидепрессанта требуется активизация двух или трех видов нейронов: ДА и НА, СЕ и НА или ДА, СЕ, НА. Терапевтическое влияние на тревогу эти препараты могут осуществлять прежде всего посредством стимуляции СЕ нейронов. Однако активизация указанных нервных клеток происходит по всей нервной системе. При этом влияние антидепрессанта распространяется как на пораженные нейроны, так и на не затронутые депрессией или тревогой. В первом случае будет наблюдаться терапевтический, а во втором – побочный эффекты [18]. По существу, эти эффекты порождаются одним и тем же механизмом действия антидепрессанта и потому могут быть отнесены к ассоциированному типу (табл. 5).
Вот почему чем эффективнее антидепрессант стимулирует ДА, НА и СЕ нейроны, тем сильнее выражены и побочные эффекты рассматриваемого типа, которые в силу особенностей своих «психических» симптомов традиционно обозначаются как «активизирующие» [5]. Важно также, что ассоциированные побочные эффекты во многом напоминают (имитируют) симптомы тревоги, выступающей в структуре как депрессии, так и тревожных расстройств.
Однако рассмотренные побочные эффекты могут и вовсе не проявляться даже у очень эффективного антидепрессанта. Это происходит из-за побочных эффектов второго типа, которые обусловлены снижением функций ацетилхолиновых (АЦХ), гистаминовых (ГИ) и норадреналиновых (НА) нейронов (табл. 6).
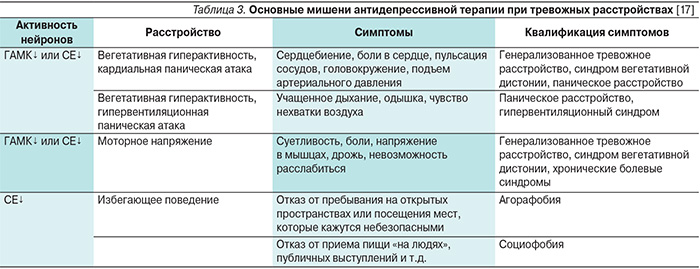
Эти побочные эффекты характерны лишь для отдельных антидепрессантов. По особенностям своего «психического» компонента они традиционно обозначаются как «седативные» [5] и имитируют антидепрессивное и особенно противотревожное действия (табл. 2, 3, 6). Но правильнее обозначить их как диссоциированные. Ведь они формируются по иным механизмам, нежели те, которые обеспечивают терапевтические эффекты (стимуляция ДА и СЕ нейронов против снижения активности АЦХ и ГИ), а то и вовсе противоположны им (стимуляция НА нейронов против снижения их активности).
Оба типа побочных эффектов отличаются не только своим отношением к терапевтическим свойствам антидепрессантов. Так, ассоциированные побочные эффекты нестойкие и подвержены спонтанной обратной динамике [8]. Их выраженность максимальна на первой неделе лечения, а на второй и третьей они редуцируются. Напротив, диссоциированные побочные эффекты достаточно стабильны и могут наблюдаться в течение всего курса терапии [14]. Считается, что эти различия связаны с тем, что «нормальным» нейронам гораздо проще адаптироваться к излишней активизации, нежели снижению их жизнедеятельности [18].
Представленных данных вполне достаточно, чтобы сформулировать простые рекомендации по улучшению переносимости антидепрессантов:
- Предпочтительны препараты, стимулирующие (за счет как основных, так и дополнительных свойств) только тот набор нейронов, который необходим для лечения данного расстройства (принцип необходимой достаточности). В противном случае антидепрессант будет давать больше ассоциированных побочных эффектов.
- Предпочтительны антидепрессанты, обладающие только ассоциированными побочными эффектами. Такие препараты не дают «лишних» (не связанных с терапевтическим действием) побочных эффектов и не маскируют истинную клиническую динамику психического расстройства. Напротив, их появление свидетельствует об активизации нейронов в центральной нервной системе, а следовательно, о приближении терапевтического эффекта.
- Из-за склонности к спонтанной редукции при развитии ассоциированных побочных эффектов не следует спешить со снижением дозы или заменой препарата. Предпочтительна тактика ожидания. Следует также рекомендовать простые методы, позволяющие улучшать переносимость побочных эффектов (например, при мышечной дрожи необходимо избегать резкого изменения положения тела, медленно вставать и т.д.). Возможно временное назначение «корректоров», например ГАМКергических препаратов (бензодиазепинов) при чрезмерной активизации, β-адреноблокаторов при повышении артериального давления и т.д.
- Назначение антидепрессантов с диссоциированными побочными эффектами, маскирующими истинную динамику состояния, допустимо в стационаре, когда «лишние» (не связанные с терапевтическим действием) побочные эффекты не столь критичны и существует уверенность в эффективности препарата.
- При появлении выраженных диссоциированных побочных эффектов требуется снижение суточной дозы антидепрессанта, которая, однако, не должна быть ниже терапевтической. Альтернативой служат отмена препарата и переход на другой антидепрессант, обладающий менее выраженными диссоциированными побочными эффектами, либо вовсе их лишенный.
- При назначении любых антидепрессантов необходимо разъяснить больному соотношение между терапевтическими (польза) и побочными (вред) эффектами антидепрессантов, а также прогноз последних (обратная динамика при ассоциированных, персистирование при диссоциированных).
Данные рекомендации целесообразно использовать во всех случаях назначения антидепрессантов. Однако в первую очередь их следует придерживаться при использовании рассматриваемых препаратов у «проблемных» категорий больных (пожилые, страдающие сопутствующими соматическими или неврологическими заболеваниями, с плохой переносимостью антидепрессивной терапии в анамнезе, недостаточной информированностью о собственной болезни, с неудовлетворительным опытом предыдущего лечения и т.д.). В качестве примера реализации рекомендаций осуществим выбор наиболее переносимого антидепрессанта для лечения тревожных расстройств.
Если следовать принципу необходимой достаточности, то в рассматриваемой ситуации необходим препарат, стимулирующий СЕ нейроны и обладающий только ассоциированными побочными эффектами. Этим требованиям (табл. 4, 6) соответствует только эсциталопрам. При назначении этого антидепрессанта целесообразно разъяснять пациенту, что препарат подробно исследован при лечении практически всего спектра тревожных расстройств [19–21]. В результате проведенных клинических испытаний показано, что эсциталопрам превосходит другие антидепрессанты по оценкам безопасности и переносимости [22–24]. И кроме того, его отличает низкий потенциал взаимодействия с прочими лекарственными средствами [25].
Неблагоприятные же реакции обычно мало выражены и чаще всего проявляются на ранних стадиях лечения, обычно угасая по интенсивности и частоте по мере продолжения терапии. Наиболее частыми побочными эффектами являются тошнота, диарея, повышенное потоотделение. При появлении этих побочных эффектов следует часто есть, но маленькими порциями на протяжении дня, использовать мятные конфеты или жвачки. Необходимо также употреблять в пищу легкие с низким уровнем клетчатки продукты (например, яблочное пюре, рис и йогурт) и, напротив, избегать острого и жирного. Наконец, возможно назначение буспирона – препарата, который уменьшает активность СЕ нейронов.
Как бы то ни было, рекомендации, направленные на улучшение переносимости терапии антидепрессантами, целесообразно основывать на соотношении патогенеза психических расстройств, а также особенностях их терапевтических и побочных эффектов. Такой подход при выборе препаратов можно использовать как в клинических условиях, так и при разработке стандартов лечения.



