Создание и внедрение в клиническую практику противоопухолевых препаратов нового поколения, к числу которых относится и низкомолекулярный ингибитор тирозинкиназных рецепторов эпидермального фактора роста ErbB1/EbB2 лапатиниб, стали возможными благодаря более глубокому пониманию биологии опухоли.
Тирозинкиназные рецепторы эпидермального фактора роста (Human Epidermal Growth Factor Receptors – HER/ErbB) располагаются на мембранах клеток нормальных тканей и опухолей, они регулируют постоянную активацию сигнальных путей, что стимулирует опухолевые клетки к митозу. Количество HER-рецепторов в опухолевых клетках больше, чем в нормальных тканях.
Семейство рецепторов эпидермального фактора роста состоит из четырех тирозинкиназных рецепторов: EGFR/HER1/ErbB1, HER2/ErbB2, HER3/ErbB3, HER4/ErbB4 [1, 2]. Для ряда опухолей, в т.ч. рака молочной железы (РМЖ), характерно увеличение числа копий генов (амплификация) и/или повышение уровней мРНК и белковых продуктов генов-рецепторов (гиперэкспрессия). Гиперэкспрессия ErbB2/HER2 при РМЖ встречается, по разным данным, в 10–37 % случаев [3, 4]. Тирозинкиназный рецептор состоит из внеклеточного лигандсвязывающего домена, трансмембранного домена и внутриклеточного каталитического или белкового тирозинкиназного домена [1, 5]. При связывании лиганда (фактора роста) с внеклеточным доменом происходит димеризация рецептора, т.е. объединение двух связанных с лигандом рецепторов в единый функциональный комплекс. В процессе димеризации образуются гомо- и гетеродимеры. После димеризации рецептора происходит активация внутриклеточного домена и аутофосфорилирование тирозинкиназы. Этот процесс инициирует сигнальные каскады с участием MAPK–ERK1/2 и PI3K/AKT и трансдукцию сигнала внутрь клетки [1, 6]. HER2, существующий в закрытой форме, не связывается с лигандом, но является предпочтительным партнером в формировании димера для других HER-рецепторов [7]. Коэкспрессия HER1 и HER2 обратно коррелирует со статусом рецепторов эстрогенов в опухоли, а гетеродимеры HER1/2 увеличивают метастатический потенциал клеточных линий РМЖ [9]. Поэтому возникло представление, будто двойное ингибирование обоих рецепторов может быть более эффективным, чем ингибирование каждого в отдельности [10].
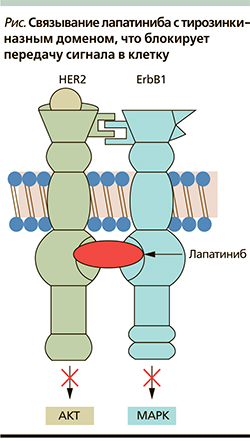
Лапатиниб – двойной ингибитор тирозинкиназных рецепторов HER1/HER2. Он блокирует активацию рецептора и таким образом прерывает передачу сигнала внутрь клетки (см. рисунок). Предотвращение активации обоих рецепторов дает возможность эффективного применения препарата при HER2(+)-опухолях, резистентных к трастузумабу (Герцептину). In vitro была продемонстрирована аддитивная активность лапатиниба и фторурацила (активный метаболит капецитабина) при использовании в комбинации на четырех линиях опухолевых клеток. Ингибирующий эффект оценивался на обработанных трастузумабом клетках. Исследования I фазы показали, что лапатиниб в монорежиме характеризуется хорошей переносимостью и обладает противоопухолевой активностью при различных HER2+-солидных опухолях, в т.ч. при РМЖ [6, 11].
 Лапатиниб – новый противоопухолевый препарат, активный при HER2-позитивном РМЖ, удобный в применении (пероральный прием) и относительно удовлетворительно переносимый, вызвал к себе значительный интерес. Первое клиническое исследование лапатиниба в сочетании с капецитабином на больных местнораспространенным и метастазирующим РМЖ, ранее получавших антрациклины, таксаны и трастузумаб, подтвердило противоопухолевую активность комбинации по сравнению с монотерапией капецитабином.
Лапатиниб – новый противоопухолевый препарат, активный при HER2-позитивном РМЖ, удобный в применении (пероральный прием) и относительно удовлетворительно переносимый, вызвал к себе значительный интерес. Первое клиническое исследование лапатиниба в сочетании с капецитабином на больных местнораспространенным и метастазирующим РМЖ, ранее получавших антрациклины, таксаны и трастузумаб, подтвердило противоопухолевую активность комбинации по сравнению с монотерапией капецитабином.
В рандомизированном исследовании III фазы EGF 100 151 больной распространенным HER2-позитивным РМЖ при прогрессировании после химиотерапии, включившей антрациклины, таксаны и трастузумаб, назначили капецитабин 2500 мг/м2/сут 1–14-й дни (201 пациентка) или капецитабин 2000 мг/м2/сут 1–14-й дни в комбинации с лапатинибом 1250 мг/сут (198 пациенток).
В группе больных, получавших комбинацию препаратов, медиана времени до прогрессирования (ВДП) составила 26,7 недели против 20,7 – в группе пациентов, получавших капецитабин в режиме монотерапии (отношение рисков [ОР] – 0,54; 95 % доверительный интервал [ДИ] – 0,28–1,03; p = 0,046). Медиана общей выживаемости составила 75 недель при комбинации препаратов и 64,7 – при монотерапии (ОР – 0,87; 95 % ДИ – 0,71–1,08; p = 0,21) [14, 15].
Таким образом, комбинация лапатиниба с капецитабином продемонстрировала значительный выигрыш в отношении медианы ВДП у больных метастатическим HER2-позитивным РМЖ по сравнению с капецитабином в монорежиме при удовлетворительной переносимости.
В другом исследовании сравнили эффективность паклитаксела и паклитаксела с лапатинибом для 579 больных метастазирующим РМЖ. Значительного различия в медиане ВДП среди HER2-негативных пациентов не отмечено. Лечение лапатинибом и паклитакселом 86 пациентов с HER2-позитивным РМЖ (15 %) привело к статистически значимому увеличению ВДП, частоты объективного эффекта и безрецидивной выживаемости [16, 17].
Однако в сравнительном рандомизированном исследовании COMPLETE [12] показано, что по противоопухолевой активности лапатиниб уступает трастузумабу. В нем 636 больных метастатическим HER2+ РМЖ получали в качестве 1-й линии лечения комбинацию лапатиниба или трастузумаба с таксанами (паклитаксел, доцетаксел). Безрецидивная выживаемость в группе больных, получавших лапатиниб, составила 8,8 месяца, в группе трастузумаба – 11,4. По общей выживаемости различий между группами не было.
В исследовании CEREBEL [13] сравнивали эффективность комбинаций капецитабина с трастузумабом и лапатинибом в отношении 475 больных HER2+-РМЖ с метастазами в ЦНС. Предшествующая терапия включала антрациклины или таксаны. Безрецидивная выживаемость в группе больных, получавших лапатиниб, составила 6,6 месяца, в группе получавших трастузумаб – 8. Медиана общей выживаемости также была ниже в группе лапатиниба: 22,4 против 27,3 месяца.
Таким образом, на основе представленных данных лапатиниб используется прежде всего больными HER2+-РМЖ, ранее получавшими трастузумаб и ставшими резистентными к нему.
Препарат продемонстрировал обнадеживающую активность в отношении метастазов в головной мозг. Результатом II фазы клинических исследований применения лапатиниба 39 больными HER2-позитивным РМЖ с метастазами в головной мозг стало достижение 1 частичной ремиссии (частота ответов – 3 %).
У 7 пациентов обеих групп с поражением и без поражения ЦНС медиана ВДП составила 16 недель. Данные об уровне безрецидивной выживаемости были оценены по критериям RECIST. Кроме того, в настоящее время изучаются возможности применения лапатиниба в комбинации с ингибиторами ароматазы и уже имеются данные о его эффективности в комбинации с летрозолом [17].
В исследовании ALTTO (Adjuvant Lapatinib and/or Trastuzumab Treatment Optimization) сравнивали 4 режима лечения: 1 год использовали трастузумаб, 1 год – лапатиниб, комбинация двух препаратов – в течение года, 3 месяца – трастузумаб с последующим 6-недельным перерывом и 7,5 месяцев – лапатиниб. В исследование включен 8381 пациент из 50 стран 6 континентов. Большинство женщин (4613) получали трастузумаб и/или лапатиниб после химиотерапии, остальные получали трастузумаб и/или лапатиниб одновременно или последовательно с химиотерапией. Медиана наблюдения составила 4,5 года. Комбинация лапатиниба с трастузумабом в качестве адъювантного лечения ранних стадий HER2+ РМЖ не показала статистически значимого преимущества в отдаленных результатах лечения [18, 31].
CALGB 40601 (Alliance) – рандомизированное исследование неоадъювантной химиотерапии III фазы с использованием паклитаксела и трастузумаба в еженедельном режиме с лапатинибом или без него. В исследование были включены 305 больных РМЖ. Пациенты получали паклитаксел (80 мг/м2/нед в/в) + трастузумаб (4 мг/кг далее 2 мг/кг/нед в/в) ± лапатиниб (750 мг/сут внутрь) в течение 16 недель перед оперативным лечением. В третьей группе больные получали паклитаксел с лапатинибом (1500 мг/сут). Эта группа вскоре была закрыта на основании отрицательных данных об эффективности и токсичности, полученных из предварительного исследования ALTTO. Частота полного патоморфологического эффекта при лечении паклитакселом, трастузумабом, лапатинибом составила 51 % (42–60 %), паклитакселом и трастузумабом – 40 % (32–49 %), паклитакселом и лапатинибом – 32 % (22–44 %); различия статистически недостоверны (p = 0,11) [19, 20].
В рандомизированном многоцентровом исследовании (NCT01013740) II фазы оценивались эффективность и токсичность комбинации лапатиниба с винорелбином или капецитабином в качестве первой и второй линий химиотерапии метастазирующего РМЖ с гиперэкспрессией HER2 [21].
В первую группу были включены 75 больных, во вторую – 37 (всего 112). Пациенты первой группы получали лапатиниб 1250 мг внутрь ежедневно + винорелбин 20 мг/м2 в/в 1-й, 8-й дни каждые 3 недели. Во второй группе назначали лапатиниб 1250 мг внутрь ежедневно + капецитабин 2000 мг/м2/сут внутрь в 2 приема с 12-часовым интервалом в 1–14-й дни каждые 3 недели. Медиана общей выживаемости в группе лапатиниба и винорелбина составила 24,3 месяца (95 % ДИ – 16,4–26,5), в группе лапатиниба и капецитабина – 19,4 (95 % ДИ – 16,4–27,2). Сорок два пациента при прогрессировании опухолевого процесса получали перекрестный режим, из них 29 – лапатиниб с капецитабином, 13 – лапатиниб с винорелбином. Медиана ВДП после перекреста составила 4 месяца (95 % ДИ – 2,1–5,8) при лечении лапатинибом и капецитабином и 3,2 месяца (95 % ДИ – 1,7–5,1) лапатинибом и винорелбином. Анализ выживаемости без прогрессирования и токсичности показал, что эти два режима сопоставимы.
Еще в одном рандомизированном многоцентровом исследовании (LPT111110; NCT00709618) II фазы оценивались эффективность и токсичность комбинации лапатиниба с винорелбином в качестве первой и второй линий химиотерапии метастазирующего РМЖ с гиперэкспрессией HER2 [22]. Больные получали лапатиниб 1500 мг внутрь ежедневно + винорелбин 20 мг/м2 в/в 1-й, 8, 15-й дни каждые 4 недели до прогрессирования или исключения из протокола. Оценивались частота объективного эффекта, безрецидивная выживаемость, общая выживаемость, время до достижения эффекта, продолжительность эффекта. В исследование были включены 44 больных. Частота объективного эффекта составила 41 % (95 % ДИ – 26,4–55,4; 4 – полных, 14 – частичных эффектов). Медиана безрецидивной выживаемости, составили 24,1 (95 % ДИ 16,9–36,7), медиана времени до достижения эффекта – 7,5 (95 % ДИ 7,1–8,1) и медиана продолжительности эффекта – 32,0 (95 % ДИ 18,0–42,3) недели соответственно.
В исследовании неоадъювантной терапии GeparQuinto частота патоморфологического эффекта при использовании стандартной антрациклин/таксан-содержащей химиотерапии в комбинации с лапатинибом была значительно ниже по сравнению с группой больных, получавших химиотерапию в сочетании с трастузумабом (22,7 против 30,3 %; р = 0,04) [23].
Для больных метастазирующим РМЖ в исследовании MA.31 лапа-тиниб в комбинации с таксанами оказался менее эффективным по сравнению с трастузумабом в комбинации с таксанами по ВДП (8,8 против 11,4 месяца; р = 0,01). По токсич-ности комбинация лапатиниба с таксанами оказалась выше за счет диареи [12].
В настоящее время известно, что лапатиниб не оказывает выраженного кардиотоксического действия.
В рандомизированном исследовании LETLOB II фазы оценивалась эффективность летрозола или летрозола и лапатиниба для пациенток в постменопаузе с гормонально-чувствительным HER2-негативным операбельным РМЖ. Побочные эффекты включали диарею, сыпь, общую слабость. Побочные эффекты III–IV степеней встречались редко [25]. Лапатиниб характеризуется потенциально низкой кардиотоксичностью по сравнению с трастузумабом и активирует аденозинмонофосфаткиназу, ключевой регулятор энергетического обмена и защиты клеток от ишемии [26]. Среди 2812 больных, получавших лапатиниб, только у 1,3 % наблюдалось снижение фракции выброса левого желудочка, которое имело обратимый характер приблизительно для половины пациентов [27].
В настоящее время продолжаются интенсивные исследования по оценке эффективности лапатиниба в сочетании с различными цитотоксиками, препаратами эндокринотерапии, а также с другими таргетными агентами. Изучается возможность применения лапатиниба в качестве адъювантной и неодъювантной терапии.
Международное многоцентровое исследование NeoALLTO показало возможность успешного сочетания лапатиниба и трастузумаба с паклитакселом. Больных инвазивным операбельным (Т > 2 см) HER2-позитивным РМЖ рандомизировали в 3 группы: 1) лапатиниб + паклитаксел, 2) трастузумаб + паклитаксел, 3) лапатиниб + трастузумаб + паклитаксел. После неоадъювантной терапии проведено оперативное лечение, затем 3 курса адъювантной химиотерапия по схеме FEC, далее назначалась терапия лапатинибом в первой группе, трастузумабом во второй и обоими препаратами в третьей группах. Суммарное время использования анти-HER-2-терапии составило 52 недели. Частота полного патоморфологического эффекта оказалась значительно выше в группе лапатиниба и трастузумаба – 51,3 %, тогда как в группе с лапатинибом она была 24 %, а в группе с трастузумабом – 29,5 %.
В клиническом исследовании IIb-фазы CHERLOB пациенты с HER2-позитивным первичным РМЖ (стадии II–IIIА) рандомизировались в группы, получавшие неоадъювантную химиотерапию с трастузумабом, лапатинибом или с обоими препаратами. Целью исследования стало достижение полного регресса опухоли. Результаты данного исследования показали преимущество сочетания лапатиниба и трастузумаба с химиотерапией по сравнению с использованием химиотерапии с трастузумабом или лапатинибом, подтвердив таким образом преимущество двойной ингибиции HER2 [29]
На основе представленных выше данных были разработаны следующие рекомендации по применению лапатиниба.
Лапатиниб показан: 1) при распространенном и/или метастазирующем РМЖ с гиперэкспрессией ErbB2+ (HER2+)-рецепторов в комбинации с капецитабином больным, ранее получавшим терапию с трастузумабом; 2) при распространенном гормонозависимом HER2-положительном РМЖ в сочетании с ингибиторами ароматазы.
Перед началом лечения необходимо оценить уровень фракции выброса левого желудочка, который следует контролировать во время терапии, чтобы не допустить снижения данного показателя ниже допустимых значений. Лечение лапатинибом следует прекратить в случае снижения фракции выброса до ≥ 3-й степени. Лече-ние лапатинибом может быть возобновлено не ранее чем через 2 недели в меньшей дозе (1000 мг/сут) и только если уровень фракции выброса левого желудочка находится в допустимых границах нормы. Постоянное снижение фракции выброса левого желудочка в течение 9 недель лечения, как правило, ограничивает длительность проводимой терапии [29].
Лечение лапатинибом должно быть прекращено и в случае появления легочных симптомов, свидетельствующих о развитии интерстициального легочного процесса/пневмонита ≥ 3-й степени (по классификации нежелательных явлений Национального онкологического института). Решение о прекращении применения или изменении дозы лапатиниба может быть принято, когда уровень развивающихся токсических эффектов соответствует ≥ 2-й степени по классификации нежелательных явлений Национального онкологического института. При снижении уровня токсических эффектов до 1-й степени и менее лечение может быть возобновлено в дозе 1250 мг/сут. В случае повторного возникновения токсических эффектов дозу лапатиниба сле-дует уменьшить до 1000 мг/сут.


