Глюкокортикоиды (ГК) эффективны в лечении различных воспалительных заболеваний и широко используются во многих областях медицины, включая трансплантологию и онкологию. Большинство больных используют препараты местного применения (в основном наружного и ингаляционного), однако определенная доля пациентов принимает системные ГК. При мета-анализе проспективных популяционных исследований, проведенных в различных странах мира, доля лиц, когда-либо в жизни принимавших пероральные ГК (ОГК), составляет 3 % в возрасте 30 лет, увеличиваясь до 5,2 % в возрасте 80 лет [1]. В многонациональном популяционном проспективном наблюдательном исследовании GLOW, включившем 60 393 женщины в возрасте 55 лет и старше, ОГК принимали на период проведения исследования в среднем 3,1 % (от 2,7 до 4,6 % в разных странах) опрошенных пациенток [2].
Экзогенные ГК подавляют костеообразование и усиливают костную резорбцию. Патогенетические механизмы развития глюкокортикоидного остеопороза (ГК-ОП) включают прямое воздействие ГК на костные клетки и опосредованное влияние на транспорт кальция в почках и желудочно-кишечном тракте, выработку половых гормонов и нейромышечную систему.
По данным множества исследований, установлено: постоянный прием системных ГК уже в течение 3 месяцев может приводить к развитию остеопоротических переломов. Остеопоротический перелом – это низкоэнергетический перелом, произошедший спонтанно или при падении с высоты не выше собственного роста человека, включая переломы, развившиеся при кашле, чихании или резком движении. Переломы костей скелета имеют различную локализацию (позвонки, проксимальный отдел бедра, кости таза, предплечья, ребра, диафизы трубчатых костей). Наиболее высокий риск отмечается для переломов позвонков [3], которые, как правило, протекают бессимптомно. По данным мета-анализа, у больных, длительно принимавших ОГК в дозе 5 мг/сут и более в преднизолоновом эквиваленте, относительный риск переломов любой локализации увеличивался в 1,90 раза, перелома бедра – в 2,01, переломов тел позвонков - в 2,86, переломов костей предплечья – в 1,13 раза по сравнению с лицами того же возраста и пола, не принимавшими эти препараты [4]. После отмены терапии ГК минеральная плотность кости может спонтанно увеличиваться, риск переломов снижаться, оставаясь, тем не менее, выше популяционного [1, 4].
Изменилось представление о градации дозы ОГК. В настоящее время высокими являются суточные дозы ОГК ≥ 7,5 мг в преднизолоновом эквиваленте, средними ≥ 2,5 < 7,5 мг, низкими < 2,5 мг [5]. Крупное ретроспективное когортное исследование в Великобритании доказало взаимосвязь между суточной дозой ОГК и риском переломов [6]. Так, относительный риск перелома позвонков по сравнению с контролем при дозе менее 2,5 мг/сут составил 1,55, при дозе 2,5–7,5 мг/сут – 2,59, а при дозе 7,5 мг/сут и более – 5,18, для перелома проксимального отдела бедра – 0,99, 1,77, 2,27 соответственно. Таким образом, увеличение риска переломов наблюдается уже при применении низких суточных доз (< 2,5 мг/сут в преднизолоновом эквиваленте), а с увеличением суточной дозы риск возрастает [3].
Имеются некоторые доказательства, что высокие дозы ингаляционных ГК (> 2000 мкг/сут бекламетазона дипропионата или эквивалентной дозы другого препарата) могут быть ассоциированы со снижением минеральной плотности кости (МПК) и небольшим увеличением риска переломов [7]. Описано также увеличение риска переломов при прерывистом приеме ОГК [8].
Глюкокортикоидный ОП является наиболее частой и тяжелой формой вторичного ОП. В различных странах были созданы клинические рекомендации по ведению больных с ГК-ОП. В 2012 г. рабочей группой Международного фонда остеопороза (IOF) и Европейского общества кальцифицированной ткани (ECTS) были разработаны ключевые положения, на основе которых предполагалось создание национальных клинических рекомендаций, но с учетом особенностей и возможностей отдельной страны. Это позволило бы сформировать врачам различных специальностей разных стран мира единый подход к диагностике и лечению ГК-ОП. В связи с этим 2013 г. под эгидой Российской ассоциации по остеопорозу (РАОП), Российского респираторного общества и Ассоциации ревматологов России была издана новая версия российских клинических рекомендаций «Диагностика, профилактика и лечение глюкокортикоидного остеопороза у мужчин и женщин 18 лет и старше» [9]. Клинические рекомендации имеют определенные ограничения: возраст пациентов 18 лет и старше, прием ОГК, использование разрешенных в РФ препаратов по показанию «глюкокортикоидный (стероидный) остеопороз».
С учетом отсутствия безопасных доз и длительности лечения ОГК в новых клинических рекомендациях указано на необходимость консультации с последующим проведением диагностических, профилактических и лечебных мероприятий в отношении пациентов любого возраста и пола, которым длительно (3 месяца и более) проводится терапия ОГК или только планируется ее проведение.
Диагностика ГК-ОП
Для ОП нет специфических ранних клинических признаков. При сборе анамнеза проводится оценка других факторов риска ОП и переломов (в т.ч. пожилой возраст, низкий индекс массы тела, отягощенный семейный анамнез по переломам проксимального отдела бедра, табакокурение, злоупотребление алкоголем). Необходимо спросить больного о перенесенных переломах, их локализации и уровне травмы. Принимаются во внимание особенности и характер течения основного заболевания, по поводу которого назначены ГК; прогноз в отношении длительности приема препарата и предполагаемой дозы.
При осмотре пациента следует обратить внимание на следующие признаки, которые могут быть связаны с компрессионными переломами позвонков: снижение роста на 2 см и более за предшествующие 1–3 года или на 4 см и более по сравнению с возрастом в 25 лет; появление грудного кифоза, уменьшение расстояния между нижними ребрами и крылом подвздошной кости (2 пальца и менее). Эта симптоматика служит показанием к проведению рентгенографии грудного и поясничного отдела позвоночника в боковой проекции для исключения деформации позвонков.
Клинический осмотр больного включает оценку риска падений. Это актуально для пациентов, принимающих ОГК, в связи с частым развитием глюкокортикоидной миопатии, которая может приводить к падениям и развитию переломов.
Двуэнергетическая рентгеновская абсорбциометрия (ДРА) поясничного отдела позвоночника и проксимального отдела бедра является основным методом измерения МПК у больных, принимающих ОГК. Она необходима для оценки риска развития переломов. По возможности это исследование должно назначаться всем пациентам, которым проводится или планируется длительная (3 месяца и более) терапия ОГК.
В интерпретации МПК к женщинам в постменопаузе и мужчинам 50 лет и старше применяется Т-критерий.
В отличие от постменопаузального ОП или ОП у мужчин другой этиологии, при которых диагноз выставляется при Т-критерии ≤ -2,5 стандартных отклонений (SD), у пациентов, длительно принимающих ОГК, показанием к назначению противоостеопоротических препаратов служат более высокие показатели МПК – Т-критерий ≤ -1,5 SD. Это обусловлено тем, что ГК-индуцированные переломы возникают при значениях МПК, более высоких, чем при переломах у пациентов с постменопаузальным ОП [10–13].
У женщин до наступления менопаузы и у мужчин моложе 50 лет МПК оценивается по Z-критерию, при этом заключение о снижении костной массы по сравнению с возрастной нормой может быть сделано на основании Z-критерия при значении -2,0 SD и ниже. При выявлении у этой категории больных низкой МПК, не сопровождающейся низкоэнергетическими переломами, решение о назначении лечения ОП принимается только при учете всех факторов риска и на основе тщательного рассмотрения всей клинической ситуации.
В связи с тем что в основу выявления больных, нуждающихся в назначении противоостеопоротической терапии, положена стратегия поиска, заключающаяся в установлении лиц с высоким риском переломов, приоритетным направлением становится не факт наличия ОП, а оценка риска развития переломов как основного осложнения ОП. С этой целью был разработан метод FRAX – компьютеризированный алгоритм, позволяющий прогнозировать абсолютный риск переломов у мужчин 50 лет и старше и у женщин в постменопаузе в течение ближайших 10 лет. В Российской Федерации используется российская модель FRAX. Десятилетний абсолютный риск переломов определяют на основе возраста, пола, индекса массы тела и клинических факторов риска (предшествующий остеопоротический перелом, перелом проксимального отдела бедра у родителей, курение в настоящее время, прием ОГК, ревматоидный артрит, заболевания, которые могут приводить к вторичному ОП, злоупотребление алкоголем). В графе «Глюкокортикоиды» надо выбирать «да», если пациент длительно (3 месяца и более) принимает или принимал пероральные ГК в любой дозе. FRAX можно подсчитывать как без учета данных денситометрии, так и введя в соответствующую графу результаты МПК шейки бедра (г/см2 или Т-критерий). Результаты денситометрии позвоночника не могут вноситься в модель FRAX. Результатом подсчета служат две цифры, показывающие 10-летнюю вероятность основных остеопоротических переломов (клинически значимого перелома позвонка, перелома дистального отдела предплечья, перелома проксимального отдела бедра или перелома плечевой кости) и отдельно перелома проксимального отдела бедра.
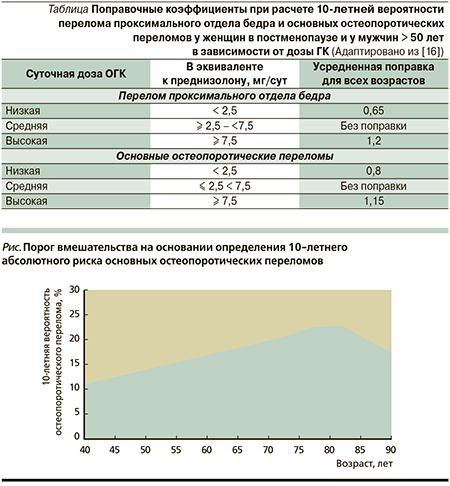
Одно из ограничений FRAX заключается в том, что использование ОГК вводится как дихотомический фактор риска (да/нет) и при этом не учитывается ни суточная доза ГК, ни длительность приема (за исключением того, что прием ГК менее 3 месяцев вообще не учитывается) [14]. Для длительного (более 3 месяцев) применения ГК в модели FRAX подсчитывается риск для средней дозы (≥ 2,5 мг, но < 7,5 мг в сутки) и средней продолжительности терапии ГК [15]. Следует учитывать, что дозы выше средней (≥ 7,5 мг/сут) ассоциированы с более высоким риском переломов и, наоборот, суточные дозы ниже средней (< 2,5 мг) с меньшим риском [3, 15]. В связи с этим по данным популяционных исследований, проведенных в Великобритании, были определены поправочные коэффициенты на суточную дозу ОГК. Их надо учитывать при расчете 10-летней вероятности остеопоротических переломов (см. таблицу) [16].
Например, величина риска основного остеопоротического перелома по FRAX = 17 %. Для пациента, принимающего ОГК в дозе:
- 2,5–7,5 мг/сут: риск соответствует рассчитанному по FRAX = 17 %;
- < 2,5 мг/сут: риск снижается и с учетом поправки равен 17 х 0,8 = 13,6 %;
- ≥ 7,5 мг/сут: риск повышается и с учетом поправки равен 17 х 1,15 = 20 %.
Дальнейшая тактика врача определяется на основании рекомендованного порога вмешательства. В Российской Федерации он зависит от возраста пациента и 10-летнего абсолютного риска основных остеопоротических переломов. График опубликован на сайте Российской ассоциации по остеопорозу (см. рисунок). Если пересечение этих двух параметров пришлось на красную зону графика, пациенту показано лечение противоостеопоротическими препаратами, если на зеленую зону – лечение можно не проводить и оценку риска перелома повторить через год.
Лабораторная диагностика должна включать клинический анализ крови, определение кальция, фосфора, общей щелочной фосфатазы и креатинина в сыворотке крови. На основании креатинина сыворотки крови определяют клиренс креатинина по формуле Кокрофта–Голта для оценки безопасности назначения лекарственных препаратов.
Дополнительные лабораторные тесты применяются в случаях необходимости дифференциальной диагностики с другими заболеваниями и состояниями, которые также могут приводить к развитию вторичного ОП. Исследование костных биохимических маркеров пока не рекомендовано в повседневной практике, поскольку взаимосвязь между изменениями биохимических маркеров и риском переломов при ГК-ОП не оценивалась.
Общие рекомендации по ведению больных, принимающих ОГК
Суточная доза ОГК должна регулярно пересматриваться с учетом динамики и тяжести основного заболевания. Следует назначать минимальные эффективные дозы этих препаратов и при возможности снижать их вплоть до полной отмены. Необходимо рассмотреть другие способы введения ГК (например, для наружного применения, ингаляционные и т.д.) или другие формулы ГК (например, будесонид) В некоторых случаях для снижения суточной дозы ОГК целесообразно назначение других классов препаратов (например, иммуносупрессоров).
Другие рекомендации не отличаются от тех, которые обычно дают пациентам с ОП иной этиологии:
- рациональное питание с употреблением продуктов, содержащих белок, кальций и витамин D;
- поддержание адекватной физической активности и по возможности выполнение физических упражнений с нагрузкой, соответствующей состоянию здоровья;
- прекращение табакокурения и ограничение алкоголя;
- принятие мер по уменьшению риска падений.
Ежедневный прием кальция в комбинации с витамином D рекомендован всем пациентам, начавшим и продолжающим терапию ГК. Адекватное количество кальция (1200–1500 мг/сут) по возможности надо получать из продуктов питания, при необходимости дополняя недостающее его количество приемом лекарственных форм. Необходимо поддерживать уровень 25(ОН)D3 в сыворотке крови не ниже 20 нг/мл (50 нмоль/л), а у больных с переломами – не менее 30 нг/мл (75 нмоль/л) [17]. Верхняя граница 25(ОН)D3 в сыворотке крови не должна превышать 125 нмоль/л. У большинства пациентов доза витамина D составляет 800–1000 МЕ/сут. Витамин D и кальций должны быть обязательным компонентом любой схемы лечения ОП, однако не могут быть использованы в качестве монотерапии.
Показания к назначению противоостеопоротического лечения пациентов, принимающих ОГК
К группе пациентов с показаниями к назначению противоостеопоротического лечения относятся женщины в постменопаузе и мужчины 50 лет и старше, которым проводится или планируется длительная (3 месяца и более) терапия ГК. Во время консультации по ГК-ОП следует обратить внимание на пациентов с высоким риском развития остеопоротических переломов, которые нуждаются в назначении лечения вне зависимости от показателей МПК при ДРА.
К ним относятся больные:
- с низкоэнергетическими переломами в анамнезе;
- 70 лет и старше, поскольку большинство больных в этой возрастной категории при приеме пероральных ГК имеют порог вмешательства по FRAX в «красной зоне»;
- принимающие высокие дозы ГК (≥ 7,5 мг/сут в преднизолоновом эквиваленте).
В остальных случаях следует проводить ДРА. При показателях МПК по Т-критерию -1,5 SD и ниже верифицируют диагноз ГК-ОП. Рекомендации касаются как женщин, так и мужчин.
В отсутствие вышеперечисленных критериев назначения терапии, а также при недоступности остеоденситометрии проводится расчет 10-летней вероятности переломов по FRAX с учетом поправочного коэффициента, описанного выше, и сопоставление его с порогом вмешательства. Если определена «красная зона», диагностируется вероятный ОП с высоким риском переломов (код по МКБ 10: М 81.8 – другие остеопорозы) и назначается лечение. При доступности рентгеновской остеоденситометрии в модели FRAX надо учитывать показатели МПК шейки бедра. Пациенты, имеющие низкий риск переломов по FRAX, нуждаются в динамическом наблюдении.
Показанием к назначению лечения женщин в пременопаузе и мужчин моложе 50 лет, которым проводится или планируется длительная (3 месяца и более) терапия ГК, является наличие низкоэнергетических переломов в анамнезе. У остальных пациентов решение о назначении лечения должно приниматься индивидуально, доказательной базы о необходимости назначения терапии в этих случаях в настоящее время нет. Тем не менее противоостеопоротическая терапия может быть назначена больным с низкой МПК (по Z-критерию ≤ -2 SD) при приеме высоких доз ГК.
Препараты лечения ГК-ОП
Эффективность многих лекарственных препаратов была оценена при лечении больных ГК-ОП. В рандомизированных клинических исследованиях (плацебо-контролируемых или сравнительных) получены доказательства высокого уровня по увеличению МПК поясничного отдела позвоночника и проксимального отдела бедра на терапии бисфосфонатами (алендронат [18–22], ризедронат [23–27] и золедроновая кислота [28]). По данным прямых сравнительных исследований было показано преимущество по влиянию на МПК золедроновой кислоты над ризедронатом [28], а алендроната – над активными метаболитами витамина D (альфакальцидолом и кальцитриолом) [29, 30]. Доказательства снижения риска переломов позвонков были получены в плацебо-контролируемых или сравнительных исследованиях при изучении алендроната [18] и ризедроната [27], хотя переломы не были первичной конечной точкой оценки в данных работах.
Для примера: эффективность алендроната в профилактике развития и лечении ГК-ОП изучалась в рандомизированном клиническом исследовании длительностью более 48 недель, включившем 477 пациентов различного пола и возраста (от 17 до 83 лет), принимавших терапию ОГК (7,5 мг/сут и более в преднизолоновом эквиваленте) по поводу различных заболеваний (ревматологических, пульмонологических, дерматологических, гастроэнтерологических и пр.). 34 % больных недавно начали глюкокортикоидную терапию, у 66 % пациентов она продолжалась более 4 месяцев. МПК поясничного отдела позвоночника увеличилась на 2,1 и 2,9 % соответственно в группах, получавших 5 и 10 мг алендроната ежедневно, и уменьшилась на 0,4 % в группе плацебо. Определены значимые изменения МПК шейки бедра и МПК всего тела по сравнению с исходным уровнем и с МПК в группе плацебо. Все пациенты получали дополнительно кальций в дозе 1000 мг/сут и витамина D 250–500 МЕ/сут [20]. Эффективность терапии алендронатом была показана в последующие 12 месяцев наблюдения у 208 пациентов, продолживших лечение. Через 2 года терапии МПК поясничного отдела позвоночника увеличилась на 2,8 и 3,9 % соответственно в группах, принимавших 5 и 10 мг ежедневно, в то время как в группе плацебо отмечено снижение на 0,8 %.
В шейке бедра наблюдалось стабильное состояние МПК, а в группе плацебо – выраженная отрицательная динамика. Частота морфометрических переломов позвонков в группе алендроната составила 0,7 %, в группе плацебо – 6,8 % (р = 0,026) [18]. Эффективность алендроната не зависела от пола и возраста пациента, суточной дозы и длительности терапии ОГК, от основного заболевания, по поводу которого была назначена глюкокортикоидная терапия, а также от показателей МПК до начала лечения. Это подтверждало эффект препарата в профилактике развития и лечения ГК-ОП на гетерогенной популяции пациентов, принимавших ОГК [18, 22]. В более позднем рандомизированном клиническом исследовании длительностью 12 месяцев была показана положительная динамика МПК поясничного отдела позвоночника и бедра по сравнению с исходными показателями и с МПК группы плацебо при применении алендроната 70 мг 1 раз в неделю [31].
Активные метаболиты витамина D более эффективны в предотвращении потери МПК и уменьшении риска переломов позвонков по сравнению с нативным витамином D, монотерапией кальцием, плацебо или в отсутствие лечения. Анализ в отдельных подгруппах активных метаболитов витамина D показал, что применение альфакальцидола предотвращало переломы позвонков, а кальцитриола – имело только тенденцию к протективному действию [30].
В настоящее время отсутствуют данные о влиянии вышеперечисленных препаратов на периферические переломы, в т.ч. переломы бедра.
В соответствии с решением Комитета по лекарственным препаратам (CHMP) Европейского медицинского агентства (ЕМА) относительно проведенного органами здравоохранения ЕС анализа соотношения пользы и риска, связанных с применением кальцитонина лосося, данный препарат больше не рекомендуется к применению по показанию остеопороза [31].
Все вышеизложенное позволило выделить бисфосфонаты (алендронат, ризедронат, золедроновую кислоту) в группу препаратов первой линии лечения ГК-ОП. Препаратом второго выбора является альфакальцидол.
В клинической практике на выбор лечения конкретного больного влияют еще и переносимость препарата, а также его стоимость.
Бисфосфонаты должны применяться с осторожностью к женщинам детородного возраста, что связано с длительным периодом их полувыведения из кости, проникновением препаратов через плаценту и возможным эффектом на скелет развивающегося эмбриона. При необходимости назначения лечения бисфосфонатами пациентка должна быть предупреждена о возможном нежелательном эффекте на плод и информирована о необходимости длительного приема контрацептивных препаратов.
При отмене ГК-терапии возможно прекращение лечения противоостеопоротическими препаратами. Если длительная терапия ГК продолжается, лечение ОП тоже должно быть продолжено.
Наблюдение за пациентами, принимающими ОГК
Минимум врачебного наблюдения включает контроль приема пациентом рекомендованной терапии противоостеопоротическими препаратами, ее дозы, достаточности получения кальция и витамина D. Необходимо выявлять новые переломы, при этом надо учитывать, что переломы ребер и позвонков особенно часты при ГК-ОП. Ежегодно следует измерять рост пациента и при его значительном снижении (более 2 см) или появлении других признаков, позволяющих заподозрить переломы позвонков, необходимо проводить рентгенографию позвоночника или при доступности – морфометрию позвонков в боковой проекции с помощью ДРА. При возможности необходимо ежегодное измерение МПК методом ДРА.
Таким образом, длительный прием ОГК является одним из основных факторов риска развития ОП. В новых клинических рекомендациях подчеркивается необходимость проведения диагностических и профилактических мероприятий для всех больных, которым проводится или планируется терапия ОГК на срок 3 месяца и более. Пациенты группы высокого риска развития переломов нуждаются в раннем назначении лечения противоостеопоротическими препаратами.


