Остеопороз (ОП) – это серьезная медико-социальная проблема, что обусловлено широкой распространенностью недуга, которая увеличивается с возрастом как у мужчин, так и у женщин, поздней диагностикой и отрицательным влиянием на качество и продолжительность жизни людей. Важная особенность этого заболевания заключается в снижении прочности кости, из-за чего со временем многие пациенты получают опасные осложнения этого заболевания – переломы при минимальных травмах [3, 6, 21]. Известно, что минеральная плотность костной ткани (МПКТ) не единственный показатель, определяющий прочность кости, поскольку часть переломов происходит при остеопении или даже нормальных значениях МПКТ. Большое значение имеют качество костной ткани и его составляющие компоненты (микроархитектоника, геометрия, скорость ремоделирования, накопление повреждений, степень минерализации, свойства коллагена/минерального матрикса) [8, 31]. Таким образом, прочность кости отражает интегрированный показатель качества кости и МПКТ.
С учетом этиологии и особенностей выделяют первичный и вторичный ОП. Среди всех форм преобладающей считается первичный ОП, который является самостоятельным заболеванием и чаще встречается у женщин в постменопаузе. На долю вторичных форм в общей структуре ОП приходится около 15–20%. В большинстве случаев – это проявление других заболеваний или следствие приема лекарственных средств, отрицательно воздействующих на костную ткань [20, 25]. Важно помнить, что при вторичном ОП потенциальный риск переломов сопоставим с таковым при его первичной форме. Среди вторичного ОП наиболее распространен стероидный и ОП при эндокринных и ревматологических заболеваниях [5, 34].
В патогенезе постменопаузального ОП пусковым фактором является дефицит эстрогенов, вызывающий ускорение потери костной массы [3, 10, 11]. До менопаузы костное ремоделирование происходит синхронно и объем резорбированной кости равен объему образованной кости. После менопаузы объем резорбции превышает объем формирования костной ткани [31]. При продолжительном отрицательном балансе трабекулы истончаются, теряют свою пластинчатую структуру и становятся цилиндрическими, возрастает биомеханическая нагрузка и напряжение, что приводит к перфорации и разрушению трабекул [26]. Происходит снижение МПКТ и ухудшается качество костной ткани [26, 29]. При этом костные потери могут достигать ежегодно 5% [3, 23]. Со временем масса кости снижается примерно на 25–30%, чему сопутствует повышение риска переломов под влиянием даже минимальных нагрузок. Вместе с тем все женщины в менопаузе имеют недостаточность эстрогенов, но ОП развивается только у каждой третьей из них. Это свидетельствует о влиянии различных, в т.ч. генетических, факторов на возникновение и развитие ОП. К факторам риска развития постменопаузального ОП относятся пожилой возраст, низкая масса тела, злоупотребление алкоголем, кофеином, курение, семейный анамнез заболевания, указания на предшествующие малотравматичные переломы, низкий индекс массы тела (менее 20 кг/м²), ранняя менопауза (до 45 лет), аменорея (более года) в репродуктивном возрасте, овариэктомия в молодом возрасте, иммобилизация [3, 8, 10].
В любом возрасте, в т.ч. в постменопаузе, на фоне возрастного дефицита эстрогенов наиболее выраженные изменения происходят в трабекулярной (губчатой) кости, в основном представленной в телах позвонков, плоских костях, в костях предплечья и в пяточных костях. Так, например, масса трабекулярной кости позвонков снижается в год на 5%, а кортикального слоя – на 1,5%.
Основным клиническим проявлением ОП и одним из ведущих факторов риска последующих переломов является перенесенный пациентом перелом на фоне незначительной травмы [2, 3, 8]. Переломы тел позвонков, как правило возникающие раньше остеопоротических переломов любой другой локализации, являются наиболее частым осложнением заболевания, составляя около половины всех переломов [7, 17, 18]. ОП – это основная причина переломов шейки бедра, часто встречающихся у женщин старше 65 лет [6]. После возникновения первого перелома запускается т.н. каскад переломов, при этом риск повторного остеопоротического перелома позвонка повышается по крайней мере вчетверо [6], а риск повторного перелома бедра удваивается [16]. Самый высокий риск повторных переломов наблюдается в течение первого года: риск перелома позвонков в течение года после предшествовавшего перелома выше в 6,1 раза [18]. Вне зависимости от показателей МПКТ наличие низкоэнергетического перелома позволяет поставить диагноз «тяжелый остеопороз».
К наиболее тяжелым формам вторичного ОП относится стероидный ОП [4, 7, 8]. Длительный избыток глюкокортикоидов (ГК) любой природы способен приводить к развитию ОП и высокому риску переломов [8, 35]. Хотя эндогенный гиперкортицизм (болезнь, или синдром, Иценко–Кушинга) достаточно редкая патология, остеопоротическое поражение костей скелета встречается более чем у половины больных при различных формах эндогенного гиперкортицизма [33, 34]. Более частой проблемой является изменение прочности костной ткани как опасное осложнение глюкокортикоидной терапии (ятрогенный гиперкортицизм). Несмотря на неоспоримую пользу, эти препараты несут потенциальный риск [33, 35]. О колоссальном значении обсуждаемой проблемы свидетельствует тот факт, что остеопоротические переломы наблюдаются у 30–50% пациентов, получающих терапию синтетическими ГК. Причем прочность костной ткани начинает снижаться уже на ранних этапах фармакотерапии [4, 5]. Известно, что потеря костной массы, вызванная приемом ГК, нарастает по мере возрастания суточной и кумулятивной доз, а также длительности применения лекарственного средства. В частности, относительный риск переломов возрастает на 62% при увеличении суточной дозы препарата на каждые 10 мг [33]. До сих пор неясно, существует ли относительно безопасная доза ГК? Даже прием минимальных доз преднизолона (2,5 мг) не исключает отрицательного воздействия на костную прочность. Наиболее высокий риск существует для больных, получающих ГК в дозе 7,5 мг/сут и более в эквиваленте к преднизолону [4, 31].
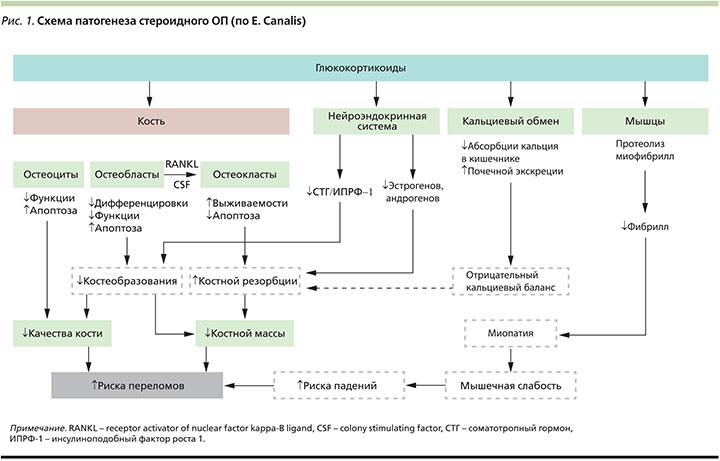
ГК оказывают различное действие на костную ткань и минеральный обмен (рис. 1). В результате воздействия на кость избыточного количества ГК усиливается апоптоз остеобластов, подавляются их активность; замедляется созревание клеток предшественников остеобластов и угнетается остеобластогенез. Возрастает подавляющее действие ПТГ (паратиреоидный гормон) на зрелые остеобласты, что приводит к подавлению костеобразования. Наряду с этим снижается синтез остеобластами коллагена I типа, уменьшается количество костного матрикса, что особенно выражено при эндогенных формах гиперкортицизма [4, 5]. В отношении ГК стало известно, что они влияют на систему костных регуляторных белков (остеопротегерин: рецептор – активатор ядерного фактора NF–kB RANKL – Receptor activator of nuclear factor kappa-B ligand): подавляют продукцию остеопротегерина, противодействующего процессу дифференциации и активизации остеокластов, способствующего формированию кости, и усиливают выработку RANKL, что приводит к стимуляции созревания и повышения резорбтивной активности остеокластов [19, 31]. Определенный вклад в подавление костеобразования при гиперкортицизме вносит снижение продукции тестостерона у мужчин и эстрадиола у женщин [8].
В наши дни существует эффективное лечение ОП, сочетающее нефармакологические подходы с современными антиостеопоротическими препаратами. Для лечения ОП используется несколько групп препаратов различной направленности и разных механизмов действия. В зависимости от влияния на костное ремоделирование фармпрепараты для лечения ОП делятся на антирезорбтивные и анаболические (стимулирующие костеобразование). Антирезорбтивные препараты уменьшают активность процессов ремоделирования кости и увеличивают минерализацию костной ткани [3, 20, 22, 29]. Единственный препарат из группы костноанаболических, стимулирующий формирование новой костной ткани, – это терипаратид [1, 27, 28].
Терипаратид увеличивает количество и активность остеобластов, осуществляющих костеобразование, в результате новая костная ткань заполняет резорбционные полости и создает новый слой костной ткани. Именно этот процесс обусловливает увеличение костной массы, прочности костной ткани и повышение МПКТ [1, 32]. Регуляция костного ремоделирования является сложным процессом, происходящим под влиянием множества локальных и системных факторов, факторов внешней среды и в значительной мере – механической нагрузки на кость. Терипаратид (рекомбинантный человеческий ПТГ) является активным фрагментом эндогенного человеческого ПТГ (1–34). Напомним, что наибольший вклад в регуляцию костного ремоделирования минерального гомеостаза вносит ПТГ – полипептид с молекулярной массой около 9500, построенный из 84 аминокислотных остатков. Причем N-концевой участок (1–34) обладает биологической активностью и достаточен для регуляции минерального гомеостаза [24]. Основная функция ПТГ заключается в регуляции гомеостаза кальция в организме. Наряду с этим он оказывает влияние на обмен фосфора и магния. Органами-мишенями ПТГ являются кости, почки и кишечник.
Синтез и секреция ПТГ находятся в обратной зависимости от концентрации Са2+ в крови. Действие ПТГ осуществляется в трех направлениях [15, 24]:
- усилении высвобождения кальция из костей;
- снижении почечного клиренса кальция (увеличивает реабсорбцию кальция в дистальных канальцах почек, уменьшая его экскрецию);
- стимуляции выработки в почках 1,25(OH)2D3 (повышая активность 1-α гидроксилазы в почках, ПТГ увеличивает конверсию 25(OH)D3 в 1,25(ОН)2D3).
ПТГ обладает двунаправленным действием, что известно как парадокс ПТГ. В частности, прерывистое подкожное введение ПТГ способствует увеличению массы костной ткани, улучшению архитектуры костной ткани, повышению биомеханической прочности, снижению риска остеопоротических переломов [8, 22]. Вместе с тем постоянное воздействие высокой концентрации ПТГ приводит к резорбции костной ткани и гиперкальциемии [3]. Эндогенный ПТГ вырабатывается как постоянно (базальный уровень секреции, постоянное воздействие), так и импульсно (прерывистое воздействие) [24, 27].
Говоря о механизме действия терипаратида, следует отметить, что анаболический эффект (воздействие ПТГ на остеобласты) реализуется через увеличение дифференцировки стволовых клеток в клетки остеобластического ряда, кроме того, увеличивается продолжительность жизни остеобластов и уменьшается частота апоптоза, что также способствует повышению числа остеобластов. ПТГ стимулирует весь процесс костного ремоделирования, в целом повышается костный обмен, однако формирование костной ткани всегда преобладает над резорбцией [12, 19].

Механизмы повышения костеобразования в ответ на введение интермиттирующих доз ПТГ реализуются через специфические рецепторы ПТГ гликопротеинами с молекулярной массой около 800 кДа. Через взаимодействие ПТГ/рецептор к ПТГ увеличивается экспрессия Runx2 (фактор транскрипции и дифференцировки остеобластов), повышается экспрессия других генов, способствующих дифференцировке остеобластов, в результате чего повышается остеобластогенез и выживаемость остеобластов [12, 24, 32].
В исследованиях показано, что ежедневное однократное введение терипаратида стимулирует образование новой костной ткани на трабекулярной и кортикальной поверхностях костей с преимущественной стимуляцией активности остеобластов по отношению к активности остеокластов, как следствие – наблюдается положительный баланс костного ремоделирования за счет выраженного формирования новой костной ткани [9, 14, 27].
С клинических позиций большой интерес представляет ключевое рандомизированное исследование профилактики переломов NEER (Fracture Prevention Trial) с участием 1637 женщин в постменопаузе (не менее 5 лет после менопаузы) с перенесенными ранее одним и более переломами позвонков умеренной степени или двумя и более переломами позвонков легкой степени (средний возраст – 69,5 лет, среднее число переломов позвонков ≈2,3, средняя МПКТ в поясничном отделе позвоночника=-2,6 СО – стандартное отклонение) [22]. Пациенток рандомизировали в три группы, получавших плацебо (n=544) или терипаратид в виде подкожных (п/к) инъекций в разных дозировках: 20 мкг (n=541) и 40 мкг (n=552). Все пациентки получали кальций (1000 мг) и витамин D (400–1200 ME) за 1–2 месяца перед рандомизацией и весь период исследования. Средняя длительность лечения составила 18 месяцев. Рентгенограммы позвоночника оценивали в начале и в конце исследования, также были проведены серии измерений массы костной ткани методом двухэнергетической рентгеновской абсорбциометрии.
Ключевые точки исследования включали вертебральные переломы, невертебральные переломы, МПКТ и оценку безопасности лечения. По результатам исследования, на фоне терипаратида в дозе 40 мкг наблюдался такой же риск переломов, что и в группе терипаратида 20 мкг, но число побочных эффектов было выше.
Результаты работы показали, что снижение риска всех новых вертебральных переломов (по полуколичественной оценке) в группе терипаратида составило 65%, а новых вертебральных переломов средней и выраженной степеней тяжести (снижение высоты тела позвонка от 25 до 40% и более) – 90% (рис. 2). Другое важное доказательство эффективности терипаратида – статистически достоверное снижение относительного риска невертебральных переломов на 53% (бедро, лучевая кость, голеностоп, плечевая кость, ребра, стопа и таз).
Применение терипаратида также способствовало повышению МПКТ.
В частности, статистически достоверное увеличение МПКТ поясничного отдела позвоночника наблюдалось после 3 месяцев лечения, прирост МПКТ в поясничном отделе позвоночника был статистически значимо выше в группе лечения терипаратидом в дозе 20 мкг. По сравнению с плацебо у женщин в группе терипаратида 20 мкг МПКТ поясничного отдела позвоночника увеличилась на 10%, а в шейке бедренной кости – на 2,8% [22].
Для клинической практики важно, что увеличение продолжительности терапии терипаратидом снижает риск низкоэнергетических невертебральных переломов. Последующий post hoc-анализ данных исследования FPT показал, что по сравнению с плацебо коэффициент риска невертебральных остеопоротических переломов снижался на 9,1% на каждый дополнительный месяц лечения терипаратидом в дозе 20 мкг (p=0,002) [28].
В рамках исследования FPT в подгруппе парных биопсий изучена эффективность применения терипаратида при оценке его способности улучшать структуру кости в группе женщин, включенных после периода лечения со средней продолжительностью 19 месяцев (подгруппа парных биопсий) [13]. В частности, был проведен анализ 51 парной биопсии гребня подвздошной кости (плацебо – n=19, терипаратид 20 мкг – n=180 и терипаратид 40 мкг – n=14 с использованием двухмерной (2D) гистоморфометрии и трехмерной (3D) микрокомпьютерной томографии). При проведении анализа две группы терипаратида были объединены в одну. Полученные результаты четко показали, что применение терипаратида способствует статистически значимому увеличению объема и связанности губчатой кости, улучшению морфологии трабекул с тенденцией к пластинчатым структурам, а также увеличению толщины кортикального слоя. Применение терипаратида не было связано с развитием остеомаляции. Подобные положительные изменения свидетельствуют о реверсии структурных нарушений кости и позволяют объяснить выраженное снижение частоты остеопоротических переломов позвонков, которое показано в рандомизированных клинических исследованиях терипаратида.
Для оценки влияния терипаратида на риск новых переломов позвоночника (метод количественной морфометрии – КМ) была отобрана группа из 892 пациентов исследования FPT (из них на терапии плацебо – 448, терипаратидом 20 мкг – 444). Пациентам была проведена повторная оценка рентгенограмм позвоночника слепым методом с целью определения частоты вертебральных переломов при соответствии позвонков следующим критериям:
- сокращение высоты позвонка на 20%, согласно КМ;
- соответствующее снижение высоты позвонка на 4 мм;
- увеличение как минимум на 1 степень, согласно визуальной полуколичественной оценке, проводимой рентгенологом.
В группе терипаратида статистически достоверное снижение относительного риска новых переломов позвонков, согласно методу КМ, составило 84%.
В Европейском наблюдательном исследовании препарата терипаратид (EFOS) проводили оценку частоты клинических вертебральных и невертебральных остеопоротических переломов, боли в спине, а также качества жизни, связанного с состоянием здоровья (HRQoL, EQ-5D) у женщин с постменопаузальным ОП, получавших лечение в течение 18 месяцев в 8 европейских странах [10]. Все 1648 женщин, включенных в исследование, ранее не получали лечения терипаратидом, 91,0% из них ранее получали лечение другими антиостеопоротическими препаратами, 72,8% завершили 18-месячный период исследования.
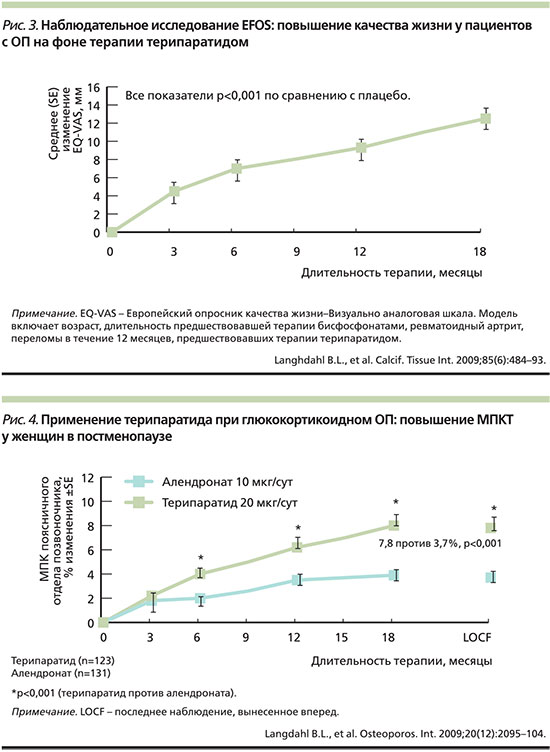
Важным преимуществом применения терипаратида стало существенное уменьшение боли в спине у пациенток уже через 3 месяца от начала лечения, сохранявшееся на протяжении периода терапии продолжительностью 18 месяцев, а также не менее 18 месяцев после отмены терипаратида. За период наблюдения было отмечено 168 случаев клинических переломов у 138 (8,8%) женщин (821 перелом/10000 пациенто-лет) и сокращение шанса переломов на 47% за последний полугодовой период по сравнению с первым 6-месячным периодом (р<0,005). Причем за 36 месяцев наблюдения от начала терапии и до 18 месяцев после окончания терапии средний балл при оценке боли в спине по Визуальной аналоговой шкале (ВАШ) снизился на 25,8 мм (с 57,8; р<0,001). Оценка по шкале EQ-VAS (EuroQol visual analogue scale) показала, что среднее изменение по сравнению с началом терапии составило 13 мм к 18-му месяцу исследования. Максимальные улучшения были отмечены в субдоменах обычной деятельности и боли/дискомфорта шкалы EQ-5D. В исследовании EFOS было показано не только уменьшение частоты переломов и боли в спине, но и улучшение качества жизни женщин, получавших терипаратид (рис. 3) [10].
Опыт клинических исследований свидетельствует, что терипаратид высокоэффективен при разных формах ОП. Как уже отмечалось выше, длительный избыток ГК любой природы (эндо- или экзогенный) способен приводить к развитию ОП и его осложнений и одной из важных медицинских проблем является терапия стероидного ОП [34, 35]. В этом плане интерес представляют результаты рандомизированного двойного слепого контролируемого исследования K.G. Saag и соавт. терипаратида в лечении глюкокортикоидного ОП (исследование GIOP) с препаратом контроля (алендронат) [30]. В исследовании приняли участие мужчины и женщины в возрасте старше 21 года (n=428, из них 345 женщин), получавшие системную терапию ГК не менее 3 месяцев (эквивалент преднизолона – более 5 мг/сут), с МПКТ поясничного отдела позвоночника или проксимального отдела бедренной кости ≤-2 или МПКТ≤-1 плюс один или более остеопоротических переломов в анамнезе.
Пациентов рандомизировали в две группы: 1-я группа получала терипаратид в дозе 20 мкг ежедневно п/к+плацебо перорально ежедневно (n=214, включая 137 женщин в постменопаузе), 2-я группа – алендронат 10 мг перорально ежедневно+плацебо п/к ежедневно (n=214, включая 143 женщины в постменопаузе). Все пациенты получали кальций и витамин Д. Первичные конечные точки включали динамику МПКТ поясничного отдела позвоночника за 18 месяцев, вторичные конечные точки – динамику МПКТ проксимального отдела бедра, маркеров костного обмена, время до динамики МПКТ в поясничном отделе позвоночника и проксимальном отделе бедра, вертебральные переломы, невертебральные переломы, безопасность терапии. В половине случаев в каждой группе причиной применения ГК был ревматоидный артрит.
В ходе исследования было четко показано, что применение терипаратида при глюкокортикоидном ОП приводит к значительному более высокому повышению МПКТ в поясничном отделе позвоночника по сравнению с алендронатом. В частности, динамика МПКТ в поясничном отделе позвоночника у женщин в постменопаузе за 18 месяцев терапии составила 7,8% в группе терипаратида и 3,7% в группе алендроната (р<0,001) (рис. 4); динамика МПКТ в поясничном отделе позвоночника у мужчин за 18 месяцев терапии составила 7,3% в группе терипаратида против 3,7% в группе алендроната (р<0,03). Подобные результаты в отношении динамики МПКТ за 18 месяцев фармакотерапии в поясничном отделе позвоночника продемонстрированы и у женщин в пременопаузе: 7,0% в группе терипаратида против 0,7% в группе алендроната (р<0,001). Следует отметить, что по сравнению с группой пациентов, принимавших алендронат, у значимо меньшего числа пациентов, принимавших терипаратид, случались вертебральные переломы [30].
Итак, применение терипаратида пациентами с ОП, вызванным приемом ГК, приводит к значительному более высокому по сравнению с алендронатом повышению МПКТ в поясничном отделе позвоночника и в бедре. Одним из объяснений более высокой эффективности применения терипаратида в лечении глюкокортикоидного ОП на фоне минимального эффекта на терапии алендронатом является различное влияние препаратов на процессы ремоделирования кости. Хорошо известно, что основным патогенетическим механизмом глюкокортикоидного ОП является снижение костеобразования, резорбция затронута в меньшей степени.
Терипаратид обладает благоприятным профилем безопасности, доказанным в долгосрочных исследованиях [22, 30]. Нет необходимости в коррекции дозы для пациентов с клиренсом креатинина ≥30 мл/мин. Назначение терипаратида не показано пациентам с клиренсом креатинина менее 30 мл/мин. При лечении терипаратидом, по данным клинических исследований, наиболее частыми побочными эффектами были боль в конечностях, тошнота, головная боль и головокружение, для минимизации которых возможно рекомендовать применение препарата перед сном. Терипаратид выпускается в виде предзаполненной шприц-ручки, рекомендуемая доза препарата составляет 20 мкг, вводится 1 раз в сутки п/к в область бедра или живота; максимальная продолжительность лечения терипаратидом составляет 24 месяца [1].
В настоящее время существуют следующие показания к назначению терипаратида:
- лечение ОП у женщин в постменопаузальном периоде;
- лечение первичного ОП или ОП, обусловленного гипогонадизмом у мужчин;
- лечение у мужчин и женщин ОП с повышенным риском переломов, обусловленного длительной системной терапией ГК [1].
Подводя итоги, следует отметить, что при своевременных медикаментозных вмешательствах можно уменьшить риск возникновения остеопоротических переломов и повысить качество жизни пациента. Терипаратид – высокоэффективный костноанаболический препарат, который повышает МПКТ у пациентов с высоким риском низкоэнергетических переломов и дает новые возможности решения основной цели лечения заболевания – снижения риска переломов различных локализаций.



