Инфекционный мононуклеоз (ИМ) – полиэтиологичное инфекционное заболевание, вызываемое различными вирусами семейства Herpesviridae с преобладанием Эпштейна–Барр вирусной (ВЭБ) и цитомегаловирусной (ЦМВ) этиологии в виде как моно-, так и микст-инфекции. Согласно международной статистической классификации болезней 10-го пересмотра, по этиологическому признаку выделяют В27.0 – мононуклеоз, вызванный гамма-герпетическим вирусом; мононуклеоз, вызванный ВЭБ; В27.1 – ЦМВ мононуклеоз; В27.8 – другой инфекционный мононуклеоз; В27.9 – инфекционный мононуклеоз неуточненный.
По данным сероэпидемиологических исследований, почти у 95 % населения старше 40 лет выявляются специфические антитела к ВЭБ, около 50 % населения переносят инфекционный мононуклеоз в детском или подростковом возрасте [1–3]. Известно, что ВЭБ является представителем онкогенных ДНК-содержащих вирусов: доказано участие ВЭБ в развитии лимфомы Беркитта, назофарингиальной карциномы, волосатой лейкоплакии [4].
Предполагается этиологическая роль ВЭБ при синдроме хронической усталости, аутоиммунных заболеваниях, ВЭБ-ассоциированном гемофагоцитарном синдроме; имеются свидетельства о возможной роли вируса в патогенезе нефритов [5, 6]. Распространенность ЦМВ, другого часто выявляемого этиологического фактора ИМ, также чрезвычайно широка. В различных странах уровень серопозитивных лиц к ЦМВ колеблется в пределах 25–95 %, уже в первые 5 лет жизни у детей частота положительных серологических маркеров ЦМВ достигает 60 % [7]. Несмотря на активное участие иммунной системы, ВЭБ и ЦМВ могут сохраняться в организме после латентного или манифестного инфекционного мононуклеоза пожизненно и заболевание может принимать хроническое рецидивирующее течение, а также трансформироваться в иммунодефицитное состояние [8].
Инфекционный мононуклеоз характеризуется полиорганностью поражения, в т.ч. развитием лихорадки, генерализованной лимфоаденопатией, тонзиллитом, увеличением печени и селезенки, характерными изменениями гемограммы [9]. Помимо основного симптомокомплекса при этом заболевании могут быть экзантема и энантема, одутловатость лица, пастозность век, диарея и др.
Для ИМ характерны изменения в гемограмме: лейкоцитоз (до 15–30 × 109/л), иногда более значительный, но возможна и лейкопения, увеличение количества одноядерных элементов крови и умеренное повышение СОЭ (до 20–30 мм/ч). Для установления диагноза ИМ основными морфологическими показателями гемограммы служат повышение абсолютного и относительного числа лимфоцитов и обнаружение атипичных мононуклеаров. На ранних стадиях это В-лимфоциты, содержащие специфические иммуноглобулины в цитоплазме. В последующие стадии клинических проявлений большую часть атипичных мононуклеаров составляют Т-клетки. Атипичные мононуклеары появляются ко 2-й неделе заболевания и сохраняются от 1–2 до 4–12 недель. Для этиологической верификации ИМ в настоящее время широко используют специфические исследования (ИФА, ПЦР), позволяющие с высокой степенью точности выявлять этиологические маркеры болезни и сроки заболевания. Установлено, что наибольшую значимость для диагностики ВЭБ-инфекции имеет определение следующих антител методом ИФА: IgM и IgG к раннему антигену (EA), капсидному антигену (VCA) и ядерному антигену (EBNA) [10]. Метод ИФА применяется и для ранней диагностики ЦМВ с определением IgМ и IgG. Метод ПЦР основан на определении генома ВЭБ и ЦМВ в образцах материала больных.
В настоящее время в комплексной терапии ИМ широко применяются интерфероны. Интерфероны относятся к цитокинам, представлены семейством белков, обладающих антивирусной, иммуномодулирующей, противоопухолевой и другими видами активности [11]. В работах отечественных ученых показана эффективность применения Виферона, Кипферона, интерферона альфа-2β (Реаферон-ЕС-Липинт) при ИМ [11–13]. В связи с этим представляет интерес исследование эффективности рекомбинантного интерферона α-2β в терапии этого заболевания. В его состав включен таурин, который повышает биологический эффект действия интерферона за счет антиоксидантных свойств и усиления регенерации поврежденных тканей, не содержит анестезина, в качестве основы – твердый жир, обладающий низким аллергенным потенциалом.
Инфекционный мононуклеоз является актуальной проблемой инфекционной патологии, связанной с ростом заболеваемости, преимущественно у детей, полиэтиологичностью, выраженным полиморфизмом клинических проявлений, полиорганностью поражений, возможностью формирования хронического течения и иммунодефицитного состояния. В то же время остаются открытыми вопросы своевременной клинической диагностики и этиотропного лечения данного заболевания, что послужило основанием к проведению настоящего исследования.
Материал и методы исследования
В исследование были включены 280 госпитализированных больных этиологически верифицированным ИМ, возраст которых варьировался от года до 30 лет. При постановке диагноза руководствовались международной статистической классификацией болезней 10-го пересмотра.
Критерий включения в исследование:
- госпитализированные больные ИМ, этиологически подтвержденным данными клинико-лабораторного обследования (с острым ИМ – 270 пациентов и 10 – с обострением хронического ИМ).
Критерии исключения:
- ИМ неуточненной этиологии (не ВЭБ- и не ЦМВ-этиологии);
- наличие микст-инфекций (острые кишечные инфекции, вирусные гепатиты, скарлатина, коклюш и другие инфекции);
- наличие у больных тяжелых соматических заболеваний, пороков развития и воспалительных заболеваний аноректальной области.
Серологическая диагностика осуществлена методом ИФА с определением в крови маркеров ВЭБ- (IgM VCA-, IgG EA-, IgG VCA-авидность) и ЦМВ-инфекции (IgM-, IgG-авидность); определены ДНК-ЕВV, ДНК-СМV методом ПЦР и имунологические показатели (IgА, IgМ, IgG, CD4, CD8, CD4/CD8, РБТЛ с ФГА, ЦИК, НСТ-тест); проведены стандартные лабораторные и инструментальные исследования. Полученные цифровые данные обработаны методами статистического анализа с использованием прикладной программы «Statistica.6».
Результаты
В 96,1 % случаев ИМ протекал в типичной форме со средней степенью тяжести. У 72,8 % больных заболевание начиналось остро с лихорадки и появления симптомов интоксикации.
В 27,2 % случаев имело место посте-пенное начало заболевания с продромальными симптомами. Увеличение размеров лимфоузлов отмечено у 98,6 % больных, тонзиллит по типу лакунарной ангины – у 90,4 %, гепатомегалия – у 81,4 %, спленомегалия – у 50,4 %, затруднение носового дыхания – у 52,3 %. В более редких случаях наблюдались одутловатость лица (21,8 %), экзантема (17,6 %), афтозный стоматит (8,9 %). Выявлены наиболее характерные изменения гемограммы при ИМ: лейкоцитоз (83,9 %) и атипичные мононуклеары (87,9 %).
Осложнения (острый миокардит, пневмония, отит, спленит) встречались у 5,8 % больных независимо от этиологии заболевания. Выявлено, что выраженность клинических проявлений ИМ зависит от этиологии заболевания (ВЭБ, ЦМВ или микст-инфекция – ВЭБ + ЦМВ). Так, ИМ, вызванный ВЭБ, достоверно чаще сопровождается развитием тонзиллита (по типу лакунарной ангины), изолированным увеличением шейных лимфоузлов, гипертермией, появлением атипичных мононуклеаров у большинства пациентов, сопровождается развитием гепатита (26,2 %) и характеризуется постепенным началом заболевания в 29,2 % случаев. Инфекционный мононуклеоз, вызванный ЦМВ, начинается остро, реже развивается тонзиллит, чаще возникают спленомегалия и лейкоцитоз по сравнению с ВЭБ-инфекцией, реже в крови появляются атипичные мононуклеары и реже, чем при ВЭБ и ВЭБ + ЦМВ, развивается гепатит (р < 0,05). Инфекционный мононуклеоз микст-этиологии (ВЭБ + ЦМВ) имеет выраженную (манифестную) клиническую картину (тонзиллит, генерализованная полилимфаденопатия, гепатоспленомегалия, наличие атипичных мононуклеаров в крови более 20 %), чаще характеризуется развитием тяжелых форм заболевания, формированием на высоте заболевания гепатита с повышением уровня трансаминаз; у 34,5 % больных ИМ микст-этиологии может развиваться постепенно (р < 0,05).
Установлено, что развитие ИМ имеет возрастные особенности (р < 0,05). Так, у детей первых 4 лет жизни чаще, чем в других возрастных группах (37,2 %), определяется ИМ ЦМВ этиологии с характерными клиническими проявлениями заболевания; выраженным затруднением носового дыхания, лейкоцитозом. У детей в возрасте от 4 до 7 лет чаще (р < 0,05) наблюдается ВЭБ-инфекция (76,2 %) с манифестными формами заболевания с характерными клиническими симптомами и гематологическими изменениями (атипичные мононуклеары выявлены у 94,6 % пациентов). В старших возрастных группах достоверно чаще развивается микст-инфекция, тяжелая степень болезни, чаще встречается поражение печени. Риск хронизации инфекции возникает с 4-летнего возраста и более характерен для подростков и взрослых (р < 0,05).
Спектр типичных клинических симптомов и гематологических изменений при ИМ не зависит от пола пациентов. Но у лиц мужского пола чаще наблюдается заболевание в тяжелой степени (р < 0,05) с развитием осложнений; достоверно чаще развиваются ИМ, вызванный ЦМВ, и микст-этиологии; для лиц женского пола более характерны проявления гепатита (р < 0,05) и развитие хронического течения заболевания.
Полиморфизм клинических проявлений ИМ создает определенные трудности в своевременной диагностике заболевания и приводит к диагностическим ошибкам на догоспитальном этапе, особенно у детей раннего возраста.
Для оценки значимости каждого из ведущих клинических признаков ИМ был проведен статистический анализ данных с применением непараметрического метода – ранговый дисперсионный анализ и конкордация М. Кендалла. При исследовании этим статистическим методом основные (опорные) клинические признаки ИМ распределились в три клинико-патогенетических синдрома: 1) лимфопролиферативно-тонзиллярный (с развитием лимфаденопатии, тонзиллита и симптомов интоксикации); 2) лимфопролиферативно-паренхима-тозный (с затрудненным носовым дыханием, поражением печени и развитием спленомегалии); 3) лимфостатически эктодермальный (с одутловатостью лица, экзантемой и стоматитом). Своевременное выявление этих клинико-патогенетических симптомов имеет определяющее значение для ранней диагностики заболевания, выбора алгоритма лабораторно-инстру-ментального исследования и верификации ИМ на догоспитальном этапе.
При иммунологическом исследовании детей (острый период заболевания) обнаружены достоверные отклонения в основных показателях иммунного статуса: повышение количества СД8-лимфоцитов – у 47,3 %, снижение количества СД4-лифоцитов – у 27,3 %, повышение количества СД4-лифоцитов – у 15,4 %, изменения иммунорегуляторного индекса – у 80,9 %; нарушения гуморального звена иммунитета с повышением уровня IgA – у 38,2 % и IgМ – у 35,5 %; сочетанные нарушения в иммунной системе отмечены у 60,9 %. Наличие иммунологических изменений при ИМ определяет целесообразность включения в комплексную терапию заболевания противовирусных препаратов с иммунокорригирующим действием.
Сорок два ребенка в возрасте от 4 до 7 лет (мальчиков – 25, девочек – 17) в составе комплексной терапии получали рекомбинантный интерферон α-2β ректально (1-я основная группа) и 42 ребенка того же возраста (мальчиков – 24, девочек – 18) не получали противовирусного лечения (2-я – группа сравнения).
У больных доминировал ИМ, вызванный ВЭБ, – 71,4 %. Рекомбинантный интерферон α-2β назначался в острый период заболевания при госпитализации детей в стационар. Группы были сопоставимыми по возрасту, полу, клиническим проявлениям заболевания и характеру базовой терапии.
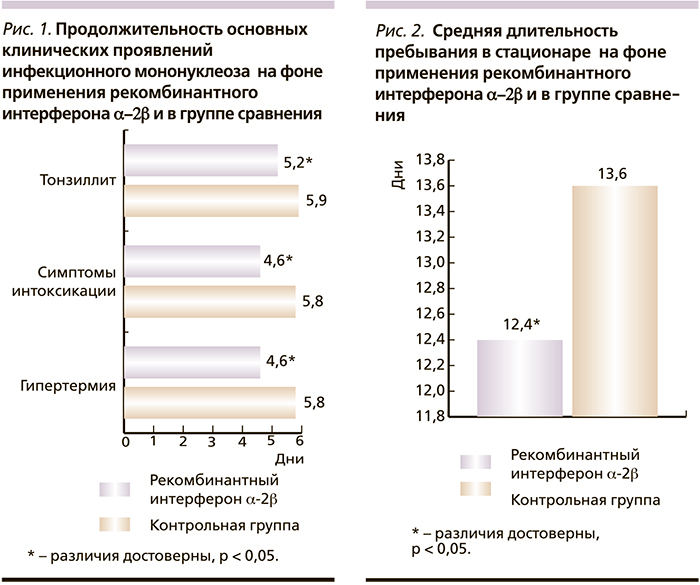
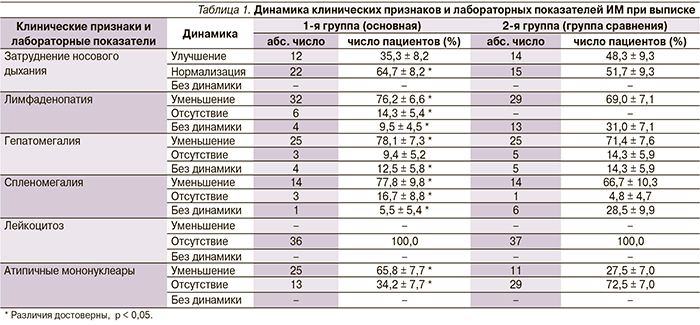
Продолжительность лихорадки и симптомов интоксикации на фоне лечения рекомбинантным интерфероном α-2β в среднем составила 4,6 ± 0,9 дня, проявления тонзиллита купировались на 5,2 ± 1,1 дня. Средняя длительность пребывания в стационаре составила 12,4 ± 0,8 дня. У детей 2-й группы лихорадка и симптомы интоксикации купировались к 5,8 ± 0,9 дня (p < 0,05), тонзиллит – к 5,9 ± 1,1 дня (p < 0,05), средняя длительность пребывания в стационаре составила 13,6 ± 0,9 дня (p < 0,05), (рис. 1, 2).
К моменту выписки из стационара у детей, получавших рекомбинантный интерферон α-2β, отмечено уменьшение размеров лимфатических узлов в 76,2 % случаев, нормализация носового дыхания в 64,7 %, уменьшение размеров печени в 78,1 %, уменьшение размеров селезенки в 77,8 %, а у детей, не получавших рекомбинантный интерферон α-2β, – соответственно 69,0; 51,7; 71,4; 66,7 % (p < 0,05). Трое детей выписаны с умеренным лейкоцитозом (7,5 %), а во 2-й группе у 24,3 % пациентов при выписке сохранялся лейкоцитоз. Атипичные мононуклеары не обнаружены у 36,8 % пациентов 1-й группы (у 17,5 % –2-й; p < 0,05, табл. 1).
При оценке отдаленных результатов лечения рекомбинантным интерфероном α-2β через месяц установлено, что в большинстве (92,9 %) случаев отмечено уменьшение лимфаденопатии и в 72,2 % размеры селезенки соответствовали норме, что подтверждалось результатами ультразвукового исследования органов брюшной полости. В группе сравнения уменьшение лимфоузлов наблюдалось у 80,9 % детей, отсутствие спленомегалии – у 52,4 % (p < 0,05, табл. 2).
Через месяц после лечения рекомбинантным интерфероном α-2β определены иммунные показатели. Нормализация иммунорегуляторного индекса наблюдалась у 62,5 % детей, в группе сравнения – у 37,5 % (p < 0,05). Применение Генферона Лайт способствовало снижению IgМ (до 1,8 мг/мл) и класса А (до 1,8 мг/мл); в 75,0 % случаев эти показатели пришли к нормальным значениям. Отмечена достоверная динамика в показателях СD4 (45,4 %) и СD8 (24,2 %) по сравнению с данными до лечения и тенденция к нормализации этих показателей. У 56,2 % пациентов группы сравнения положительная динамика этих показателей не обнаружена (p < 0,05).
Отмечена хорошая переносимость рекомбинантного интерферона α-2β. Осложнений, болезненности и других местных реакций при использовании свечей не было.
Выводы
Этиология ИМ (ВЭБ, ЦМВ, микст-этиология [ВЭБ, ЦМВ]), возраст пациентов и гендерные факторы влияют на клинические особенности заболевания, гематологические и биохимические показатели.
Лимфопролиферативно-тонзи-ллярный, лимфопролиферативно-паренхиматозный и лимфостатически эктодермальный клинико-патогенетические синдромы являются опорными клиническими признаками ИМ и предполагают обследование для уточнения этиологии заболевания.
Включение рекомбинантного интерферона α-2β в комплексную терапию ИМ приводит к быстрому уменьшению клинических проявлений, нормализации показателей гемограммы, сокращению средней длительности пребывания больного в стационаре и оказывает иммунокорригирующий эффект. Применение рекомбинантного интерферона α-2β безопасно и не вызывает побочных реакций. Рекомбинантный интерферон α-2β в форме ректальных суппозиториев может быть рекомендован для лечения детей, больных ИМ.


