Введение
Уротелиальный рак является одним из пяти наиболее часто встречаемых злокачественных образований в США и Российской Федерации [1–3]. В структуре заболеваемости мужского населения рак мочевого пузыря (РМП) составляет 4,6% в России и 7% в США [1, 2]. По данным R.L. Siegel et al., в 2016 г. в США было выявлено 7690 новых случаев РМП, смертность от которого составила 16 390 случаев [2]. В РФ в 2015 г. было выявлено 12 368 новых случаев РМП, смертность от которого составила 4995 случаев [2, 3].
Иммуноонкология – активно развивающееся направление в лекарственном лечении злокачественных новообразований, направленное на мобилизацию иммунной системы пациента для борьбы с опухолью и препятствующее уклонению опухоли от механизмов иммунной защиты. Иммунная система человека способна распознавать и ликвидировать опухолевые клетки на протяжении всей жизни, осуществляя т.н. иммунологический контроль [3].
Ключевым фактором распознавания опухоли клетками иммунной системы служит ее антигенная характеристика, наличие опухолевоспецифичных и опухолевоассоциированных антигенов, определяющих ее иммуногенность [3]. Частота мутаций в опухолях мочевого пузыря является самой высокой из всех опухолей человека, что может способствовать высокой антигенности данного вида рака и делает уротелиальные опухоли крайне привлекательными для использования методов иммунотерапии [3].
Блокирование или ингибирование ключевых точек иммунного ответа (чек-поинтов) – одно из самых многообещающих направлений научных исследований в лечении онкологических заболеваний, в т.ч. РМП [4–6]. Мишенью ингибиторов чек-поинтов являются регуляторные пути, влияющие на активность Т-лимфоцитов путем уменьшения ингибиторных сигналов и как результат – активации Т-клеток для усиления противоопухолевой защиты. Рецептор программированной клеточной смерти PD-1 и его лиганды PD-L1, PD-L2 являются важнейшими рецепторными лигандами, модулирующими функцию Т-клеток. Гиперэкспрессия PD-L1 на опухолевых клетках указывает на то, что сигнальный путь PD-1 – один из механизмов уклонения опухоли от иммунного ответа [7]. Иммуногистохимические исследования показали, что повышенная экспрессия PD-L1 ассоциирована с увеличением стадии и степени злокачественности РМП, указывая на потенциально высокую эффективность блокады PD-L1 для противоопухолевого взаимодействия [3, 8–10].
Цель исследования. Изучение экспрессии PD-L1 у больных РМП с наличием вирусных ДНК в опухолевой ткани
Описание серии случаев
Набор больных проводился с 2014 по 2016 г. на базе урологического отделения ГБУЗ «ГКБ им. В.П. Демихова» ДЗМ г. Москвы и онкологического отделения Коми Республиканского онкодиспансера г. Сыктывкара. Про-ведено обследование и лечение 100 больных (72 мужчины и 28 женщин) в возрасте от 38 до 90 лет (средний возраст – 65±10 лет), поступивших в стационар с направительным диагнозом рак мочевого пузыря. Дополнительно к общепринятым методам обследования при РМП были взяты анализы крови на IgG, M к вирусу простого герпеса (ВПГ) 1-го и 2-го типов, цитомегаловирусу (ЦМВ), вирусу Эпштейна–Барр (ВЭБ). Произведен забор мочи и ткани опухоли на наличие вирусов ВПГ 1-го и 2-го типов, вируса папилломы человека (ВПЧ) высокого онкогенного риска, ЦМВ и ВЭБ. Была произведена оценка воспалительной инфильтрации в опухолевой ткани и подлежащей строме. Полуколичественно от 0 до 3 баллов (отсутствие, слабая, умеренная и выраженная степени) оценивались следующие признаки:
- Лимфоцитарно-плазмоцитарный инфильтрат: а) в опухоли, б) рассеянный в подлежащей строме, в) периваскулярная инфильтрация, г) очаговая гиперплазия лимфоидной ткани в виде лимфоидных фолликулов.
- Активность воспаления: а) степень лейкоцитарного инфильтрата, б) степень эозинофильной инфильтрации.
- Цитопатические изменения: а) внутриклеточные включения (койлоцитоз), б) внутриядерные включения.
Наличие вирусных ДНК в ткани опухоли было выявлено у 34 больных, из них 50% опухолей являлись низкодифференцированными. Наличие ДНК ВЭБ в опухоли выявлено у 27 больных, ЦМВ – у 6, ВПЧ высокого онкогенного риска (16, 39, 45, 52, 59) – у 5, ВПГ 1-го, 2-го типов – в одном случае.
Из 34 больных у 4 выявлена ДНК нескольких вирусов (ВПЧ 59 типа+ВЭБ в одном случае, ВЭБ+ЦМВ у двух пациентов, ЦМВ+ВЭБ+ВПЧ 31-го, 52-го типов у одного больного).
Проведено пилотное исследование, в котором 10 больным (2 женщинам и 8 мужчинам), страдавшим РМП, в возрасте от 50 лет до 81 года (средний возраст – 67,1 года) с наличием вирусных ДНК в опухолевой ткани было выполнено определение экспрессии PD-L1 по стандартной методике в иммунных и опухолевых клетках. Использовались клон антител SP 142 (Spring Bioscience, США), иммуностейнер BOND III (Leica, Германия) с системой детекции Refine, демаскировка антигенов в буфере ER2 производилась в течение 20 минут.
Операционный материал был фиксирован в 10%-ном нейтральном забуференном формалине, залит в парафин. Для иммуногистохимического исследования использовались серийные парафиновые срезы толщиной 5 мкм.
Исследование проведено в иммуностейнере BOND III. Температурную демаскировку/HIER провели c использованием буфера ER2 с рН 9,0 в течение 20 минут. Инкубация с первичными антителами клона SP142 использовалась в разведении 1:100 в течение 15 минут. Для визуализации применяли систему детекции Bond Refine с использованием DAB-хромогена в течение 10 минут и BOND DAB Enhancer – 10 минут (BOND DAB Enhancer). Срезы докрашивали гематоксилином в течение 3 минут и Bluing Reagent – 5 минут.
Из 10 пациентов в 1 случае имел место немышечноинвазивный рак, в остальных случаях было выявлено наличие мышечной инвазии (T2-T4).
У 3 пациентов определено метастатическое поражение регионарных лимфатических узлов. Первичный характер опухолевого поражения выявлен у 9 из 10 пациентов. В 50% случаев определены множественные опухоли мочевого пузыря. Уротелиальный рак был выявлен у 8 из 10 пациентов, в одном случае – плоскоклеточный и в одном – нейроэндокринный РМП. Высокодифференцированная опухоль мочевого пузыря имела место у 2 из 10 пациентов, низкодифференцированная у 8 из 10 больных. У всех пациентов было выявлено наличие вирусных ДНК в опухолевой ткани. В 50% случаев имело место моноинфицирование ВЭБ, у 2 (20%) пациентов инфицирование ВЭБ сочеталось с ЦМВ, в одном случае – с ВПЧ (66-й и 39-й типы) в соскобе из уретры, еще у одного пациента имела место микст-инфекция в виде ВЭБ+ЦМВ+ВПЧ (31-й и 52-й типы).
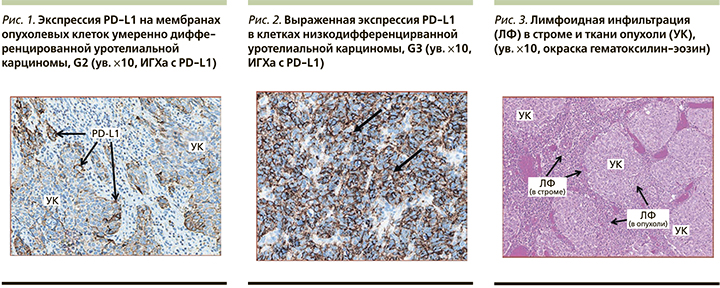
Экспрессия PD-L1 в опухолевых клетках у пациентов с наличием вирусных ДНК в опухолевой ткани >60% была выявлена у 3 из 8 больных (в 2 случаях имел место аутолиз; рис. 1, 2).
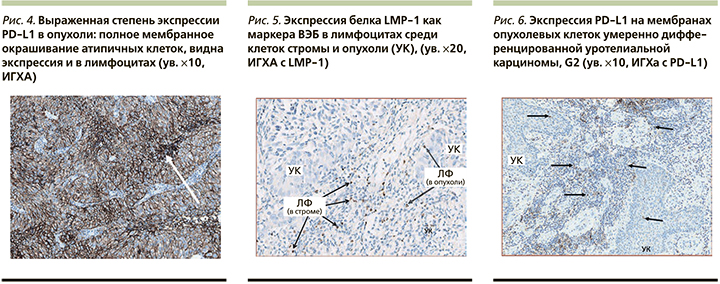
У пациента 50 лет с немышечноинвазивной уротелиальной карциномой (УК) мочевого пузыря pT1N0M0 G2, наличием ДНК трех вирусов (ВЭБ+ЦМВ+ВПЧ, 31-й и 52-й типы) в опухолевой ткани, высокими уровнями противовирусных антител, в частности анти-ЦМВ IgG – 1148 ЕД/мл, выявлена 99%-ная экспрессия PD-L1 в опухолевых клетках (рис. 3–5). При иммуногистохимическом исследовании выявлено наличие ВЭБ в строме и опухолевой ткани мочевого пузыря. Рецидив заболевания наступил в течение 3 месяцев после проведенной трансуретральной резекции стенки мочевого пузыря с опухолью и внутрипузырной химиотерапии (доксирубицин 50 мг). Экспрессия PD-L1 в иммунных клетках (IC) >1% мела место у 9 из 10 пациентов, >5% у 4 из 10 (рис. 6).
Если рассматривать экспрессию маркера в зависимости от морфологических характеристик опухолевого процесса, то выраженность окраски в опухолевых клетках коррелировала с наличием лимфоцитов, рассеянных в строме, граничащей с опухолью (R=0,307), наличием лимфоцитов в самой опухоли (R=0,489), периваскулярной инфильтрацией (R=0,51), наличием койлоцитоза как проявления ВПЧ-инфекции (R=0,335) и наличием ВПЧ в опухолевой ткани (R=0,608; p=0,062). По нашим данным, более выраженная степень лимфоидной инфильтрации как в подлежащей строме, так и непосредственно в опухоли имела место именно у пациентов с наличием вирусных (ЦМВ, ВЭБ, ВПГ 1-го и 2-го типов, ВПЧ высокого онкогенного риска) ДНК в опухоли, равно как и наличием выраженного койлоцитоза [11]. Кроме того, наличие ДНК ВЭБ в опухоли в нашем исследовании коррелировало с выраженностью рассеянной лимфоидной инфильтрации как в подлежащей строме (R=0,326, p=0,006), так и в опухоли (R=0,348, p=0,003), и периваскулярной инфильтрации (R=0,288, p=0,019) [11]. Так, K.L. Chuang et al. указывают на высокие коррелятивные связи между низкой дифференцировкой опухолевого процесса у пациентов с мышечно-неинвазивным РМП и большим количством вирусных ДНК ВЭБ в опухолевой ткани. При этом, по мнению авторов, количество рецидивов не зависит от количественных параметров ДНК ВЭБ у данной категории больных [12]. Другие авторы указывают на влияние ВЭБ-инфекции на прогрессирование УК [13].
Кроме того, определяется тенденция увеличения степени выраженности лимфоидно-плазмоцитарного инфильтрата в зависимости от наличия вирусных ДНК в опухолевой ткани и степени дифференцировки опухоли. У пациентов с наличием вирусных ДНК в опухолевой ткани количество лимфоцитов, рассеянных в строме, граничащей с опухолью, было статистически достоверно выше, чем у пациентов с их отсутствием (2,1 против 1,72 балла; p=0,05). Аналогичная тенденция наблюдается в отношении наличия лимфоцитов в опухолевой ткани (1,79 против 1,4 балла; p=0,06). Если рассматривать степень дифференцировки опухоли, то количество лимфоцитов, как рассеянных в строме, так и в опухолевой ткани, было достоверно выше у пациентов с низкодифференцированным процессом (1,44 против 2,06 балла, p=0,005; 1,0 против 1,71 балла, p=0,004) [11].
Сходные данные получили Z. Li et al., которые выявили коррелятивные связи между экспрессией PD-L1, лимфоидной инфильтрацией, наличием ВЭБ-инфекции, плохим прогнозом течения рака желудка. Авторы предлагают использовать степень лимфоидной инфильтрации в качестве независимого фактора прогноза положительного ответа на использование анти-PD-L1-терапии [14]. Высокая внутриопухолевая экспрессия PD-L1 у пациентов с ВЭБ-ассоциированным раком желудка ассоциирована с неблагоприятным течением опухолевого процесса и снижением раково-специфичной выживаемости, тогда как экспрессия PD-L2, наоборот, свидетельствует о хорошем прогнозе [15].
Обсуждение
В настоящее время появляется все больше публикаций, в т.ч. и обзоров, посвященных влиянию вирусных инфекций на этиологию онкологических заболеваний различных локализаций и поиску методов лечения этой категории больных с использованием иммунотерапии [16-22]. M.L. Guelly et al. подчеркивают, что «ВЭБ является не просто сторонним наблюдателем развития аденокарциномы желудка, но и тесно связан с патогенезом развития и поддержания опухолевого процесса» [23]. Q. Liang et al. выявили около 5 сигнальных путей, на которые влияют только ВЭБ-ассоциированные геномные и эпигеномные альтерации со снижением периода выживания у пациентов с ВЭБ-положительным раком желудка [24]. Рассматривается и роль воспалительных реакций в генезе онкологического процесса, протекающего на фоне вирусной или бактериальной инфекции [25].
В последние годы изучалась экспрессия PD-L1 в опухолевых клетках неоплазм различных локализаций. Получены весьма противоречивые данные. Одни авторы считают, что высокие показатели экспрессии этого маркера свидетельствуют о неблагопритном прогнозе течения опухолевого процесса [26–28]. Другие, наоборот, отмечают большую общую раковоспецифичную и безрецидивную выживаемость этих пациентов [29–31]. Так, J. Breyer et al. провели исследование по изучению экспрессии мРНК PD-L1 у пациентов с мышечно-неинвазивным РМП. Авторы делают вывод, согласно которому пациенты с высокой экспрессией мРНК PD-L1 имеют более благоприятный прогноз в отношении общей раковоспецифичной и безрецидивной выживаемости. Исследователи предлагают использовать этот критерий для отбора пациентов как для проведения иммунотерапии, так и для выполнения ранней цистэктомии [29]. S. Wankowicz et al. указывают на то, что экспрессия PD-L1 в опухолевых клетках пациентов с низкодифференцированной немышечноинвазивной карциномой была ниже, чем у больных мышечноинвазивными опухолями мочевого пузыря [30]. По другим данным, высокая экспрессия PD-L1 при мышечноинвазивном РМП ассоциирована с увеличением общей продолжительности жизни пациентов с наличием метастазов [32]. Также, по мнению R. Pichler et al., гиперэкспрессия PD-L1 коррелировала с отсутствием эффекта 1-й линии химиотерапии у пациентов с метастатическим РМП [33].
Если рассматривать экспресиию PD-L1 при опухолях других локализаций, в частности при светло-клеточном раке почки, то высокая экспрессия данного маркера ассоциирована с неблагоприятным прогнозом течения опухолевого процесса [34, 35].
Тем не менее высокая экспрессия PD-L1 делает целесообразным проведение иммунотерапии с использованием check-point-ингибиторов при метастатических опухолях различной локализации.
В настоящее время нет публикаций, касающихся определения маркера PD-L1 у пациентов с УК мочевого пузыря, протекающей на фоне вирусной инфекции. В то же время высокая внутриопухолевая экспрессия PD-L1 при ВЭБ-положительном раке желудка и ВЭБ-положительной назофарингеальной карциноме, а также лимфопролиферативных заболеваниях указывает на неблагопрятный проогноз течения заболевания [15, 26–28, 36]. B.J. Chen в своем обзоре, посвященном экспрессии PD-L1 у пациентов с лимфопролиферативными заболеваниями и вирус-ассоциированными опухолевыми процессами, указывает на повышенную экспрессию PD-L1 в опухолевых клетках у этой категории больных [27].
По нашему мнению, экспрессия PD-L1 у пациентов с УК связана с наличием латентной вирусной инфекции, в частности ВЭБ как в качестве моноинфекции, так и в сочетании с другими герпес-вирусами (ЦМВ) и ВПЧ высокого онкогенного риска. Степень выраженности экспресии этого маркера ассоциирована со степенью выраженности лимфоцитарно-плазмоцитарного инфильтрата как проявления ВЭБ и ЦМВ-инфекции,и цитопатическими изменениями как проявлениями ВПЧ-инфекции. По всей видимости, именно этой категории больных показано проведение терапии с использованием препаратов анти-PD-L1, однако требуется продолжение исследования в указанном направлении.
Заключение
Таким образом, у больных РМП, в т.ч. немышечноинвазивным, и признаками латентной вирусной инфекции, особенно сочетанной (ВЭБ+ЦМВ+ВПЧ), целесообразно определение экспрессии PD-L1 как маркера неблагоприятного течения опухолевого процесса. Данной категории больных возможно проведение лечения с использованием препаратов анти-PD-L1 с целью увеличения безрецидивного периода и раковоспецифичной выживаемости. Однако требуется продолжение исследования.
Согласие
Больные подписали стандартное согласие на оперативное лечение и обработку персональных данных.
Благодарности
Выражаем признательность врачу-патологоанатому, специалисту по ИГХ и ISH-диагностике патологоанатомического отделения Московской онкологической больницы № 62.


