В группе оппортунистических принято относить инфекции, которые манифестно проявляются у лиц с иммунодефицитным состоянием любой природы. В последние годы отмечено возрастание частоты оппортунистических инфекций (ОИ) у больных иммуно-воспалительными заболеваниями, такими как ревматоидный артрит, болезнь Бехтерева, псориаз, рассеянный склероз, получающих иммуно-супрессивную терапию. Аналогичная ситуация сложилась при воспалительных заболеваниях кишечника (ВЗК): язвенном колите (ЯК) и болезни Крона (БК). За последние 10 лет в англоязычной литературе описаны многочисленные ОИ, сопровождающие ЯК и БК, систематизированные W. Reinisch (см. таблицу) [1–3].
Таблица.ОИ при ВЗК (по W. Reinisch).
В популяционных исследованиях ЯК стандартизованный показатель смертности (на 100 тыс. населения в год) вследствие ОИ составил 3,3 (0,6–9,5) среди женщин и 1,6 (0,33–4,7) среди мужчин. При БК этот показатель у женщин был значительно выше и составил 8,3 (1,0–30,9), а у мужчин мало отличался от такового при ЯК –2,1 (0,0–11,8) [4, 5].
При ВЗК иммунодефицитное состояние определяется как самим заболеванием, так и приводимой иммуносупрессивной терапией. Число больных ВЗК, получающих базисную терапию глюкокортикостероидами (ГКС), остается стабильным на протяжении почти 20 лет (1990–2008) и колеблется в интервале 17–20 %. Различные иммуносупрессоры к настоящему времени получают почти 70 % больных. Препарата – ингибиторы фактора некроза опухоли (ФНО) α используют около 20 % пациентов [6, 7].
Учитывая значимость проблемы инфекций при ВЗК, Европейская организация по изучению язвенного колита и болезни Крона (ECCO) включила в 2010 г. в Европейский консенсус по диагностике и лечению ВЗК специальный раздел, касающийся непосредственно ОИ [8].
Согласно положению 2С этого раздела: “к иммуномодуляторам, широко применяемым при ВЗК и связанным с повышенным риском развития инфекций, относятся ГКС, тиопурины (азатиоприн,6-меркаптопурин), метотрексат, ингибиторы кальциневрина (циклоспорин А), ингибиторы ФНО и другие биопрепараты. Риск развития ОИ повышается при применении суточной дозы ГКС, эквивалентной 20 мг преднизолона при длительности лечения 2 недели”. Таким образом, даже низкая доза и короткий курс применения ГКС требуют настороженности в отношении развития ОИ. Другие иммуномодуляторы также связаны с повышенным риском развития инфекции. Так, при применении циклоспорина А частота ОИ при ЯК составляет 18,6 %, а смертность от ОИ у этих больных достигает 3,5 % [9]. Применение инфликсимаба сопровождается более низкой частотой ОИ как при ЯК (2,5–6,6 %), так и при БК (3–6 %), которая не отличается от таковой в группах плацебо [10, 11]. Согласно положению 2В указанного выше раздела консенсуса ЕССО: “Наибольшему риску развития ОИ подвержены больные, получающие комбинацию иммуномодулирующих средств” [8].
Среди ОИ наибольший клинический интерес представляет цитомегаловирусная (ЦМВ) инфекция, имеющая широкое распространение в популяции и характеризующаяся вариабельностью клинической картины [12, 13].
ЦМВ хорошо известен как причина заболеваний желудочно-кишечного тракта пациентов с синдромом приобретенного иммунодефицита и больных, готовящихся к трансплантации [14, 15]. Инфицированность ЦМВ у взрослого населения достигает 40–100 %, при этом инфекция в большинстве случаев пожизненно носит латентный характер [12, 13]. Активизация ЦМВ у пациентов с ВЗК может достигать 21–34 %, она утяжеляет течение основного заболевания [13, 16] и увеличи-
вает риск смертности, особенно если остается недиагностированной [17, 18]. ЦМВ выявляется у трети пациентов, рефрактерных к ГКС [19].
Патогенетическая роль ЦМВ при ВЗК до настоящего времени не вполне ясна. С одной стороны, имея тропность к эпителию кишечника, вирус может вызывать ЦМВ-колит. С другой – он может стать триггером запуска воспалительного процесса при ВЗК [13, 16]. При первой атаке ЯК и при наличии ДНК ЦМВ у клиницистов возникает вопрос о причинно-следственной связи и дифференциальном диагнозе.
Могут рассматриваться три варианта:
а) случай острого первичного ЦМВ-колита без ВЗК;
б) активация латентной инфекции на фоне ВЗК;
в) первичное заражение ЦМВ на фоне ВЗК. Вирус имеет тропизм к воспаленным участкам кишки, вызывая прогрессирующее повреждение тканей. В то же время воспалительный процесс в кишке и обусловленное им повышение уровней ФНО-α и интерферона-γ в крови ведут к активации латентной ЦМФ-инфекции [19].
Диагноз ЦМВ подтверждается при обнаружении ДНК вируса методом полимеразной цепной реакции (ПЦР) в крови и ткани и/или в биоптате при окраске гематоксилином и эозином при наличии характерных гигантских клеток (цитомегалов) с включениями в ядре, получивших название “совиный глаз”. Разработаны методы иммуногистохимической диагностики. Выявление специфических антител классов IgM и IgG серологическими методами не имеет решающего значения в постановке диагноза и свидетельствует лишь о факте инфицированности, а не о наличии заболевания. Метод ПЦР позволяет провести как качественную, так количественную оценку. По величине вирусной нагрузки ЦМВ определяются показания к противовирусной терапии, оцениваются ее эффективность и сроки лечения [21]. При невозможности определения вирусной нагрузки эффективность лечения может быть оцененной на основании стойкой элиминации ДНК вируса из крови.
На сегодняшний день единственным эффективным препаратом лечения ЦМВ является ганцикловир 5 мг/кг внутривенно каждые 12 часов – 2–3 недели. Противовирусный эффект препарата обусловлен образованием в пораженных вирусом клетках ганцикловиртрифосфата, тормозящего синтез вирусной ДНК в результате двух механизмов: конкурентного ингибирования ДНК-полимеразы и прямого включения в вирусную ДНК, что прекращает ее элонгацию.
Клинический случай
Женщина 48 лет, жительница Московский области, поступила в отделение гастроэнтерологии МОНИКИ с жалобами на жидкий стул до 15 раз в сутки с примесью крови и слизи, енезмы до 5 раз в сутки, выраженную общую слабость, утомляемость, повышение температуры тела до 38 °С, прогрессирующее похудание (снижение массы тела на 4 кг за 2 месяца). Около 10 месяцев назад впервые отметила послабление стула.
Последние 2,5 месяца – многократный жидкий стул до 15 раз в сутки с примесью крови и слизи, повышение температуры тела до 38 °С, похудание, нарастающая общая слабость. Из анамнеза известно, что пациентка длительно злоупотребляла алкоголем, в течение года закодирована от алкоголизма, страдает артериальной гипертензии II степени, эндометриозом.
Больная обследовалась в инфекционном отделении горбольницы по месту жительства. Данных за острую кишечную и токсикоинфекцию выявлено не было. При обследовании в терапевтическом отделении был заподозрен диагноз ЯК. При ректороманоскопии: слизистая оболочка прямой кишки гиперемирована; язв, эрозий, полипов не выявлено; контактная кровоточивость. При ирригоскопии в восходящей, поперечной, нисходящей ободочной и сигмовидной кишках гаустры отсутствуют – синдром “водопроводной трубы”, слизистая оболочка утолщена. Были назначены сульфасалазин 4 г/сут, преднизолон по 25 мг/сут, антибактериальная инфузионная терапия. Отмечено некоторое снижение температуры – до 37,2–37,5 °С, однако сохранялся многократный жидкий стул с примесью слизи и крови. Поскольку принципиального улучшения состояния не отмечалось, больная была переведена в отделение гастроэнтерологии МОНИКИ.
При поступлении состояние средней тяжести. Рост – 162 см. Вес – 63,5 кг. Кожные покровы бледноозовые, чистые. В легких дыхание везикулярное, хрипов нет. Язык розовый, чистый, суховат. Живот округлой формы, умеренно вздут, при пальпации умеренно болезненный в подвздошных областях. Пастозность голеней, стоп.
На основании анамнеза, данных клинической картины (лихорадка, многократный жидкий стул с примесь крови и слизи, похудание) первично был установлен диагноз ЯК, острая форма, тотальное поражение, тяжелое течение.
По результатам лабораторного обследования выявлены: железодецицитная анемия (гемоглобин 107 г/л, эритроциты 3,07 × 1012/л, цветовой показатель 0,79, снижение уровня сывороточного железа до 5,6 ммоль/л), гипопротеинемия (общий белок 51 г/л), гипоальбуминемия (альбумин 25 г/л), гипокалиемия (калий 3,6 ммоль/л) гипокальциемия (кальций 2,08 ммоль/л), шестикратное повышение уровня С-реактивного белка (48 мг/л). При иммунологическом исследовании крови отмечено снижение IgG (475,8 при норме 750–1800). Анализ кала на Сlostridium difficile токсин А и Б отрицателен. Анализ крови на ВИЧ отрицателен.
Ректороманоскопия: Слизистая оболочка прямой кишки от ануса до 7 см утолщена, зернистая, с единичными эрозиями, от 7 до 15 см слизистая оболочка резко отечна, инфильтрирована, с множеством эрозий, сосудистый рисунок отсутствует, спонтанная кровоточивость. На 15 см – впечатление о сужении просвета кишки, возможно обусловленном воспалением, дальнейшее продвижение невозможно. Проведена биопсия. Заключение: эндоскопическая картина ЯК высокой степени активности.
Морфологическое исследование биоптатов слизистой оболочки прямой кишки: выявлены изменения, подтверждающие клинический диагноз ЯК – фрагменты слизистой оболочки с выраженной лимфоплазмоцитарной инфильтрацией с примесью эозинофилов и сегментоядерных лейкоцитов, имеются участки эрозий и язв, выраженные дисрегенераторные изменения эпителия крипт, множественные крипт-абсцессы.
УЗИ органов брюшной полости и забрюшинного пространства: диффузные изменения печени, поджелудочной железы, умеренное увеличение селезенки. В полости малого таза незначительное количество свободной жидкости.
Обзорная рентгенография брюшной полости: данных за токсическую дилатацию толстой кишки не получено.
С первого дня в отделении проводилась терапия стероидами (метилпреднизолон 500 мг внутривенно, капельно), инфузионная терапия (Абактал, Метрагил, свежезамороженная плазма, белковые препараты, проводилась коррекция электролитных нарушений). Через 7 дней добавлен циклоспорин
4 мг/кг в связи с отсутствием клинического эффекта к терапии. Обсуждался вопрос об оперативном лечении, но больная категорически отказалась. Кроме того, она отказалась от проведения колоноскопии.
Через 7 дней на фоне приема циклоспорина и продолжающейся терапии метилпреднизолоном 500 мг внутривенно, капельно наметилось улучшение: стул сократился до 2–4 раз в сутки, консистенция его изменилась с жидкой на кашицеобразную или полуоформленную, примесь крови и слизи в кале исчезла, температура тела стабильно снизилась до 36,6–37,1 °С. При ректороманоскопии положительная эндоскопическая динамика: уменьшение количества эрозий, уменьшение отека слизистой оболочки, отсутствие контактной и спонтанной кровоточивости.
Однако у больной нарастала общая слабость и слабость в ногах, пациентка с трудом могла встать со стула, ходить по отделению, отмечала снижение аппетита, масса тела дополнительно снизилась на 2,5 кг. Кроме того, появилась гипергликемия (глюкоза крови 9,6 ммоль/л), сохранялся стабильно низкий уровень общего белка и альбумина, несмотря на ежедневные инфузии белковых препаратов. Прогрессировала анемия (гемоглобин 75–70 г/л, эритроциты 2,1–2,2 × 1012/л), появилась лейкопения (1,9–2,4 × 109/л), тромбоцитопения (109 × 109/л). Изменения трактовались как токсический эффект цитостатической терапии, и циклоспорин был отменен.
Затем у больной появились пузырьковые высыпания на губах и слизистой оболочке полости рта, что было расценено как проявление герпетической инфекции и подтверждено инфекционистом, хотя дополнительно исследования на наличие вируса герпеса не проводились. К лечению добавлен ацикловир 800 мг × 3 раза в день, Панавир местно.
В связи с возникшими жалобами на сухой кашель без мокроты, ослаблением дыхания в нижних отделах легких справа проведена рентгенография органов грудной клетки: не исключено наличие правосторонней пневмонии.
Больная консультирована эндокринологом – стероидный сахарный диабет, гинекологом – патологии не выявлено, неврологом по поводу слабости в ногах – полинейропатия неясного (токсического?) генеза.
После отмены циклоспорина у пациентки вновь участился стул до 8 раз в сутки, появилась примесь крови и слизи в кале. Совместно с хирургом было принято решение об оперативном лечении. В отделение абдоминальной хирургии больная переведена с клиническим диагнозом ЯК, острая гормонорезистентная форма, тотальное поражение, тяжелое течение. Панцитопения. Гипопротеинемия. Гипокалиемия. Хроническая герпетическая инфекция в стадии обострения. Правосторонняя герпетическая (?) пневмония. Полинейропатия смешанного генеза. Стероидный сахарный диабет.
В плановом порядке проведена резекция прямой кишки, колэктомия, илеостомия. Больная продолжала получать ацикловир, внутривенно ГКС, инфузионную терапию, включающую свежезамороженную плазму, эритроцитарную массу. Все это время у пациентки продолжался кашель. По данным рентгенографии органов грудной клетки пневмония не разрешалась несмотря на проводимую антибактериальную и противовирусную терапию. На 26-е сутки после операции проведено ушивание передней брюшной стенки по поводу эвентрации. На 33-е сутки после операции на фоне прогрессирующей сердечно-легочной недостаточности наступила смерть больной. В связи с предполагаемым герпетическим генезом пневмонии был взят аутопсийный материал на определение инфекций герпетической группы, в т. ч. вируса простого герпеса, однако ДНК вируса простого герпеса обнаружено не было. В аутопсийном материале обнаружена ДНК ЦМВ в ткани прямой кишки, легкого, головного мозга. После получения таких результатов были прицельно обследованы все гистологические препараты биоптатов слизистой оболочки прямой кишки и операционный материал. В ткани прямой кишки, резицированной толстой кишки, в ткани головного мозга, щитовидной железы, легкого обнаружены клетки “совиного глаза” (рис. 1–3).
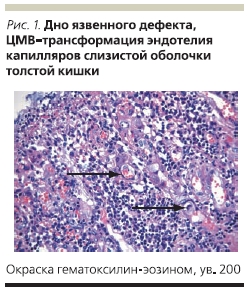
Патологоанатомический диагноз: ЯК, тотальное поражение, осложненный генерализованной ЦМВ-инфекцией с поражением толстой кишки, щитовидной железы, легких, головного мозга. Резекция прямой кишки, колэктомия, илеостомия. Операция ушивания передней брюшной стенки по поводу эвентрации. Двусторонняя пневмония: очагово-сливная слева и тотальная справа. Жировая дистрофия печени. Спленомегалия. Ограниченный перитонит. Септицемия. Отек головного мозга.
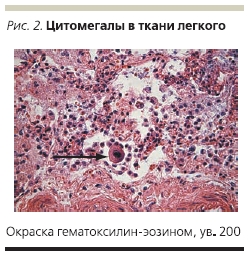
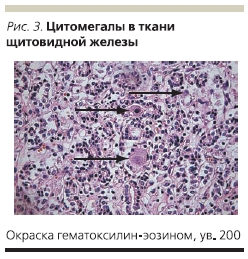
Заключение
Представлен случай острой формы тяжелого ЯК, осложненного недиагностированной генерализованной ЦМВ инфекцией, активированной на фоне комбинированной иммуносупрессивной терапии кортикостероидами и циклоспорином.
При обсуждении этого случая на патологоанатомической конференции возник ряд вопросов:
• Был ли это острый ЯК или острая генерализованная ЦМВ-инфекция с поражением желудочно-кишечного тракта, поскольку клинические симптомы схожи?
Ответ: диагноз ЯК был поставлен правильно, т. к. у больной были характерные эндоскопические, рентгенологические (симптом “водопроводной трубы”) и морфологические признаки ЯК. Инфекция присоединилась позже.
• Можно ли было заподозрить ЦМВ-инфекцию в самом начале?
Ответ: Чрезвычайно трудно, если нет соответствующей настороженности, тем более что у пациентки была явная герпетическая инфекция. Было два симптома, нами не учтенных: лейкопения и полинейропатия, которые появились на фоне лечения циклоспорином и были ошибочно расценены как токсическое действие препарата, хотя для него не типичны. Эти симптомы как раз характерны для ЦМВ.
• Если бы латентная ЦМВ-инфекции была диагностирована до начала лечения, нужно ли было лечить больную циклоспорином А и высокими дозами стероидов?
На этот вопрос дает ответ соответствующий раздел Европейского консенсуса – положение 4А по ЦМВ: в скрининге латентной или субклинической инфекции ЦМВ перед началом иммуномодулирующей терапии нет необходимости (УД2, СОВ).
Латентная или субклиническая инфекция не является противопоказанием к проведению иммуномодулирующей терапии (УД2, СРВ).
У больных с острой формой ЯК и нетипичной эндоскопической картиной или у пациентов с диагностированным ЯК, резистентным к базовой терапии, нужно быть настороженным в отношении ОИ.
• В случае своевременного выявления генерализованной ЦМВ-инфекции что нужно было бы предпринять? Ответ: быстро провести противовирусную терапию ганцикловиром, затем решать вопрос об операции или продолжении консервативного лечения ЯК.
Цель представленного случая – привлечь внимание врачей к возможным, все чаще встречающимся инфекционным осложнениям у больных ВЗК.


