Анализ отечественной и международной литературы показал, что ни мануальная, ни физиотерапия, ни тракция позвоночника, а также другие консервативные методы лечения дистрофических заболеваний (остеохондроз) позвоночника, рекомендованные Всемирной организацией здравоохранения, не решили проблемы [14].
Недостаточная эффективность существующих консервативных способов лечения пациентов с неврологическими проявлениями остеохондроза позвоночника указывают на следующее: среди существующих способов консервативного лечения нет такого, который ликвидировал бы основной патогенетический элемент данного заболевания – катаболический метаболизм в межпозвонковом диске (МПД), развивающийся вследствие энергетической недостаточности в хондроцитах [1, 3–10, 13–17, 20, 27]. В связи с этим разработка новых способов патогенетического лечения остеохондроза позвоночника перспективна и актуальна.
В настоящее время установлено, что основной причиной развития энергетической недостаточности в хондроцитах МПД является недостаточное нутриентное обеспечение (нехватка глюкозы, аминокислот, кислорода и воды) [18, 23, 24, 28] вследствие перемещения склеротического процесса из собственных сосудов МПД на сосуды, снабжающие тела позвонков [4–6, 9, 10, 18, 23, 24, 28]. H.A. Horner и J.P.G. Urban [23], исследуя выживание клеток диска в различных условиях, доказали, что если адекватное количество кислорода и глюкозы не поступает в ткани МПД, переключение метаболизма на анаэробный гликолиз приводит к развитию энергетической недостаточности (при анаэробном гликолизе образуется всего 200 кДж/моль энергии и 2 молекулы АТФ по сравнению с аэробным – 2800 кДж/моль энергии и 38 молекул АТФ) [1, 12–14, 27]. Энергии, образовавшейся в результате анаэробного гликолиза, недостаточно для продолжения жизнедеятельности клеток МПД. Для того чтобы поддерживать свою жизнедеятельность, клетки МПД используют энергию, образовавшуюся в результате поэтапного расщепления более крупных молекул матрикса протеогликанов (белково-мукополисахаридный комплекс) на протеин (аггрекан) и глюкозоаминогликаны (мукополисахариды). На фоне продолжающейся энергетической недостаточности происходит катаболический метаболизм: белки расщепляются до дезаминированных аминокислот, глюкозоаминогликаны – до моносахаридов. Энергия, образованная в результате катаболического метаболизма, лишь частично покрывает энергетическую потребность клеток, поэтому разрушение матрикса медленно и незаметно прогрессирует [18, 23, 24, 28].
Вышеизложенное показывает, что причиной развития катаболического метаболизма является энергетическая недостаточность. Чем меньше кровоснабжение и концентрация кислорода, тем выше активность протекания процесса. Увеличение энергообразовательных процессов в клетках МПД путем переключения анаэробного гликолиза на аэробный путь служит ключевым фактором патогенетической терапии остеохондроза. Препарат Актовегин, обладающий антигипоксантными свойствами и способный переключать метаболизм клетки с анаэробного на аэробный гликолиз, может рассматриваться в качестве средства патогенетического лечения остеохондроза [26].
Целью настоящего исследования явилась оценка эффективности применения Актовегина больными с остеохондрозом поясничного отдела позвоночника.
Материал и методы
Для исследования были отобраны 60 больных (32 мужчины и 28 женщин, средний возраст – 45,1 ± 5,3 года), находившихся на стационарном лечении в нейрохирургическом отделении Самаркандского городского медицинского объединения с 2006 по 2010 г. Критерии включения в исследование: 1) возраст от 30 до 60 лет; 2) КТ- и МРТ-признаки остеохондроза: протрузия диска, артроз дугоотростчатых суставов с обеих сторон, внутридисковое перемещение пульпозного ядра, уменьшение высоты МПД и субхондральный склероз; 3) установленный диагноз – острая люмбоишиалгия (корешковый болевой синдром) вследствие дистрофически-дегенеративных заболеваний поясничных позвонков (подверженный объективными методами исследования). Вертеброневрологическая диагностика проведена по критериям H. Hall [22]. Больные, включенные в исследование, методом простой рандомизации и «вслепую» были разделены на 2 группы по 30 человек в каждой. Пациенты первой (основной) группы вместе с традиционной консервативной терапией (нестероидные противовоспалительные средства, ортопедическое лечение, периферические миорелаксанты и хондропротекторы) получали Актовегин 250 мл 20 %-ного раствора в виде внутривенных инфузий ежедневно в течение 10 дней; пациенты второй (контрольной) группы получали только традиционное консервативное лечение.
Для определения эффективности способа лечения были использованы следующие шкалы:
- шкала общей оценки результатов лечения врачом, предусматривающая 5 градаций (1 балл – ухудшение, 0 баллов – отсутствие эффекта, 1 балл – незначительно выраженный эффект, 2 балла – умеренный эффект, 3 балла – значительный эффект) [6, 7];
- специально разработанная шкала самооценки состояния при боли в спине, использующая принцип визуальной аналоговой шкалы и предусматривающая оценку спонтанной боли и боли при движении в спине и ногах; ограничение подвижности при наклоне вперед и разгибании; ограничение способности передвижения, способности сидеть и стоять; ограничение повседневной активности [7]. Больной должен оценить выраженность каждого из этих симптомов, отметив ее точкой на отрезке в 100 мм, при этом 0 на этом отрезке соответствует отсутствию симптома, а отметка на противоположном конце отрезка – максимально возможной выраженности симптома. Общая оценка по этой шкале определялась суммированием длины 10 отрезков и могла колебаться от 0 до 1000;
- шкала количественной оценки вертебрального синдрома. Применялся модифицированный вариант шкалы G. Waddeletal [30]. Шкала предусматривает оценку 10 показателей по четырехбалльной системе (от 0 до 3): угол сгибания поясничного отдела, разгибания поясничного отдела, бокового наклона вправо, бокового наклона влево, подъема выпрямленной правой ноги, подъема выпрямленной левой ноги, напряжение паравертебральных мышц, выраженность сколиоза, способность удерживать на весу обе выпрямленные ноги, усаживание в постель из положения лежа.
Оценка эффективности лечения осуществлена посредством оценки клинических симптомов до начала лечения, после окончания курса лечения, а также через 3 месяца после окончания курса. Данные заносились в специально разработанную форму. Статистическая обработка проведена с использованием дескриптивных методов и модели ANOVA (Analysis of variance). Оценка изменения показателей по сравнению с исходным уровнем, а также сравнение показателей между группами проводились с помощью t-теста.
Результаты и их обсуждение
Обе группы пациентов были сопоставимыми по возрасту, длительности заболевания, выраженности симптоматики и частоте определенных вертеброневрологических синдромов.
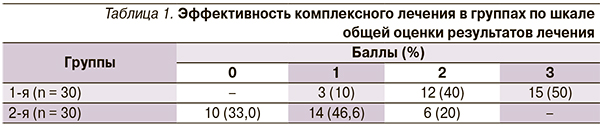
По завершении курса комплексного лечения больных с острой вертеброгенной люмбоишиалгией в основной группе пациентов шкала общей оценки результатов лечения врачом показала, что хороший эффект 2–3 балла отмечен у 27 (90 %) больных, а у остальных 3 (10 %) – незначительно выраженный эффект (табл. 1).
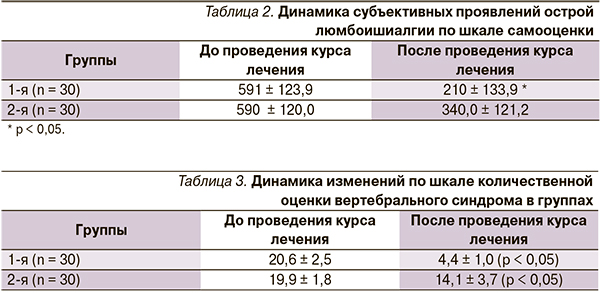
Средние показатели по шкале общей оценки результатов лечения врачом были достоверно выше в первой группе. Лечебный эффект Актовегина проявлен в виде уменьшения выраженности субъективной симптоматики уже после 4–5 инфузий. Острый период первой группы больных длился 10–12 дней, тогда как у второй – до 3 месяцев и у 10 (33 %) больных, получавших традиционное консервативное лечение, произошла хронизация люмбоишиалгии с прогрессированием дистрофически-дегенеративного процесса в МПД. У больных первой группы явлений хронизации процесса не отмечено, что, вероятно, свидетельствует об уменьшении катаболического и преобладании анаболического метаболизма, активированного Актовегином (табл. 2).
Аналогичная динамика отмечена и при оценке выраженности вертебрального синдрома по шкале G. Waddel, представленная в табл. 3.
Результаты проведенного динамического КТ-исследования показали, что у первой группы больных признаки прогрессирования патологического процесса не отмечены, у второй –выявлены признаки прогрессирования заболевания (произошел полный разрыв МПД с развитием патологической подвижности или грыжи, развились гипертрофическая форма артроза дугоотростчатых суставов и стеноз позвоночного канала).
Анализ безопасности лечения показал, что в первой группе пациентов нежелательные явления, в т. ч. связанные с приемом Актовегина, ни у одного больного отмечены не были.
Проведенный нами сравнительный анализ результатов лечения больных острой люмбоишиалгией показал, что у больных с применением традиционного комплексного лечения в сочетании с инфузиями Актовегина значительно сокращается продолжительность острого периода, ни у одного больного не произошло хронизации люмбоишиалгии. В группе контроля у 10 (33 %) больных, получавших только традиционное комплексное консервативное лечение, возникла хронизация люмбоишиалгии с продолжением прогрессирования дистрофически-дегенеративного процесса в МПД и структурах позвоночного двигательного сегмента. Кроме того, у больных, получавших комплексное лечение с применением Актовегина в течение двух лет, обострения заболевания не отмечено, а у больных, получавших только традиционное комплексное лечение за тот же период, в среднем трижды имели место обострения заболевания. Эффект Актовегина на регресс симптоматики и отсутствие прогрессирования заболевания, по нашему мнению, связан с положительным эффектом препарата на клеточный метаболизм, в частности, за счет активации аэробного гликолиза (анаболический метаболизм) и усиления пластических (регенераторных) процессов в структурах пораженного позвоночно-двигательного сегмента.
Заключение
Таким образом, нами получены клинические и нейровизуализационные свидетельства эффективности применения комбинированной терапии с применением Актовегина пациентами с дистрофическими заболеваниями позвоночника. Переключение катаболического метаболизма в хрящевой ткани пораженного позвоночно-двигательного сегмента на анаболический путь является патогенетическим способом лечения ряда дистрофических заболеваний позвоночника.


