Введение
Сахарный диабет 2 типа (СД2) – это хроническое, прогрессирующее заболевание, которое приводит к развитию специфических сосудистых осложнений микро- и макроангиопатии, что в свою очередь увеличивает сердечно-сосудистую летальность в 4–5 раз по сравнению с общей популяцией. Крупные рандомизированные исследования доказали важность гликемического контроля в снижении риска прогрессирования диабетических сосудистых осложнений [1]. Так, в Европейском проспективном исследовании EPIC-Norfolk была выявлена прямая связь между гипергликемией и риском сердечно-сосудистых заболеваний: повышение гликированного гемоглобина (НbА1с) на 1 % увеличивало риск сердечно-сосудистых заболеваний в 1,3 раза (р < 0,001). На рис. 1 приведены показатели гликемического контроля по данным Государственного регистра СД (2009) и российского исследования Диаконтроль (2010).

Сходные данные продемонстрированы и в европейском исследовании PANORAMA: 38 % пациентов с СД2 не достигли уровня HbA1c < 7 %, 80 % страдали артериальной гипертензией, у 56 % была диагностирована гиперхолестеринемия, а 46 % имели висцеральное ожирение. Такая ситуация во многом объясняется клинической инерцией врачей, занимающихся лечением СД2, и плохой мотивацией самих пациентов. Мало кто из врачей-эндокринологов учитывает тот факт, что у большинства пациентов с СД2 на фоне избыточной массы тела наблюдается прогрессирующее снижение массы функционирующих β-клеток. В связи с этим лечение пероральными сахароснижающими препаратами (ПССП) не позволяет многим пациентам с СД2 достигать и/или поддерживать адекватный гликемический контроль.
Известно, что для СД2 характерны следующие основные патофизиологические механизмы, на которые следует обращать внимание, когда речь идет о контроле заболевания:
- инсулинорезистентность;
- дефицит инсулина;
- повышение продукции глюкозы печенью;
- гиперглюкагонемия.
Преимущества сахароснижающей терапии с добавлением базального аналога человеческого инсулина суточного действия
Необходимо подчеркнуть, что среди существующих методов лечения СД2 добавление инсулина к терапии ПССП оказывает целенаправленное воздействие на все вышеупомянутые патофизиологические дефекты. С течением времени (на фоне инсулинорезистентности и хронической гипергликемии) продукция инсулина β-клетками начинает снижаться. Таким образом, развивается относительная инсулиновая недостаточность. Следует отметить, что своевременное назначение инсулинотерапии приводит к значительному улучшению контроля гликемии у пациентов с СД2. Однако вопрос о сроках начала использования инсулина по отношению к другой антидиабетической терапии служит предметом серьезных исследований.
В то же время назначение инсулина по сравнению с терапией ПССП позволяет достигать более эффективного гликемического контроля. Надо отметить, что начало инсулинотерапии требует дополнительных усилий со стороны как врача, так и пациента [2, 3]. По данным современных исследований, инсулин назначается через 10–15 лет после установления диагноза СД2.
Решение начать инсулинотерапию больных СД2 не является очень простым. В связи с этим хочется привести мнение европейских экспертов по формированию политики в области СД (1989): «Лечение инсулином должно начинаться не слишком рано и не слишком поздно». Не слишком рано – т. к. дефицит секреции инсулина может быть вторичным по отношению к инсулинорезистентности; кроме того, возрастает риск развития гипогликемии и прибавки массы тела [4, 5]. Не слишком поздно – с целью достижения оптимального гликемического контроля как можно раньше. В настоящее время эта рекомендация звучит следующим образом: инсулин при СД2 должен назначаться вовремя.
В современной литературе широко обсуждается вопрос старта (инициации) инсулинотерапии. Так, данные по России международного исследования СREDIT показали, что [6], на старте инсулинотерапии используются следующие схемы: только базальный инсулин – 66,2 % пациентов, базальный инсулин + инсулин короткого действия – 17,9 %, только двуфазный инсулин – 14,4 %, только инсулин короткого действия – 1,1 %, другие схемы – 0,4 %. Самым распространенным остается комбинированный вариант начала инсулинотерапии, включающий базальный инсулин и ПССП. Наиболее вероятный механизм контроля гликемии при комбинированной терапии инсулин + ПССП – это подавление продукции глюкозы печенью днем и ночью с одновременным контролем уровня глюкозы между приемами пищи и ночью. Результаты 12-недельного исследования, проведенного на Российской популяции больных СД2, показали высокую эффективность инсулина гларгин (Лантус). При его добавлении к ПССП уровень HbA1с снизился с 9,6 до 7,5 %, гликемия натощак – с 10,8 до 6,4 ммоль/л. При этом необходимо отметить, что большинство пациентов в течение 12 недель испытали лишь 1–2 эпизода легкой гипогликемии [22].
Эффективность и безопасность назначения базального инсулина
Весьма серьезным барьером в назначении инсулина пациентам с СД2 служит наличие у них избыточной массы тела или ожирения разной степени выраженности. На фоне инсулинотерапии вес может еще больше увеличиться. Улучшение метаболического контроля без прироста массы тела является сложной задачей. В связи с этим заслуживают внимания данные, полученные в ходе исследования по оценке динамики массы тела [13].
Наблюдались 72 пациента с СД2 в течение 36 недель: 32 пациента получали терапию инсулином гларгин в комбинации с глимепиридом или глимепиридом в комбинации с метформином. Другие 40 пациентов получали инсулин гларгин однократно в течение суток и аналог человеческого инсулина ультракороткого действия лизпро перед основными приемами пищи. У 32 пациентов первой группы масса тела уменьшилась по сравнению с начальной. У 40 пациентов второй группы, получавших только инсулинотерапию, отмечена тенденция к повышению массы тела, которая, однако, не была статистически значимой.
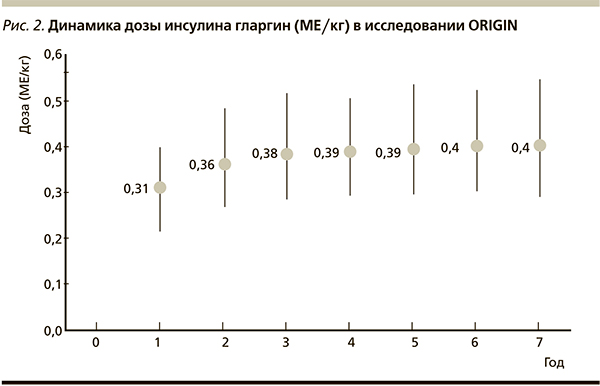
Наглядной иллюстрацией эффективности и безопасности раннего назначения базального аналога инсулина гларгин является исследование ORIGIN [7], в котором на протяжении 7 лет уровень HbA1с поддерживался в пределах 5,9–6,2 %. Глюкоза крови натощак у лиц с предиабетом на старте исследования была на уровне 6,1 ммоль/л, а после начала терапии инсулином гларгин – в пределах 5,0–5,1 моль/л на протяжении 7 лет. При этом частота тяжелых гипогликемий в группе пациентов, получавших инсулин гларгин, составила лишь 0,01 эпизод/пациент/год! Эти результаты были получены при раннем назначении гларгина* пациентам с нарушенной толерантностью к углеводам или с СД2 небольшой длительности на фоне отягощенного сердечно-сосудистого анамнеза. Кроме того, очень важным клиническим аспектом является доза инсулина гларгин, требуемая для достижения поставленных целей гликемического контроля.
На рис. 2 показано, что на протяжении всех 7 лет наблюдения суточная доза вводимого инсулина оставалась стабильной и составляла в среднем 0,4 МЕ/кг массы тела. Необходимо подчеркнуть, что при этом изменение массы тела было минимальным (+1,6 кг) в группе, получавшей гларгин, по сравнению с группой на стандартной терапии (-0,5 кг).
Не менее важным результатом этого крупномасштабного исследования стало отсутствие повышения частоты рака на фоне применения инсулина гларгин в течение 7 лет наблюдения.
Таким образом, исследование ORIGIN показало:
- раннее назначение гларгина позволило достигнуть и удержать целевой контроль гликемии без выраженного набора массы тела;
- поддержание строгих целевых уровней гликемии натощак не влияет на сердечно-сосудистые исходы;
- общая частота гипогликемии была весьма низкой – 0,1 эпизода на 1 пациента в год, а частота тяжелых гипогликемий еще ниже – 0,01 эпизода на 1 пациента в год;
- применение гларгина в течение 7 лет не вызывало повышения риска развития любых форм рака.
Дозирование базальных инсулинов
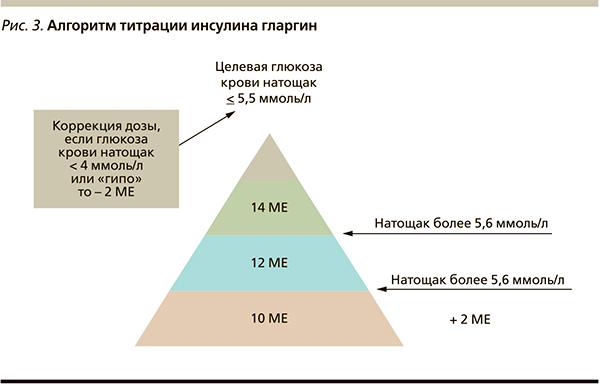
Сегодня наиболее простыми являются алгоритмы титрования, ориентированные на целевую гликемию натощак [8, 9]. На рис. 3 представлен наиболее широко используемый алгоритм, разработанный специально для инсулина гларгин [15]: коррекция дозы осуществляется 1 раз в 3 дня на 2 МЕ в зависимости от уровня гликемии натощак.
В Международном центре диабета (РМАПО МЗ РФ, Москва) используются правила инициации и коррекции инсулинотерапии для пациентов с СД2, подробно изложенные в пособии «Поэтапное управление сахарным диабетом» (2010, 5-е издание):
- коррекция гликемии осуществляется по ее результатам за последние 3 дня;
- стартовая доза инсулина составляет 0,1–0,2 ЕД/кг веса;
- коррекция дозы инсулина осуществляется 1 раз в 3 дня на 1–2 единицы;
- единовременно следует изменять только одну дозу препарата;
- производится коррекция сначала гипогликемии, затем гипергликемии;
- в первую очередь корректируется гликемия натощак;
- при общей дозе инсулина более 1 ЕД/кг необходимо исключить чрезмерную инсулинизацию;
- при неспособности распознать гипогликемию следует повысить целевые значения гликемии.
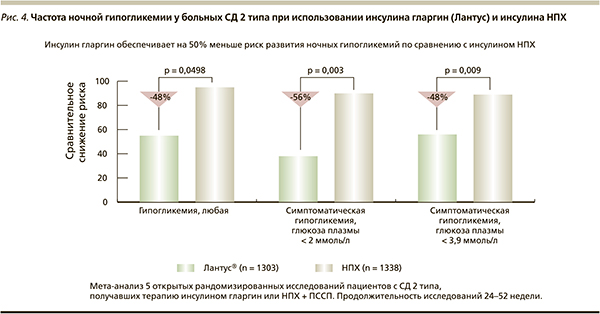
Анализируя действие базальных инсулинов, следует отметить, что инсулины НПХ, гларгин и детемир в одинаковой степени снижают уровень HbA1с [10]. Однако при схожей эффективности в плане снижения HbA1с аналоги инсулина (гларгин, детемир) имеют преимущества в плане более низкого риска развития гипогликемий. Данные мета-анализа, проведенного на основании 10-летнего опыта применения инсулина гларгин (рис. 4), показали в 2 раза меньшую частоту гипоглике-мий, включая тяжелые эпизоды (уровень гликемии < 2 ммоль/л) [11, 12].
Хорошо известно, что после достижения целевой гликемии натощак следует обеспечивать контроль постпрандиальной гипергликемии (ППГ) с помощью коротких инсулинов или их ультракоротких аналогов. Как правило, необходимость прандиального контроля возникает в тех случаях, когда на фоне базальных инсулинов добиваются целевых значений гликемии натощак, а уровень HbA1с при этом остается выше намеченного.
Интенсификация инсулинотерапии
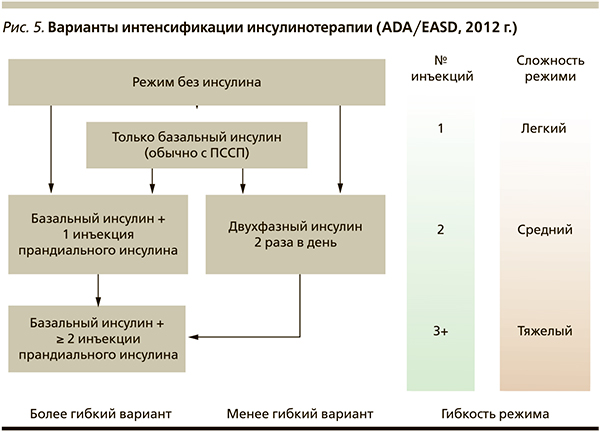
Эпидемиологические и клинические исследования показали, что ППГ является прямым и независимым фактором риска развития сердечно-сосудистых заболеваний. Постпрандиальные подъемы гликемии > 8,8 ммоль/л свидетельствуют о необходимости назначения инъекций инсулина перед основными приемами пищи. Современные способы интенсификации инсулинотерапии различаются по количеству инъекций прандиального инсулина для конкретного пациента, типу применяемого инсулина, гибкости используемого режима. На рис. 5 представлены варианты интенсификации инсулинотерапии, согласно рекомендациям ADA/EASD (2012).
Предпочтительной остается мягкая, пошаговая интенсификация инсулинотерапии. В зависимости от гибкости назначаемого режима пациент может продолжать получать базальный инсулин и одну инъекцию прандиального инсулина в самый большой прием пищи (режим базал-плюс). Целесообразность этого режима основана на результатах ряда исследований, демонстрирующих максимальный подъем ППГ после самого большого приема пищи. Воздействие на главный прандиальный пик может улучшить 24-часовой гликемический контроль и обеспечить достижение целевого уровня HbА1с [16, 17]. Интересно отметить, что быстродействующие аналоги инсулина по сравнению с простыми человеческими инсулинами были более эффективны в плане снижения ППГ после завтрака и обеда. После ужина различий между простыми человеческими инсулинами и быстродействующими аналогами инсулина не выявлено. Эти данные получены в рамках мета-анализа различных исследований, посвященных сравнению простых человеческих инсулинов и быстродействующих аналогов инсулина [14].

Так как на фоне инсулинотерапии существует риск развития гипогликемии и прибавки массы тела, в настоящее время рассматриваются и другие альтернативные варианты интенсификации сахароснижающей терапии. Имеется возможность сочетания базального инсулина гларгин со всеми существующими классами сахароснижающих препаратов. Очень интересным и перспективным сочетанием выглядит комбинация гларгина и агонистов глюкагоноподобного пептида-1 (а-ГПП-1). В ряде исследований показано, что добавление а-ГПП-1 к базальному инсулину приводит к существенному снижению уровня глюкозы после приема пищи, HbA1c, массы тела и характеризуется низкой базальной потребностью в инсулине без увеличения риска гипогликемии. В настоящее время отсутствуют результаты долгосрочных наблюдений эффективности и безопасности подобной комбинации, однако в перспективе такой терапевтический вариант интенсификации получит всестороннее клиническое подтверждение. Например, Ассоциация диабетологов Великобритании представила работу, в которой наблюдались 4857 пациентов из 126 центров, получавших экзенатид [18]. При этом 40 % пациентов применяли его в сочетании с инсулином. Использование этой комбинации в течение 12 месяцев привело к снижению уровня HbA1c на 0,51 %, массы тела – на 5,8 кг, к отмене инсулина 17 % пациентов.
Весьма интересны и другие исследования подобной комбинированной терапии. Так, например, международное исследование GetGoal с включением более 1250 пациентов, получавших новый препарат группы а-ГПП-1 (ликсисенатид – в России еще не зарегистрирован) в составе комбинированной терапии, в т. ч. и с гларгином [19, 20, 21], продемонстрировало существенное улучшение гликемического контроля, особенно ППГ, достоверное снижение массы тела (рис. 6). В настоящее время клинические исследования ликсисенатида продолжаются.
Заключение
Многим пациентам с СД2 на определенном этапе заболевания требуется инсулинотерапия. В качестве пре-парата для ее инициации может быть рекомендован базальный инсулин в комбинации с ПССП. Для интенсификации базальной инсулинотерапии возможно поэтапное добавление короткого (прандиального) инсулина или его ультракоротких аналогов.



