Сахарный диабет типа 2 (СД2) представляет собой тяжелое, прогрессирующее заболевание. Несмотря на достижения в области диагностики и лечения СД2, хронические осложнения недуга являются главной проблемой для большинства больных, тем более что к моменту его диагностики у половины пациентов уже присутствуют макро- и микрососудистые осложнения [1, 2]. Свой вклад в рост числа различных осложнений и высокую смертность вносят неудовлетворительный контроль, а также часто неэффективные режимы терапии заболевания [3].
Предотвращение хронических осложнений, которые становятся причиной ранней инвалидизации и высокой летальности при СД2, – это важнейшая задача современной медицины. Несмотря на сложные патогенетические механизмы сосудистых осложнений, установлено, что основная их причина состоит в хронической гипергликемии [2, 4, 5]. При оценке значимости гипергликемии необходимо учитывать, что она редко возникает в отсутствие других весомых метаболических нарушений, которые обладают самостоятельным значением в развитии макро- и микрососудистых осложнений СД2, но вместе с тем усиливают неблагоприятное воздействие друг на друга и требуют своевременной активной коррекции.
Несомненно, оптимизация метаболического контроля имеет большое значение в контексте возможности снижения частоты хронических осложнений. Медикаментозное снижение гипергликемии достигается назначением различных препаратов с учетом того, что фармакотерапия СД2 должна воздействовать на ключевые патофизиологические нарушения, присущие этому заболеванию: дисфункцию β-клеток и инсулинорезистентность [3, 6]. Препараты сульфонилмочевины (ПСМ) являются эффективным лекарственным средством, на фоне их применения гликозилированный гемоглобин (HbA1c) в среднем снижается на 1,5–2,0 %, что превосходит эффекты многих сахароснижающих препаратов (тиазолидиндионы, ингибиторы дипептидилпептидазы (ДПП-4), агонисты глюкагоноподобного пептида-1 (ГПП-1). При этом вариабельность степени снижения гликемии связана с исходным уровнем показателя до начала лечения ПСМ. В клиническом плане важно, что ПСМ позволяют быстро снизить и гликемию натощак, и постпрандиальную гликемию у больных СД2 [6, 7].
В лечебной практике ПСМ используются более полувека и по-прежнему остаются широко применяемыми сахароснижающими средствами [8, 9]. Снижение гликемии как результат действия ПСМ происходит за счет стимуляции секреции инсулина β-клетками поджелудочной железы, необходимой для преодоления имеющейся инсулинорезистентности [5, 6, 8]. Как результат – повышение уровня инсулина в крови обеспечивает утилизацию глюкозы инсулинзависимыми тканями и подавление ее гепатической продукции. ПСМ связываются со специфическими белками-рецепторами на клеточной мембране β-клеток – SUR-1, представляющими собой белки АТФ-зависимых калиевых каналов клеточной мембраны, приводя к их закрытию и деполяризации мембран β-клеток. Это влечет за собой открытие кальциевых каналов и быстрое поступление кальция внутрь клеток. Повышение концентрации ионов кальция внутри β-клеток способствует движению гранул, содержащих инсулин, через их мембрану и секреции инсулина в кровоток [6, 10, 11].
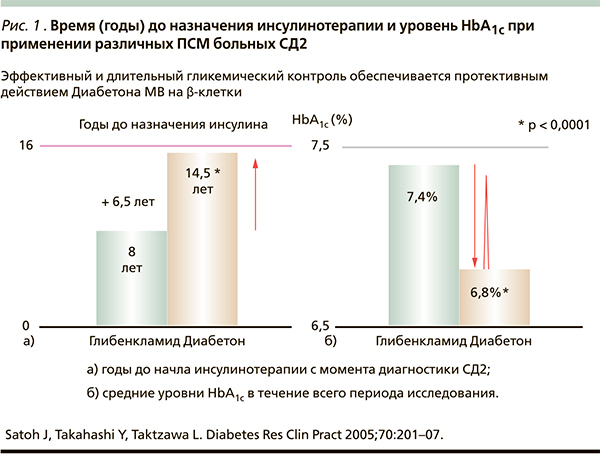
 Принято считать, что в целом механизм действия ПСМ одинаков. В то же время по своей химической структуре этот класс неоднороден, что и определяет индивидуальные терапевтические свойства отдельных представителей. Принципиальный подход к выбору того или иного ПСМ основывается на оценке баланса эффективности, безопасности и доступности для пациента. Неодинаковая аффинность ПСМ к специфическим рецепторам β-клеток поджелудочной железы обусловливает их различную сахароснижающую активность. Очевидно, что чем выше сродство ПСМ к рецептору, тем дольше подавляющее влияние препарата на АТФ-зависимые К+-каналы, а значит, сильнее будет стимулироваться эндогенная секреция инсулина β-клетками [10, 11]. Так, глибенкламид – весьма сильное средство в отношении снижения гликемии, что обусловлено низкой обратимостью связи препарата с рецептором сульфонилмочевины, но как нежелательный результат действия препарата – пролонгированная секреторная активность β-клеток [6, 12, 13]. Между тем это может сопровождаться чрезмерной гиперинсулинемией, чреватой риском развития гипогликемий, а в прогностическом плане – быстрым истощением функциональных резервов β-клеток при применении глибенкламида, что ускоряет время назначения инсулинотерапии (рис. 1) [12–14]. С позиций патофизиологии СД2 крайне важно сохранить инсулиносекреторный потенциал β-клеток поджелудочной железы [1, 6, 8].
Принято считать, что в целом механизм действия ПСМ одинаков. В то же время по своей химической структуре этот класс неоднороден, что и определяет индивидуальные терапевтические свойства отдельных представителей. Принципиальный подход к выбору того или иного ПСМ основывается на оценке баланса эффективности, безопасности и доступности для пациента. Неодинаковая аффинность ПСМ к специфическим рецепторам β-клеток поджелудочной железы обусловливает их различную сахароснижающую активность. Очевидно, что чем выше сродство ПСМ к рецептору, тем дольше подавляющее влияние препарата на АТФ-зависимые К+-каналы, а значит, сильнее будет стимулироваться эндогенная секреция инсулина β-клетками [10, 11]. Так, глибенкламид – весьма сильное средство в отношении снижения гликемии, что обусловлено низкой обратимостью связи препарата с рецептором сульфонилмочевины, но как нежелательный результат действия препарата – пролонгированная секреторная активность β-клеток [6, 12, 13]. Между тем это может сопровождаться чрезмерной гиперинсулинемией, чреватой риском развития гипогликемий, а в прогностическом плане – быстрым истощением функциональных резервов β-клеток при применении глибенкламида, что ускоряет время назначения инсулинотерапии (рис. 1) [12–14]. С позиций патофизиологии СД2 крайне важно сохранить инсулиносекреторный потенциал β-клеток поджелудочной железы [1, 6, 8].
В ряду ПСМ современный препарат гликлазид (Диабетон МВ) наделен всеми необходимыми клинически значимыми свойствами, а его применение больными СД2 позволяет избегать побочных эффектов, традиционно свойственных этому классу сахароснижающих средств (гипогликемии, прибавка массы тела) [14–17]. Ключевым показателем нарушения функции β-клеток поджелудочной железы служит утрата первой (ранней) фазы секреции инсулина, которая играет важную роль в метаболизме глюкозы [3, 18]. Ранняя фаза секреторного ответа инсулина отвечает за подавление гепатической продукции глюкозы, секреции глюкагона и липолиза, повышает чувствительность периферических тканей к действию инсулина, способствуя утилизации ими глюкозы в постпищевой период. Составляя около 10 % от суточной секреции инсулина, первая фаза ограничивает рост гликемии в постпрандиальный период [18–20]. Отдельного внимания заслуживает свойство гликлазида восстанавливать первую фазу секреции инсулина [21, 22], что максимально приближает к физиологическому ответу β-клеток на прием пищи, а с учетом очевидной связи стимуляции секреции инсулина и наличия достаточного уровня глюкозы достоверно снижает риск эпизодов гипогликемий [19, 20].
Макрососудистые осложнения СД2 до сих пор остаются главной проблемой для большинства пациентов. Среди больных СД2 распространенность ишемической болезни сердца выше в 2–4 раза, риск развития острого инфаркта миокарда (ОИМ) – в 6–10, а мозговых нарушений – в 4–7 раз выше, чем среди лиц без диабета [23, 24]. Иначе говоря, нельзя не отметить наличия высокого риска сердечно-сосудистых осложнений у таких пациентов, что выдвигает особые требования к кардиоваскулярной безопасности сахароснижающих лекарственных средств [25].
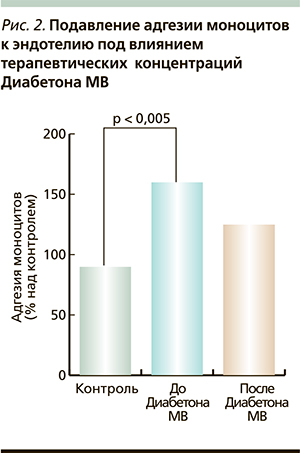
 Исследования в области хронических осложнений СД2 показали, что помимо прямого воздействия гипергликемии механизмами, вовлеченными в их развитие, являются окислительный стресс, генерализованная эндотелиальная дисфункция, нарушение реологии крови [23–27]. В этом плане важно помнить, что фармакологический профиль Диабетона МВ характеризуется не зависящим от сахароснижающего эффекта сосудистым действием, включая влияние на атерогенез, тромбообразование, нарушение эндотелиальной функции и антиоксидантное действие [28–31]. Считается, что эти благоприятные свойства Диабетона МВ обусловлены его химической структурой: наличием в отличие от других ПСМ амино-азобицикло-октанового кольца. Получены данные, свидетельствующие о снижении содержания в крови свободных радикалов, подавлении адгезии моноцитов к эндотелию под влиянием терапевтических концентраций Диабетона МВ (рис. 2) [29, 30]. Здесь следует отметить и антиатерогенный эффект этого препарата: например, в терапевтических концентрациях Диабетон МВ значительно повышает время задержки между воздействием на липопротеиды низкой плотности прооксидантов и началом окисления. Иначе говоря, эта защита липопротеидов низкой плотности от окисления и этот эффект, как показало исследование, не воспроизводятся при приеме других ПСМ [31]. Эти свойства препарата значительно увеличивают возможности лечения СД2, о чем свидетельствуют результаты недавних исследований.
Исследования в области хронических осложнений СД2 показали, что помимо прямого воздействия гипергликемии механизмами, вовлеченными в их развитие, являются окислительный стресс, генерализованная эндотелиальная дисфункция, нарушение реологии крови [23–27]. В этом плане важно помнить, что фармакологический профиль Диабетона МВ характеризуется не зависящим от сахароснижающего эффекта сосудистым действием, включая влияние на атерогенез, тромбообразование, нарушение эндотелиальной функции и антиоксидантное действие [28–31]. Считается, что эти благоприятные свойства Диабетона МВ обусловлены его химической структурой: наличием в отличие от других ПСМ амино-азобицикло-октанового кольца. Получены данные, свидетельствующие о снижении содержания в крови свободных радикалов, подавлении адгезии моноцитов к эндотелию под влиянием терапевтических концентраций Диабетона МВ (рис. 2) [29, 30]. Здесь следует отметить и антиатерогенный эффект этого препарата: например, в терапевтических концентрациях Диабетон МВ значительно повышает время задержки между воздействием на липопротеиды низкой плотности прооксидантов и началом окисления. Иначе говоря, эта защита липопротеидов низкой плотности от окисления и этот эффект, как показало исследование, не воспроизводятся при приеме других ПСМ [31]. Эти свойства препарата значительно увеличивают возможности лечения СД2, о чем свидетельствуют результаты недавних исследований.
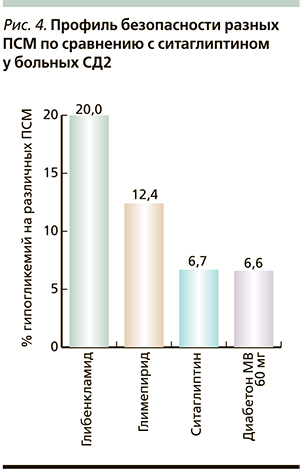
Представляется важным анализ данных датского регистра, включившего 107 806 больных СД2 (из них у 9607 пациентов в анамнезе острый инфаркт миокарда (ОИМ). По результатам 9-летнего наблюдения выявлено достоверное снижение риска общей, сердечно-сосудистой смертности, ОИМ, инсульта у пациентов как с перенесенным ОИМ, так и без него, получавших гликлазид, в отличие от тех, кто принимал другие ПСМ (рис. 3) [32].
Принимая во внимание высокий сердечно-сосудистый риск для пациентов с СД2, нельзя не остановиться на результатах обсервационного исследования A.S. Abdelmoneim и соавт. с участием 21 325 пациентов с СД2, в котором изучали риск развития и прогноз острого коронарного синдрома при использовании разных ПСМ на протяжении 5,5 лет наблюдения. Частота указанных событий зависела от проводимой сахароснижающей терапии. Высокие показатели смертности, а также большее количество госпитализаций, связанных с ОКС, выявлены среди больных СД2, которые принимали глибурид. Так, применение глибурида ассоциировалось с увеличением на 14 % риска ОКС по сравнению с гликлазидом [33].
В дополнение к этому ретроспективный анализ украинского регистра («System of Diabetes Mellitus Supervisionin Ukraine» – SINADIAB) определил принципиальные отличия по рискам общей смертности и смертности от сердечно-сосудистых заболеваний между пациентами с СД2, получавшими разные ПСМ: глибенкламид (n = 50 341), гликлазид (n = 11 368) и глимепирид (n = 2479) [12]. Применение глибенкламида ассоциировалось с более высокими показателями общей смертности по сравнению с гликлазидом (отношение шансов смерти – 0,33; 95 % доверительный интервал – 0,26–0,41; p < 0,001) и глимепиридом (отношение шансов смерти – 0,605; 95 % доверительный интервал – 0,413–0,886; p < 0,01). Однако в отношении смертности от сердечно-сосудистых заболеваний достоверные различия были получены только для гликлазида (отношение шансов смер-ти – 0,29; 95 % доверительный интервал – 0,21–0,38; p < 0,001). Иначе говоря, с целью улучшения отдаленного прогноза для больных СД2 следует уделять внимание выбору ПСМ.
В целом подобные результаты исследований можно считать важным источником при выборе эффективной стратегии сахароснижающей фармакотерапии в отношении улучшения отдаленного прогноза СД2. Очевидно, что для благоприятного прогноза заболевания недостаточно только снижения уровня гликемии, необходимо принимать во внимание и другие метаболические эффекты сахароснижающих препаратов, что особенно важно для пациентов с ИБС.
Говоря о микрососудистых осложнениях, следует напомнить, что, согласно результатам исследования ADVANCE, в группе интенсивного контроля гликемии, основанного на применении Диабетона МВ, регресс нефропатии минимум на одну стадию (т. е. от макро- к микро- или нормоальбуминурии либо от микро- к нормоальбуминурии) отмечен у 62 % пациентов [15]. Надо сказать, что эффективность применения Диабетона МВ для профилактики прогрессирования альбуминурии становится дополнительным основанием к его использованию пациентами с СД2 в качестве сахароснижающего средства.
В связи с этим остается сделать следующее заключение: применение Диабетона МВ позволяет достигать важной цели при лечении больных СД2 – улучшение отдаленных исходов недуга, касающихся не только сердечно-сосудистых заболеваний, но и микрососудистых осложнений: прогрессирования диабетической нефропатии как одного из наиболее серьезных и инвалидизирующих последствий диабета.
Важнейшая цель терапии СД – безопасное снижение всех параметров гликемического контроля до показателей, как можно более близких к нормальным значениям, а выбор наиболее безопасных режимов терапии с меньшим риском гипогликемий имеет определяющее значение для предупреждения сердечно-сосудистых рисков у пациентов. Ведь наиболее тяжелые последствия гипогликемий напрямую связаны как с сердечно-сосудистой заболеваемостью, так и со смертностью. Кроме того, дополнительный вклад в повышение риска гипогликемий вносит хроническая болезнь почек, которая часто наблюдается среди больных СД2 и, соответственно, требует от сахароснижающей терапии минимизации таких рисков [34].
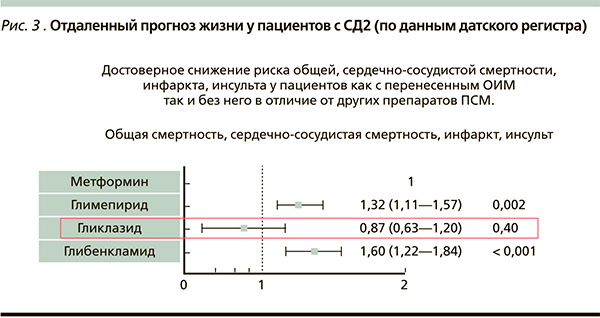
Применяющиеся в клинической практике сахароснижающие препараты эффективны в отношении снижения уровня гликемии, однако в вопросах безопасности они существенно отличаются друг от друга [35, 36]. В этом плане важно остановиться на недавнем исследовании (The Middle East Ramadan study), в котором изучали частоту симптоматической гипогликемии у постящихся мусульман с СД2, принимающих различные пероральные сахароснижающие препараты (ситаглиптин или ПСМ) во время Рамадана [37]. Считается, что класс ингибиторов ДПП-4 безопасен в плане гипогликемий. Результаты исследования показали, что частота эпизодов гипогликемий была меньше для гликлазида по сравнению с другими ПСМ и такой же, как для ингибитора ДПП-4 ситаглиптина (рис. 4). Следовательно, выбор ПСМ может влиять на риск развития гипогликемии в условиях измененного режима питания (например, нерегулярного приема пищи), а более безопасным, по результатам цитируемой работы, является применение гликлазида. Кроме того, о низком риске гипогликемий на фоне использования гликлазида, сопоставимым с ситаглиптином, свидетельствуют также результаты исследования S.R. Aravind и соавт. (2012) [38]. Говоря о гипогликемиях, нельзя не вспомнить, что стратегия достижения гликемического контроля в исследовании ADVANCE, основанная на Диабетоне МВ, ассоциировалась с очень низким риском эпизодов гипогликемий [15]. Между тем 70 % больных получали препарат в суточной дозе 120 мг, а число гипогликемий было вчетверо меньше, чем в исследовании UKPDS, несмотря на более низкий уровень HbA1c, достигнутый пациентами в ADVANCE.
Большой интерес всегда вызывают данные, полученные в условиях реальной клинической практики, а не только в жестких рамках рандомизированного исследования. С этих позиций показательны результаты наблюдательной программы по оценке эффективности и безопасности терапии Диабетоном МВ в повседневной практике – DIAMOND (DIAMicrON MR in Daily practice) [39]. Основной ее целью стала оценка эффективности применения Диабетона МВ в монотерапии и/или в комбинации, а также безопасности стратегии увеличения дозы препарата до максимальной (120 мг/сут).
В исследовании DIAMOND приняли участие 394 больных с неудовлетворительным контролем СД2 на терапии диетой или одним пероральным сахароснижающим препаратом (метформином, глитазоном, ингибитором ДПП-4, акарбозой, глинидом или ПСМ [кроме Диабетона МВ]). Средний возраст пациентов при включении составил 59,0 ± 9,2 года, средний уровень HbA1c – 8,4 ± 0,9 %. Пациентов переводили на Диабетон МВ с продолжением или отменой предшествующей сахароснижающей терапии. При последнем варианте терапии Диабетон МВ назначался в эквивалентной дозе ранее принимаемого сахароснижающего средства (например, 2 таблетки Манинила 3,5 мг = 2 таблеткам Диабетона МВ, Амарил 1 мг = 30 мг, 2 мг = 60 мг Диабетона МВ соответственно и т. д.).
Через полгода лечения Диабетоном МВ (в монотерапии для 30 % и в комбинации для 70 % пациентов) целевой уровень HbA1c < 7 % достигнут 64,7 % пациентов, более того, HbA1c < 6,5 % – каждым третьим пациентом из них. Несмотря на небольшую продолжительность исследования, отмечена положительная динамика альбуминурии, о чем свидетельствовало снижение числа пациентов как с микроальбуминурией (с 29,19 до 22,59 %), так и с протеинурией (с 5,08 до 3,30 %). В целом низкая частота гипогликемий имела место при эффективном результате терапии: значимом снижении уровня HbA1c на 1,6 %. Важно подчеркнуть, что тяжелых гипогликемий отмечено не было, а легкие эпизоды зарегистрированы у 2,28 % пациентов с СД2.
Диабетон МВ назначается один раз в сутки и в удобное для всех время: утром – во время завтрака. Подбор дозы препарата обычно начинают с минимальной (30–60 мг), с последовательной ее титрацией под контролем гликемии устанавливается оптимальная доза Диабетона МВ. Планируя лечение СД2, нужно отчетливо представлять, что это хроническое заболевание, а на любом этапе его прогрессирования важно своевременно проводить коррекцию фармакотерапии. Здесь следует опять обратиться к результатам ADVANCE: значения HbA1c, достигнутые к концу первого года наблюдения в группе интенсивной терапии (6,5 %), удерживались на протяжении всего периода исследования – в течение 5 лет. Для достижения целевого уровня HbA1c 70 % пациентов суточная доза Диабетона МВ была постепенно увеличена до 120 мг [15]. Эти данные демонстрируют принципиальную важность увеличения дозы Диабетона МВ с целью проявления всего спектра эффективности препарата, продемонстрированного во многих исследованиях, что дает возможность улучшения прогноза пациентов – снижения частоты тяжелых осложнений диабета, в частности нефропатии [12, 15, 37, 39].
В заключение следует отметить, что СД2 представляет колоссальную проблему для здоровья населения Российской Федерации. В лечении СД2 должны применяться современные сахароснижающие препараты, доказавшие свою способность не только эффективно и безопасно снижать HbA1c, но и улучшать прогноз.


