Проведение адекватной терапии сахарного диабета 2 типа (СД2) с учетом сложного механизма развития заболевания является важной задачей, предусматривающей достижение определенных целей лечения: обеспечение оптимального метаболического контроля показателей углеводного и липидного обменов, снижение риска развития гипогликемических реакций, предупреждение или замедление прогрессирования поздних осложнений. В исследовании UKPDS (United Kingdom prospective diabetes study) было показано, что снижение уровня гликированного гемоглобина (НbА1с) на 0,9% (с 7,9 до 7,0%) приводило к снижению частоты развития микро- и макрососудистых осложнений. Естественное течение заболевания, связанное с прогрессирующим снижением массы β-клеток поджелудочной железы, со временем затрудняет поддержание целевых параметров гликемии и НbА1с на фоне терапии пероральными сахароснижающими препаратами (ПССП). Менее 50% пациентов могут поддерживать адекватный контроль гликемии на монотерапии ПССП через 3 года от момента манифестации диабета, а через 9 лет только 25% пациентов достигают компенсации заболевания [1]. Это в свою очередь приводит к необходимости интенсификации терапии за счет увеличения дозы лекарственного препарата или же использования двух- или трехкомпонентной комбинированной терапии [2, 3]. Существует вполне устоявшееся мнение, что в случае отсутствия достижения целевых значений гликемии и НbА1с на фоне применения двух ПССП показана инициация терапии инсулином, а не добавление третьего перорального препарата [4]. В то же время подключение к комбинированной терапии ПССП инсулина усложняет схему лечения и снижает качество жизни больных. Это связано с повышением риска развития симптоматических и бессимптомных гипогликемий, отеков, увеличения массы тела, необходимостью титрации дозы инсулина, обучением пациентов, частым мониторингом гликемии. Тяжелая гипогликемия ассоциирована с высоким риском развития «сосудистых катастроф», а повторная гипогликемия значительно повышает риск развития кардиоваскулярных и микрососудистых осложнений [5]. Поэтому внедрение в клиническую практику эффективных и безопасных лекарственных препаратов с минимальным риском развития гипогликемии приобретает особое значение.
В настоящее время выработана общая стратегия лечения СД2, основанная на обновленном Консенсусе ADA (American Diabetes Association) и EASD (European Association for the Study of Diabetes) 2015 г. [6, 7]. Аналогичный документ разработан в России [8].
Стратификация лечебной тактики осуществляется в зависимости от исходного уровня НbА1с. Эффективность терапии оценивается по соответствию достигнутого уровня НbА1с целевому значению. При необходимости проводится интенсификация терапии.
В рутинной клинической практике препаратом первой линии терапии является метформин. Интенсификация терапии или же ее инициация при более высоких показателях гликемии чаще всего осуществляется за счет добавления препаратов группы сульфонилмочевины (ПСМ). Раннее назначение ПСМ в комбинации с метформином является более эффективной стратегией лечения, чем увеличение дозы одного из компонентов комбинации. Это позволяет минимизировать побочные эффекты препаратов. Из группы ПСМ наиболее широко используемым препаратом является глибенкламид (в микронизированной форме).
Последнее время в лечении СД2 активно применяются агонисты рецепторов глюкагоноподобного пептида-1 (аГПП-1). В зависимости от длительности действия они подразделяются на коротко- и длительнодействующие. Длительнодействующие (лираглутид, эксенатид – ЛАР) в основном влияют на показатели гликемии натощак. Короткодействующие (эксенатид, ликсенатид) преимущественно влияют на постпрандиальную гликемию. Первым препаратом из данной группы, появившимся в клинической практике, был короткодействующий аГПП-1 эксенатид. Природный эксенатид (эксендин-4) был выделен из секрета слюнных желез ящерицы-ядозуба (Gilamonster). Лекарственный препарат эксенатид (синтетический аналог белка эксендина-4) является стабильным соединением, хотя нативный ГПП-1 нестабилен. Эксенатид состоит из 39 аминокислотных остатков и на 53% гомологичен нативному ГПП-1. Эксенатид при взаимодействии с чувствительными к ГПП-1 рецепторами действует идентично нативному ГПП-1. Он оказывает инсулинотропное, глюкозозависимое влияние на β-клетки поджелудочной железы, повышает 1-ю (0–10 минут) и 2-ю (10–120 минут) фазы секреции инсулина [2, 9, 10].
Эксенатид, воздействуя на α-клетки поджелудочной железы, вызывает снижение гиперглюкагонемиии как натощак, так и после еды [11]. В то же время препарат не оказывает влияния на физиологическую регуляцию глюкозы в условиях гипогликемии.
Введение эксенатида в дозе 10 мкг 2 раза в сутки вызывает замедление пассажа жидкой и твердой пищи в желудочно-кишечном тракте на 1,3 и 1,8 часа соответственно [11].
В экспериментах на животных показано, что эксенатид стимулирует неогенез и повышает массу β-клеток. Для оценки эффективности терапии эксенатидом были проведены многоцентровые международные исследования, доказавшие высокую эффективность добавления препарата к терапии метформином, ПСМ и их комбинациями. В отсутствие компенсации углеводного обмена у больных СД2 на монотерапии ПСМ в максимальных дозах интенсификация терапии эксенатидом приводила к снижению уровня НbА1с на 0,86±0,11% (р<0,001), уменьшению массы тела на 1,6±0,3 кг (р<0,05) по сравнению с плацебо, 41% пациентов достигли НbА1с≤7% (р<0,001). Не было зарегистрировано гипогликемических состояний. Однако были отмечены побочные эффекты со стороны желудочно-кишечного тракта [12]. Эффективность терапии была оценена в группе пациентов с неудовлетворительным гликемическим контролем на монотерапии метформином (доза >1500 мг/сут, индекс массы тела – 27–45 кг/м2). Дополнительное введение эксенатида в дозе 10 мкг 2 раза в сутки к 30-й неделе терапии приводило к снижению уровня НbА1с на 0,7±0,10% (р<0,001), а 46% пациентов достигли уровня НbА1с≤7% (р<0,01). Было отмечено снижение массы тела на 2,8±0,5 кг (р<0,05) по отношению к плацебо [13].
В 2005 г. в работе D. Kendаll была показана высокая эффективность комбинированной терапии эксенатидом (10 мкг 2 раза в сутки) с ПСМ (в максимальных дозах) и метформином (>1500 мг/сут). Терапия в течение 30 недель приводила к снижению уровня НbА1с на 0,8±0,1% (р<0,001), уровня НbА1с≤7% достигли 34% пациентов (р<0,001). Было отмечено снижение массы тела на 1,6±0,2 кг (р<0,05). Из побочных эффектов наиболее часто регистрировалась тошнота. В 28% случаев были отмечены гипогликемические состояния легкой степени тяжести, потребовавшие коррекции дозы ПСМ [14].
В исследованиях по эффективности комбинации эксенатида с тиазолидиндионом было показано снижение уровня НbА1с на 0,98% (р<0,001), массы тела – на 1,51 кг (р<0,05). Были зафиксированы следующие побочные эффекты: в 40% случаев – тошнота, в 13% – рвота, в 11% – эпизоды гипогликемии. При продолжении приема эксенатида уменьшение массы тела происходило на фоне стабилизации показателей гликемии.
Механизм действия препарата на массу тела является многофакторным. Уменьшению массы тела способствуют снижение аппетита, более быстрое насыщение, замедление скорости эвакуации пищи. Связь ожирения с факторами развития и прогрессирования сердечно-сосудистых осложнений является еще более мощным стимулом для выбора ПССП, вызывающих снижение массы тела. При длительном использовании эксенатида было отмечено достоверное снижение уровней триглицеридов, липопротеидов низкой плотности (ЛПНП), аполипопротеина В, систолического и диастолического артериального давления (АД) и повышение уровня липопротеидов высокой плотности (ЛПВП). В ряде клинических исследований было показано повышение индекса функциональной активности β-клеток (НОМА-β – Homeostasis Model Assessment-β), что свидетельствовало об улучшении секреторной способности β-клеток поджелудочной железы.
Одним из механизмов влияния аГПП-1 на показатели гликемии натощак является ингибирование глюкозозависимой секреции глюкагона α-клетками островковой ткани поджелудочной железы [15]. Постпрандиальная гликемия регулируется за счет изменения скорости опорожнения желудка, секреции инсулина, стимулированной приемом пищи, подавления выделения глюкагона [16]. Однако на фоне длительного использования аГПП-1 может развиваться тахифилаксия (быстрое снижение лечебного эффекта при повторном применении лекарственного препарата) [17]. Эксенатид оказывает более существенное влияние на скорость опорожнения желудка, чем другие препараты этой группы.
Использование аГПП-1 как компонента комбинированной терапии, ассоциируется с низким риском гипогликемии, что связано с противоположным по отношению к уровню гликемии влиянием на секрецию глюкагона.
В связи с особенностью механизма действия эксенатида и его высокой безопасностью он может быть рекомендован ряду пациентов для интенсификации терапии.
Ниже приводится случай из клинической практики.
Клинический случай. Пациентка 56 лет, учитель. СД2 выявлен 8 лет назад на фоне ожирения. Была рекомендована диета с ограничением жиров и углеводов и метформин (1500 мг/сут). В течение последних 3 лет принимает метформин (2000 мг/сут) в комбинации с глибенкламидом (микронизированная форма, 14 мг/сут). Контроль гликемии осуществляет 1 раз в 2 недели. Гликемия плазмы натощак (ГПН) от 9 до 12,2 ммоль/л, постпрандиальная гликемия до 15 ммоль/л. Из сопутствующих заболеваний: неалкогольная жировая болезнь печени (НАЖБП), артериальная гипертензия в течение 10 лет. Постоянно принимает ингибиторы ангиотензинпревращающего фермента в сочетании с блокаторами кальциевых каналов – достигнуты целевые уровни АД (≤140/85 мм рт.ст). Часто отмечает обострения хронического пиелонефрита. Три года назад проведена холецистэктомия. Аллергических реакций не отмечает. Наследственность отягощена по линии матери (мать и сестра матери имеют СД2 и ожирение). Были проведены биохимические и гормональные исследования: оценка уровня инсулина, С-пептида, проинсулина, глюкагона, ГПП-1, адипонектина, резистина, лептина и его рецептора.
Динамика уровней инсулина, проинсулина характеризует состояние β-клеток поджелудочной железы в плане сохранности и завершенности синтетического и секреторного процессов. Известно, что у больных СД2 уровень проинсулина выше, чем у здоровых лиц. Функциональную активность α-клеток поджелудочной железы оценивали по изменению концентрации глюкагона в плазме крови. Потеря первой фазы секреции инсулина способствует повышению секреции глюкагона в постпрандиальном периоде.
У больных СД2 концентрация ГПП-1 в плазме крови снижена и недостаточна для подавления секреции глюкагона и стимуляции секреции инсулина. Кроме того, у них чаще выявляется низкий уровень адипонектина, который играет ключевую роль в снижении чувствительности к инсулину. Резистин, возможно, принимает участие в развитии и поддержании инсулинорезистентности (ИР) при СД2. Секреция резистина регулируется многими факторами, в т.ч. и гипергликемией. Основным эффектом резистина является стимуляция продукции глюкозы печенью. Гормоном, по содержанию которого оценивают метаболическую активность жировой ткани, является лептин. Растворимый рецептор лептина человека принимает участие в транспорте лептина через гематоэнцефалический барьер, способен связывать и инактивировать циркулирующий лептин. Экспрессия растворимого рецептора лептина осуществляется в печени, периферических нервных окончаниях, сердце, мозге, костной ткани.
Функциональную активность β-клеток рассчитывали по формуле:
HOMA-β=20×ИРИ (мкЕД/мл)/ГПН (ммоль/л)-3,5(норма – 100%),
Где ИРИ – иммунореактивный инсулин.
Степень выраженности ИР оценивали по формуле:
HOMA IR=ГПН (ммоль/л)×ИРИ (мкЕД/мл)/22,5 (норма <2,77)
Где HOMA IR – Homeostasis Model Assessment of Insulin Resistance.
Определяли соотношение проинсулина к инсулину по формуле:
Проинсулин (пмоль/л)/Инсулин мкЕД/мл×6,945×100%
Консультация офтальмолога: без патологии.
Учитывая возраст пациентки, длительность СД2, отсутствие тяжелых осложнений диабета, установлен целевой уровень НbА1с<7%. Для интенсификации терапии рекомендован прандиальный аГПП-1 эксенатид (Баета, ЭлиЛили, США) по 1,2 мл (5 мкг) 2 раза в сутки за 30 минут до завтрака и ужина (1 месяц) с последующим увеличением дозы до 2,4 мл (10 мкг) 2 раза в сутки в течение 5 месяцев. Был учтен тот факт, что при проведении самоконтроля максимальные показатели гликемии пациентка регистрировала через 2 часа после еды. Ко 2-му месяцу терапии была уменьшена доза глибенкламида с 14 до 7 мг/сут в связи с эпизодами гипогликемии. Длительность наблюдения составила 6 месяцев. Динамика показателей на фоне добавления к терапии эксенатида представлена в таблице.
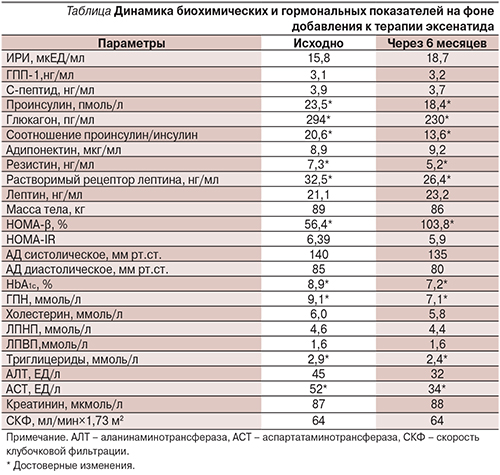
За период наблюдения зафиксирован лишь один эпизод гипогликемии. Масса тела снизилась на 3 кг. Показатели АД 130/80 мм рт.ст. были стабильными на фоне исходной антигипертензивной терапии. Отмечена хорошая переносимость эксенатида, побочных эффектов не было.
На фоне интенсификации терапии эксенатидом отмечено улучшение показателей гликемии (снижение уровня НbА1с на 1,8%) за счет повышения функциональной активности β-клеток поджелудочной железы (увеличение HOMA-β на 84%), улучшение процесса синтеза инсулина (уменьшение соотношения проинсулин/инсулин на 33% ), снижение уровня глюкагона на 22%. Уменьшение уровня резистина косвенно может свидетельствовать об уменьшении ИР на уровне печени, а снижение концентрации рецептора к лептину указывает на повышение чувствительности к лептину. Уменьшение массы тела является дополнительным фактором, способствующим нормализации гликемии. Отмечено снижение уровней АСТ и АЛТ и низкий риск развития гипогликемических состояний.
Таким образом, интенсификация терапии эксенатидом может быть рекомендована пациентам с СД2 и избыточной массой тела, уровнем НbА1с>7% при неэффективности предшествующей комбинированной терапии.


