Целиакия является генетически детерминированным хроническим расстройством пищеварительной системы, при котором происходит повреждение слизистой оболочки тонкой кишки, вызванное иммунологической реакцией на глютен, что приводит к развитию синдрома мальабсорбции [1, 2]. Распространенность целиакии в мире значительно варьируется в разных странах – от 1 : 100 до 1 : 300 в популяции. Высокие цифры заболеваемости отмечены среди жителей Сахары, Индии, Ирана, а также других стран, расположенных вдоль Великого шелкового пути; в Европе эти цифры варьируются от 2,4 % в Финляндии, до 0,3 % в Германии [3]. К сожалению, в России нет эпидемиологических данных, полученных в ходе серьезных скрининговых и клинических исследований в отношении целиакии.
Представляем клинический случай из нашей практики. Больная Ш. 35 лет, домохозяйка, обратилась в декабре 2012 г. с жалобами на диарею до 8–12 раз в сутки, дискомфорт и вздутие в животе в течение последнего года, которым сопутствовали слабость, повышенная утомляемость, похудание более чем на 10 кг. Больная отмечает связь с началом диареи рождение третьего ребенка и длительный период лактации. В течение последнего года неоднократно обследовалась и лечилась у инфекциониста и гастроэнтеролога по месту работы. Кишечные инфекции, органические заболевания толстой кишки были исключены, гистологический тест на Нelicobacter рylori был отрицательным, а гастроэнтеролог с упорством ставил диагноз «хронический панкреатит с внешнесекреторной недостаточностью». Пациентка принимала большие дозы панкреатина, но положительного эффекта от лечения не было. При обращении после сбора жалоб и анамнеза при объективном исследовании индекс массы тела был 17,8 кг/м2, кожные покровы бледные, волосы сухие, ногти ломкие, живот мягкий, безболезненный, печень у края реберной дуги, поставлен предварительный диагноз «синдром избыточного бактериального роста (СИБР), железодефицитная анемия легкой степени тяжести, синдром раздраженного кишечника». Пациентке был назначен дыхательный тест с лактулозой (ЛДТВ) для верификации диагноза, анализ кала на фекальную эластазу-1, предложено заполнить опросник HADS (госпитальная шкала тревоги и депрессии). Дыхательный водородный тест применяется для ориентировочного представления о степени бактериального обсеменения тонкой кишки. Этот показатель находится в прямой зависимости от концентрации водорода в выдыхаемом воздухе натощак. Концентрация водорода в выдыхаемом больными воздухе с заболеваниями кишечника, протекающими с хронической рецидивирующей диареей и бактериальным обсеменением тонкой кишки, значительно превышает 15 ppm. При бактериальном обсеменении тонкой кишки «пик» нарастания концентрации водорода в выдыхаемом воздухе появляется гораздо раньше. Водородные дыхательные тесты на сегодняшний день рассматривают как информативные методы диагностики определенных физиологических и патологических процессов, таких как мальабсорбция углеводов (лактоза, фруктоза, сорбитол), СИБР, определение времени ороцекального транзита. Ввиду неинвазивности и относительной дешевизны во многих случаях они являются диагностическими тестами первой линии обследования [4].
При анализе ЛДТВ у нашей пациентки был выявлен СИБР (рис. 1), уровень фекальной эластазы-1 – более 250 мкг/г каловых масс (в пределах нормы), результаты тестирования по опроснику HADS – Т-5, Д-2 (в пределах нормы).
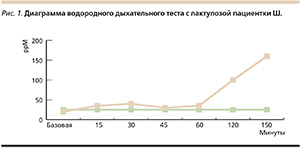 Под СИБР в тонкой кишке понимается патологическое состояние, в основе которого лежит повышенное заселение тонкой кишки фекальной или орофарингиальной микрофлорой, сопровождающееся хронической диареей и мальабсорбцией, в первую очередь жиров и витамина В12. СИБР развивается, когда нарушаются гомеостатические механизмы, контролирующие популяцию бактерий в тонкой кишке. Чаще всего к развитию избыточного роста бактерий приводят снижение секреции соляной кислоты в желудке и нарушение моторики тонкой кишки. Симптомы СИБР не имеют специфичности: метеоризм, вздутие живота, абдоминальная боль или дискомфорт, диарея, утомление, слабость, похудание, они отражают степень распространенности воспаления слизистой оболочки кишки, «наслаиваются» на проявления основного заболевания, являющегося причиной развития СИБР. Более тяжелые симптомы указывают на осложнения СИБР, включая мальабсорбцию, дефицит нутриентов и расстройства метаболизма костной ткани. Неспецифичность этих симптомов часто бывает причиной диагностических ошибок и требует дифференциального диагноза с синдромом раздраженного кишечника, непереносимостью лактозы или фруктозы, целиакией [5].
Под СИБР в тонкой кишке понимается патологическое состояние, в основе которого лежит повышенное заселение тонкой кишки фекальной или орофарингиальной микрофлорой, сопровождающееся хронической диареей и мальабсорбцией, в первую очередь жиров и витамина В12. СИБР развивается, когда нарушаются гомеостатические механизмы, контролирующие популяцию бактерий в тонкой кишке. Чаще всего к развитию избыточного роста бактерий приводят снижение секреции соляной кислоты в желудке и нарушение моторики тонкой кишки. Симптомы СИБР не имеют специфичности: метеоризм, вздутие живота, абдоминальная боль или дискомфорт, диарея, утомление, слабость, похудание, они отражают степень распространенности воспаления слизистой оболочки кишки, «наслаиваются» на проявления основного заболевания, являющегося причиной развития СИБР. Более тяжелые симптомы указывают на осложнения СИБР, включая мальабсорбцию, дефицит нутриентов и расстройства метаболизма костной ткани. Неспецифичность этих симптомов часто бывает причиной диагностических ошибок и требует дифференциального диагноза с синдромом раздраженного кишечника, непереносимостью лактозы или фруктозы, целиакией [5].
Пациентке Ш. было назначено лечение – рифаксимин (Альфа-Нормикс, пр-во «Alfa Wassermann», Италия) 400 мг 2 раза в сутки в течение 7 дней, затем пробиотик (Линекс, пр-во «Sandoz», Словения) по 2 капсуле 3 раза в день в течение 21 дня.
При повторном визите через 2 недели из беседы выявлено, что диарея сохраняется до 5–7 раз в сутки. Результаты ЛДТВ в динамике нормализовались. Назначены анализы крови на антитела класса IgA к глиадину и трансглутаминазе, фиброгастродуоденоскопия с ретродуоденальной биопсией слизистой тонкой кишки. Чувствительность тестов на антитела к глиадину составили 69–85 %, специфичность – 73–90 %, чувствительность к тканевой трансглютаминазе – 85–98 %, специфичность – 95–99 % [6, 7]. Полученные результаты подтвердили диагноз целиакии у больной Ш.: антитела класса IgA к глиадину – 98 МЕ/мл (норма до 25 МЕ/мл), к трансглутаминазе – 78,5 УЕ/мл (норма до 10 УЕ/мл). Морфологическое заключение: субтотальная атрофия ворсин соответствует III-В стадии целиакии по критериям Marsh [8, 9]. На основании полученных данных поставлен диагноз целиакии и назначены аглютеновая диета, поливитамины с микроэлементами.
Основным поставщиком глиадинового белка – глютена – является клейковина, которая содержится в злаковых растениях (пшеница, рожь, ячмень). Попадание глютена в просвет тонкой кишки ведет к активации Т- и В-клеточного иммунного ответов, запуску каскада патологических аутоиммунных реакций, вызывающих и поддерживающих воспаление слизистой оболочки тонкой кишки, поражению других органов и систем организма. Генетическую предрасположенность к целиакии определяют HLA класса 11, DQA- и DQB-гены, локализованные в главном комплексе гистосовместимости. Эти гены (характерны комбинации из вариантов аллелей HLA DQA*0501/DQB*0201 и DQA1*0301/DQB*0302) кодируют HLA DQ2 HLA DQ8 класса 11 белковые молекулы. Экспрессию HLA DQ2 выявляют более чем у 90 %, HLA DQ8 – у 5–10 % больных целиакией. Развитие энтеропатии при целиакии идет параллельно с появлением сывороточных антител класса IgA трансглутаминазы (antiTG), антиэндомизиальных (ЕМА) и антиглиадиновых (AGA) [10]. Клинический спектр целиакии включает случаи с типичными проявлениями (хроническая диарея, потеря веса и т. д.) или «атипичные» внекишечные проявления без явной диареи (анемия, остеопороз, неврологические нарушения и др.), и латентные формы, которые иногда выявляются при серологическом скрининге [11]. Признаки и симптомы целиакии могут варьироваться у разных лиц в зависимости от степени нарушения всасывания: от бессимтомного течения до тяжелых обменных нарушений, связанных с нутритивным дефицитом [12]. Симптомы часто сравнивают с айсбергом, в котором надводная верхушка соответствует числу пациентов с классической мальабсорбцией, а менее типичные или отсутствующие проявления находятся в невидимой зоне ниже ватерлинии [7, 13].
Следующий визит Ш. был назначен через месяц (февраль 2013 г.). Пациентка отмечает урежение стула до 3–4 раз в сутки, вес не увеличивается, периодически – дискомфорт в животе, соблюдает строгую аглютеновую диету, продукты приобретает в специализированном диетологическом магазине, на каждом из них – маркировка и описание, указывающие на отсутствие глютена. Объективные данные: без динамики, по лабораторным данным – нормализация гемоглобина и сывороточного железа.
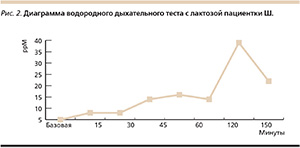
С учетом клинических данных и того, что у больных целиакией часто развивается вторичная лактазная недостаточность, пациентке назначен водородный дыхательный тест с лактозой для поиска лактазной недостаточности [14, 15]. Результаты теста нашей пациентки указывали на выраженную лактазную недостаточность (рис. 2).
К аглютеновой диете была рекомендована диета с исключением лактозы.
Лактазная недостаточность является вторичной при целиакии. M.S. Basso и соавт. исследовали у 188 детей сочетание лактазной недостаточности с целиакией с использованием генетических тестов, а также определяли распространенность целиакии, ассоциированной с лактазной недостаточностью, по сравнению с контрольной группой без целиакии. В результате оценки полученных данных не было выявлено различий в обеих группах по распространенности лактазной недостаточности [16].
Наиболее неблагоприятным прогнозом нелеченой целиакии является отдаленное возникновение множества желудочно-кишечных и внекишечных осложнений. У таких больных возра-стает риск развития онкологических заболеваний органов пищеварения, наиболее частой из которых остается тонкокишечная Т-клеточная лимфома. Кроме того, опасен для жизни язвенный еюнит, который может стать причиной кишечного кровотечения и гибели больного. Вовремя недиагностированная и нелеченая или неправильно леченная целиакия служит причиной возникновения рефрактерной формы заболевания, также уносящей жизни больных.
Единственным методом лечения больных целиакией является строжайшая аглютеновая диета, основанная на полном, пожизненном исключении из рациона питания всех продуктов, содержащих в своем составе пшеницу, рожь, ячмень и овес. Больные с целиакией могут безопасно употреблять в пищу мясо, рыбу, птицу, овощи, фрукты, яйца, молочные продукты, рис, зернобобовые, гречку, кукурузу. Особого внимания заслуживают опасные для больных глютеновой энтеропатией продукты, содержащие в своем составе т. н. скрытый глютен. Например, глютен может попадать в продукты, изготавливаемые фабрично, с полотна производственной линии, входить в состав пищевых добавок, стабилизаторов, красителей, эмульгаторов и т. д. Кроме того, глютен может оказаться в тарелке больного целиакией путем самого банального загрязнения: с прилавков магазинов, разделочных досок, тостеров, миксеров и т. д. Скрытый глютен чаще всего содержится в колбасах, сосисках, мясных, рыбных полуфабрикатах и консервах, пастах и соусах, мороженом, йогуртах, майонезах и маргаринах с глютенсодержащими стабилизаторами, концентрированных сухих супах и бульонных кубиках, некоторых видах растворимых напитков (чай, кофе, какао), смесях для быстрого приготовления, кукурузных хлопьях (при использовании ячменной патоки), имитациях морепродуктов (крабовых палочках и др.), квасе и некоторых алкогольных напитках. Полные перечни разрешенных для употребления больными целиакией продуктов обычно публикуются на официальных специальных сайтах обществ больных целиакией в каждой стране после проведения специального анализа продукта на содержание в нем скрытого глютена.
 Пациенты с целиакией требуют постоянной заботы со стороны членов их семей и общества в целом. Необходимо стремиться к насыщению рынка специальными диетическими продуктами для больных целиакией, изготовленными в соответствии со строгими нормами. При возможности следует отдавать предпочтение готовым продуктам, заменяющим общепринятые глютенсодержащие продукты питания (хлеб, макароны, кондитерские изделия и т.д.) и абсолютно безопасным при глютеновой энтеропатии [17].
Пациенты с целиакией требуют постоянной заботы со стороны членов их семей и общества в целом. Необходимо стремиться к насыщению рынка специальными диетическими продуктами для больных целиакией, изготовленными в соответствии со строгими нормами. При возможности следует отдавать предпочтение готовым продуктам, заменяющим общепринятые глютенсодержащие продукты питания (хлеб, макароны, кондитерские изделия и т.д.) и абсолютно безопасным при глютеновой энтеропатии [17].
Визит пациентки Ш. в апреле 2013 г.: жалоб не предъявляет, стул оформленный, 1–2 раза в сутки, прибавка в весе – 3 килограмма. Визит в августе 2013 г.: жалоб не предъявляет, стул регулярный, оформленный, 1–2 раза в сутки, прибавка в весе – 9 килограммов, соблюдает строгую аглютеновую и алактозную диету. Риск развития целиакии увеличивается в случаях семейного анамнеза (от 1 : 10 при первой степени родства), от 2,4 до 44,0 % при других аутоиммунных заболеваниях, таких как сахарный диабета 1 типа, тиреоидит, дефицит IgA, герпетиформный дерматит, аутоиммунные заболевания печени, миокарда, нервной системы и др. [18, 19].
Во время последнего визита пациентка Ш. показала анализы на антитела класса IgA к глиадину и трансглутаминазе дочерей 16 и 6 лет. У дочери 16 лет некоторое повышение показателей, у младшей данные результаты в норме, но она отказывается принимать молочные продукты, после которых у нее возникают дискомфорт в животе и диарея. Обеим назначены углубленные исследования по описанной выше схеме.
В соответствии с принципами Национального института здравоохранения и клинического мастерства в Великобритании [20] недиагностированная целиакия связана с массой долгосрочных осложнений, в т. ч. остеопорозом и некоторыми злокачественными новообразованиями.
Прогноз при глютеновой энтеропатии благоприятный при условии пожизненного соблюдения аглютеновой диеты. Больные должны находиться под диспансерным наблюдением гастроэнтеролога. Лечение целиакии считается эффективным, если в течение 1–2 лет безглютеновой диеты у больного исчезают клинические проявления заболевания (кишечные и внекишечные), нормализуются лабораторные показатели и концентрации серологических биомаркеров, восстанавливается структура слизистой оболочки тонкой кишки. Наступление полной клинико-лабораторной ремиссии делает пациента с диагнозом «целиакия» практически здоровым, снижается до общепопуляционных показателей риск осложнений, в первую очередь злокачественных новообразований, кровотечений; восстанавливаются функции вовлеченных в патологический процесс органов.



