Введение
Согласно современным рекомендациям среди больных с симптомами диспепсии, выделяют подгруппу с Helicobacter pylori-ассоциированной диспепсией [1, 2]. Однако после успешной антихеликобактерной терапии (АХБТ) стойкое исчезновение симптомов диспепсии отмечается только у части пациентов [3]. В настоящее время известно, что H. pylori является основным, но не единственным представителем микрофлоры желудка [4]. Наряду с H. pylori в желудке выявляются Firmicutes, Bacteroidetes, Actinobacteria [5]. В ряде исследований показано, что после эрадикации H. pylori у части больных происходит микробная колонизация желудка и тонкой кишки анаэробными бактериями, отмечается развитие синдрома избыточного бактериального роста (СИБР) [6, 7]. Мы предположили, что сохранение симптомов диспепсии у части пациентов после эрадикации инфекции H. pylori связано с СИБР.
Цель исследования: изучить возможность развития диспепсии, ассоциированной с синдромом избыточного бактериального роста (СИБР).
Методы
Методом сплошной выборки в исследование включены 40 пациентов с Н. pylori-ассоциированной диспепсией [1, 2] (34 женщины, 6 мужчин; средний возраст – 46,7±1,9 года). Всем больным проведена успешная стандартная тройная терапия, включающая ингибитор протонной помпы, кларитромицин 1 г в сутки и амоксициллин 2 г в сутки [2]. Эффективность эрадикации инфекции Н. pylori подтверждена отрицательным результатом анализа кала на антиген H. pylori через 5 недель после завершения АХБТ. У всех больных выявлен сопутствующий синдром раздраженного кишечника с запором (СРК-З), диагноз которого соответствовал III Римским критериям [8]. Следует отметить, что в клинической картине доминировали диспепсические жалобы, а симптоматика СРК-З была невыраженной.
До и через 5 недель после АХБТ у всех пациентов изучили частоту и выраженность симптомов диспепсии, качество жизни, результаты водородного дыхательного теста с нагрузкой лактулозой на аппаратном устройстве «Gastro+Gastrolyzer, Bedfont Scientific Ltd, Kent, UK», степень тяжести сопутствующего СРК. Для оценки выраженности эпигастральной боли и чувства переполнения в эпигастрии использовали визуально-аналоговую шкалу (ВАШ) длиной 100 мм, где деление «0» соответствовало отсутствию симптомов, «100» – максимальной выраженности симптома. Частоту симптомов диспепсии оценили по количеству дней с клиническими симптомами в неделю. Степень тяжести СРК определили с помощью опросника IBS-SS [9]. Оценку качества жизни выполнили с помощью опросника SF-36 («SF-36, Healt Status Survey») [10]. Провели расчет интегральных показателей психического и физического компонентов здоровья SF-36-профиля. Диагностическим критерием СИБР считали увеличение уровня водорода ≥12 ppm в течение 30–60 минут или его двухступенчатое повышение [11].
Статистическую обработку полученных данных выполнили с помощью пакета программ Microsoft Office 2010 (Excel) и Biostat-2000. Количественные переменные представлены в работе в виде среднего значения±стандартная ошибка среднего значения (Х±mx). Категориальные переменные показаны в процентах. Достоверность различий количественных переменных определена по критерию t-Стьюдента.
В случае повторных измерений использован парный критерий Стьюдента. Для непараметрических признаков применен двусторонний вариант точного критерия Фишера. Различия результатов считали статистически достоверными при уровне значимости p<0,05.
Результаты
Через 5 недель после завершения успешной эрадикации H. pylori и оценки симптомов диспепсии пациенты были разделены на 2 группы. В группу 1 включены 27 (67,5%) больных с достоверным уменьшением частоты и выраженности симптомов диспепсии (р<0,05), в группу 2 – 13 (32,5%) пациентов с сохраняющимися симптомами диспепсии (р>0,1; табл. 1).
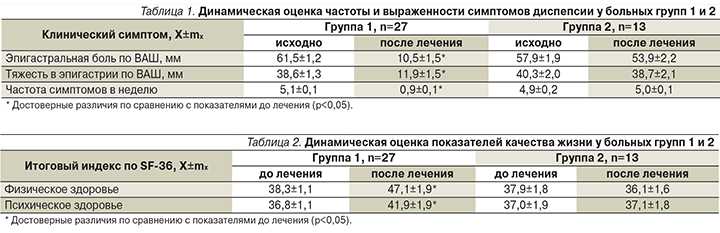
Уменьшение симптомов диспепсии у пациентов группы 1 сопровождалось статистически значимым повышением уровня качества жизни (табл. 2).
У всех больных выявлен сопутствующий СРК-З. Следует отметить, что симптомы диспепсии преобладали в клинической картине и стали причиной обращения к врачу, а симптоматика СРК-З была невыраженной. После завершения терапии ухудшения сопутствующего СРК-З ни в одном случае не отмечено. Более того, у пациентов 1-й группы в 81,5% случаев (n=22) наблюдалось достоверное уменьшение степени тяжести СРК-З по опроснику IBS-SS (табл. 3).

До начала терапии СИБР диагностирован у 35 (87,5%) включенных в исследование пациентов: 24 пациента группы 1 и 11 – группы 2. Через 5 недель после завершения АХБТ эрадикация СИБР отмечена у 22 (91,6%) из 24 пациентов в группе 1 и не наблюдалась у пациентов группы 2 (p<0,05, точный критерий Фишера). Более того, у двух пациентов группы 2 с исходным отсутствием СИБР отмечено его появление после эрадикации H. pylori.
Обсуждение
Симптомы диспепсии отмечаются у 20–25% населения [12, 13]. С этиологической точки зрения выделяют вторичную и функциональную диспепсию [14]. К первой группе относят диспепсию, развитие которой можно объяснить органическими, системными или метаболическими причинами [14].
О вторичной диспепсии говорят у пациентов с язвенной болезнью, НПВП-гастропатией, а также инфекцией H. pylori [14]. При обнаружении H. pylori устанавливают диагноз диспепсии, ассоциированной с данной инфекцией [14]. И только в случае сохранения или рецидива симптомов диспепсии после успешной АХБТ диагностируют функциональную диспепсию [14].
По результатам нашего исследования положительная клиническая динамика с достоверным уменьшением диспепсических жалоб отмечена у 67,5% больных через 5 недель после эрадикации H. pylori. Согласно современным рекомендациям, данная группа больных нуждается в динамическом наблюдении на протяжении 6–12 месяцев для окончательного установления диагноза и определения лечебной тактики [14]. Параллельно с эрадикацией инфекции H. pylori у данной группы больных в 91,6% случаев отмечена эрадикация СИБР, что, вероятно, оказало положительное влияние на течение сопутствующего СРК-З. По данным ранее проведенных исследований, одним из возможных патогенетических механизмов эффективности АХБТ при СРК-З является улучшение сенсорной функции прямой кишки вследствие устранения патогенной и условно-патогенной микрофлоры в толстой кишке антибактериальными препаратами, входящими в состав схемы АХБТ [15, 16].
У 32,5% больных не наблюдалось уменьшения диспепсических жалоб.
У всех пациентов данной группы через 5 недель после отмены АХБТ диагностирован СИБР. В настоящее время опубликованы исследования, свидетельствующие о том, что у части больных после эрадикации H. pylori отмечаются изменения состава микрофлоры пищеварительного тракта в виде уменьшения количества Firmicutes, Bacteroidetes, Verrucomicrobia, Lentispaerae и увеличения количества условно-патогенных анаэробных бактерий [6]. Установлено, что подобные изменения микрофлоры желудочно-кишечного тракта могут сохраняться от 18 месяцев до 4 лет после завершения лечения антибиотиками [17, 18]. Изменение состава микробиоты и ее разнообразия приводят к развитию воспалительных изменений в двенадцатиперстной кишке [13]. Персистенция воспаления в стенке двенадцатиперстной кишки способствует формированию стойких симптомов диспепсии [13]. Приведенные данные литературы и результаты собственного исследования демонстрируют возможность сохранения или развития симптомов диспепсии на фоне избыточного роста бактерий. По нашему мнению, вторичная диспепсия, ассоциированная с СИБР, реально существует, имеет определенное значение в клинической практике для терапевтов и гастроэнтерологов и требует дальнейшего изучения.
Заключение
Эрадикация инфекции H. pylori положительно влияет на клиническую симптоматику у 67,5% больных с симптомами диспепсии, сопровождаясь повышением качества жизни. СИБР служит одной из возможных причин сохранения симптомов диспепсии у 32,5% больных и может рассматриваться как новая потенциальная цель лечения.


