Проблема остеопороза (ОП), как первичного, так и вторичного, на сегодняшний день привлекает внимание многих клиницистов, поскольку, согласно данным Всемирной организации здравоохранения (ВОЗ), ОП входит в четверку заболеваний, лидирующих по смертности и инвалидизации населения, наравне с сердечно-сосудистыми заболеваниями,сахарным диабетом и онкологическими заболеваниями [1]. Важно подчеркнуть, что ОП протекает бессимптомно до тех пор, пока не случится низкоэнергетический перелом, т. е. возникающий без значительной травмы.
ОП – самое распространенное заболевание костной ткани: остеопоротические переломы отмечаются у половины всех женщин, находящихся в периоде постменопаузы, а также у мужчин старших возрастных групп. Пациенты, перенесшие один остеопоротический перелом, имеют высокий риск повторных переломов, следовательно, наиболее важной целью лечения ОП является предотвращение переломов.
Поскольку ОП протекает без характерной клинической картины вплоть до возникновения перелома, важным направлением в его изучении является выявление новых факторов риска развития ОП и переломов. Расширение таких знаний с позиций доказательной медицины дает возможность своевременно принимать меры по профилактике или лечению ОП, обеспечивающие эффективное снижение риска остеопоротических переломов у пациентов в различных клинических ситуациях. Наиболее часто встречающиеся в современной практической медицине состояния, способствующие
быстрому развитию ОП и повышению риска переломов шейки бедра, – это менопауза, прием глюкокортикостероидов (ГКС), постинсультный период, сахарный диабет и ожирение [2–5].
Патогенез ОП
ОП – системное заболевание скелета, для которого характерны снижение минеральной плотности и ухудшение качества кости, следствием чего является ее хрупкость и повышение риска переломов. Чаще всего клиническая картина ОП включает триаду: боли в спине, переломы без значительных
травм – низкоэнергетические (обычно позвоночника, бедра, дистального отдела лучевой кости и проксимального отдела плечевой кости) и низкую минеральную плотность костной ткани (МПК). Генетические факторы изменения костной массы составляют до 60–80 %, несмотря на тот факт, что МПК у взрослых отражает степень приобретения ее в процессе роста (т. е. пик костной массы) [6].
Максимальный прирост МПК происходит в возрасте от 12 до 20 лет, когда максимально проявляются генетические особенности, гормональные эффекты, влияние окружающей среды, взаимодействие которых приводит к повышению линейного роста и стимулированию формирования основной костной массы. Любое расстройство, изменяющее или нарушающее формирование кости, повышает резорбцию кости или изменяет последовательность гормональных влияний в течение этого периода (например, нервная анорексия, дефицит гормона роста, задержка полового созревания, аменорея), приводит к снижению пика костной массы и предположительно – к более высокому риску ОП.
Следует также отметить, что костная ткань – это динамичная ткань с постоянно протекающими процессами формирования и резорбции, т. е. всю жизнь костная ткань обновляется. Около 10 %
костной ткани замещается ежегодно. Известно, что скелет на 80 % состоит из компактной костной ткани и на 20 % из губчатой. Метаболические процессы в этих тканях протекают с различной скоростью. Скорость обменных процессов в губчатых костях в 4–9 раз выше, чем в кортикальных. Позвоночник, диафизы и эпифизы трубчатых костей, пяточная кость и нижняя челюсть содер-
жат массу трабекулярной (губчатой) костной ткани. Ремоделирование компактного и губчатого вещества кости рассматривается с позиции функционирования базисных многоклеточных единиц (Basic Multicellular Unit) или костных ремоделирующих блоков (Bone Remodeling Unit). Блок костно-
го ремоделирования формируется в локусе перестройки костной ткани и представляет собой группу согласованно функционирующих клеток, которые называют также “преобразующими блоками”, состав которых создают остеокласты, остеобласты, активные мезенхимальные клетки и микрососуды. Остеокласты происходят из гемопоэтических предшественников в костном мозге, а остеобласты образуются в результате дифференциации мезенхимальных стволовых клеток (МСК) [7]. Согласование дифференциации этих двух клеточных линий во время активного ремоделирования костной ткани отчасти обеспечивается МСК, которые являются источником ряда цитокинов, влияющих на этот процесс.
Существует тонкий баланс между резорбцией и формированием костной ткани, поэтому любое вмешательство в этот процесс может приводить к снижению костной массы, изменению костной архитектуры и как следствие – к переломам. Сроки этих изменений являются критическими для определения их окончательного воздействия на костный статус. Но к пятому десятилетию жизни процесс снижения МПК неумолимо начинается у мужчин и женщин, когда процессы костной резорбции опережают формирование костной ткани [8]. У женщин после менопаузы потеря костной массы повышается до 1,5 % ежегодно. Таким образом, состояния, ускоряющие активацию остеокластов, такие как мено-, андропауза, гипогонадизм, терапия ГКС, сахарный диабет и иммобилизация, могут способствовать дальнейшему повышению риска переломов. Кроме того, снижение функции остеобластов в конце жизни дополнительно увеличивает разрыв между процессами костного формирования и резорбции [9].
Клинические проявления ОП
Снижение МПК является главным фактором риска переломов, так же как повышенное артериальное давление – значимым риском инсульта [6]. В случае нормального развития максимальная МПК у здорового человека достигается в возрасте 25–30 лет. Далее МПК остается постоянной или постепенно снижается с максимальной скоростью – на 0,5 % ежегодно [8]. К пятому десятилетию жизни процесс потери МПК у мужчин и женщин ускоряется, т. к. процессы костной резорбции начинают опережать формирование костной ткани.
Как известно, ОП – это “безмолвная болезнь” и развивается асимптомно до тех пор, пока не появляются переломы. Частота переломов позвонков повышается вскоре после менопаузы и продолжает нарастать с возрастом. Если диагностика переломов предплечья, шейки бедра или почти всех других участков периферического скелета затруднений не вызывает, то переломы позвонков, вызванные ОП, зачастую не диагностируются, а следовательно, и не лечатся.
Ведущим клиническим проявлением ОП позвоночника является боль, вызванная компрессией позвонка или повторяющимися микропереломами. В нашей стране наиболее частым диагнозом при боли в спине является “остеохондроз позвоночника”. Однако диагностика ОП имеет принципиальное значение для прогноза пациента, поскольку его лечение существенно отличается от того, что рекомендуется
при остеохондрозе.
В отличие от остеопоротических переломов других локализаций большинство переломов позвоночника происходит не при падении, а в результате компрессионной нагрузки, возникающей при подъеме груза, изменении положения тела, и выявляются случайно. Микропереломы могут происходить
и при обычной ежедневной активности. Интересно, что переломы позвонков, возникающие в первые 15–20 лет после менопаузы, часто представляют собой компрессию высокой степени или коллапс с сильными болями, в то время как после 75 лет переломы происходят постепенно и не всегда сопровождаются болью. При этом в процесс может быть вовлечено несколько позвонков. Этот вариант течения ОП позвоночника проявляется снижением роста и деформацией спины.
Компрессия позвонка обычно развивается остро при подъеме тяжести, кашле, чихании либо тряской езде. У пациента внезапно развивается острая боль в спине, имеющая опоясывающий характер и усиливающаяся при движении. Наиболее частая локализация боли – нижнегрудной и верхнепоясничный отделы позвоночника. Боль при компрессионном переломе позвонка обычно продолжается 2–4 недели и постепенно проходит. При микропереломах хрупкие тела позвонков оседают и постепенно деформируются под действием собственной тяжести. Характерна постоянная боль в спине, усиливающаяся при перемене положения тела (особенно при переходе из горизонтального положения в вертикальное и наоборот), кашле, чихании, натуживании.
Обычно первые деформации и переломы при ОП развиваются в X–XII грудных и I–II поясничных позвонках. Это связано с тем, что на стыке грудного и поясничного отделов ход позвоночника имеет угол. Сила тяжести, направленная в вертикальном направлении, в первую очередь именно в этом отделе способствует “сминанию” тел позвонков, часто приводя к клиновидным деформациям. Со временем, если костная ткань позвонков не укрепляется, а условия, способствующие деформации, сохраняются, переломы продолжаются. При этом, как правило, добавляются переломы вышележащих
позвонков, однако шейный и верхнегрудной отделы позвоночника вовлекаются крайне редко.
При объективном исследовании у пациента с множественными переломами позвонков отмечается снижение роста. Обычно сравнение проводится с ростом в молодом и зрелом возрасте. С переломом каждого позвонка рост уменьшается на 1–3 см, и в целом пациент может потерять до 9–15 см. В результате деформаций позвонков формируется выраженный грудной кифоз (“вдовий горб”), который
компенсируется поясничным лордозом. Также наблюдается укорочение торса, из-за чего пожилой человек с множественными переломами позвонков выглядит длинноруким. В случае выраженного ОП с компрессионными переломами, значительным кифозом и снижением роста расстояние между нижними ребрами и тазом существенно уменьшается и ребра соприкасаются с тазовыми костями. Это может приводить к болям в боковой области или синдрому илеокостального трения.
Если перелом был недавно, может отмечаться локальная болезненность тела позвонка. Очень важным признаком ОП позвоночника, позволяющим отличать его от других заболеваний, является отсутствие симптомов выпадения (двигательных и чувствительных нарушений). Если они регистрируются у пациента с болью в спине и компрессией позвонка, нужно исключить опухоль, метастазы, туберкулез, остеомиелит и др.
Клинически манифестный ОП позвоночника снижает продолжительность и качество жизни. Хотя в отличие от перелома бедра увеличения числа смертельных исходов в течение первого года после перелома позвонка не происходит, показатели выживаемости снижаются позже, возможно, из-за
присоединения сопутствующих заболеваний. Хронические боли в спине стойко изменяют образ жизни больного. Пытаясь ограничить боль, пациенты снижают двигательную активность, у них развиваются психологические изменения, депрессия, они часто нуждаются в социальной поддержке.
Инструментальные методы диагностики ОП позвоночника
Традиционно в течение многих лет для диагностики ОП использовалась рентгенография. Однако следует иметь в виду, что рентгенологический диагноз ОП возможен только при потере костной массы на 20–30 % от пиковой. Таким образом, диагностика ОП с помощью рентгенологического метода нецелесообразна, поскольку может производиться только в поздние сроки заболевания. Вместе с тем рентгенография незаменима при диагностике переломов, в т. ч. деформаций позвонков. Для выявления последних используется метод рентгеноморфометрии позвоночника, когда измеряются высоты тел позвонков (передняя, средняя и задняя) и сравниваются друг с другом, а также с высотами выше- и нижележащих позвонков. Этот метод позволяет выявлять клиновидные, двояковогнутые (по типу рыбьих позвонков) и компрессионные деформации, характерные для ОП.
Показаниями к рентгенографии позвоночника являются снижениероста и боли в спине при наличии следующих факторов риска ОП:
• предшествующие переломы;
• возраст старше 65 лет;
• низкая МПК;
• женский пол;
• индекс массы тела < 20 кг/м2 и/или вес < 57 кг;
• склонность к падениям;
• наследственность (семейный анамнез ОП);
• системное применение ГКС более трех месяцев;
• гипогонадизм у мужчин и женщин;
• курение;
• недостаточное потребление кальция;
• дефицит витамина D;
• злоупотребление алкоголем.
Необходимо помнить, что существенным фактором риска ОП позвоночника является применение ГКС,
поэтому указание на использование этих препаратов должно нацеливать врача на диагностику и профилактику указанной патологии.
Поскольку прочность кости главным образом зависит от МПК, определение последней считается наиболее объективным методом оценки риска переломов. Согласно рекомендациям ВОЗ, показатели костной массы лежат в основе диагноза ОП и бывают особенно полезными на ранних стадиях
заболевания, когда переломов еще нет и принятие решения о тактике ведения пациента основывается на значениях МПК и факторах риска развития ОП. Для оценки МПК в настоящее время наиболее широко применяется рентгеновская и ультразвуковая денситометрия. “Золотым” стандартом денситометрии является двуэнергетическая рентгеновская абсорбциометрия (DEXA). Денситометрия поясничного отдела позвоночника и проксимального отдела бедренной кости относится
к стандартным методам исследования на аппаратах данного типа. При исследовании позвоночника с помощью DEXA анализируются первые четыре поясничных позвонка. Денситометрия грудного отдела позвоночника не проводится, поскольку грудина и ребра являются помехой для измерения МПК
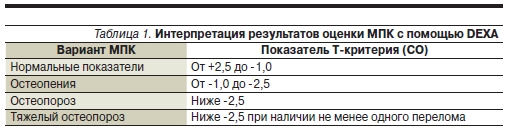
грудных позвонков. Числовым выражением диагноза остеопороза является Т-критерий – количество стандартных отклонений (СО) от показателей МПК молодых здоровых лиц (20–39 лет). Колебания Т-критерия в диапазоне 1 СО относятся к норме. При снижении МПК до уровня между -1 и -2,5 СО
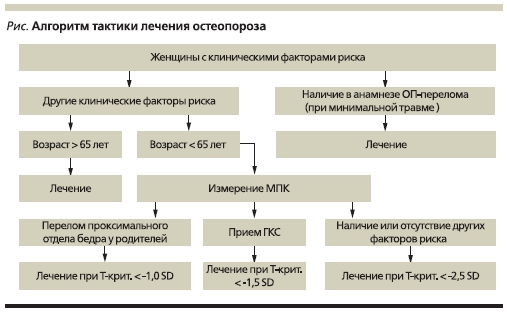
диагностируется остеопения (состояние предостеопороза). Если снижение МПК превышает -2,5 СО от пиковых значений (Т-критерий < -2,5 СО), показатели соответствуют ОП (табл. 1) Для стероидного ОП показатели денситометрии, при которых диагностируется ОП, выше: не -2,5, а -1,5 СО (см. рисунок).
При постановке диагноза ОП на основании денситометрического исследования важно иметь в виду, что различные участки скелета неоднородны по МПК, а риск перелома определенной локализации можно прогнозировать только при исследовании данного отдела скелета. Так, поставить диагноз ОП позвоночника, а следовательно, определить риск переломов позвонков можно только на основании
денситометрии именно этого участка костной системы.
Поскольку денситометрическое исследование пока не общедоступно, а часть больных не могут его себе позволить из-за высокой стоимости, не следует отказываться от лечения, если денситометрию провести не удалось. Лечение ОП можно и нужно начать без предварительного инструментального подтверждения, эти показания внесены в современный алгоритм лечения таких больных (см. рисунок),
главными поводами немедленно начать терапию являются:
• перенесенный ранее перелом при низком уровне травмы либо перелом позвонка в отсутствие явной травмы, особенно в возрасте старше 50 лет;
• пациенту предполагается назначить преднизолон (или любой другой ГКС) или он уже получает данную терапию;
• наличие факторов риска переломов, включая возраст старше 65 лет.
Лечение и профилактика ОП
Что же можно назначить пациенту с целью лечения и профилактики ОП?
Известно, что препараты лечения ОП разделены соответственно механизмам их действия: с преимущественным антирезорбтивным эффектом (препятствующие быстрой потере МПК) и стимулирующие рост костной ткани. К антирезорбтивным препаратам относят эстрогены, селективные модуляторы эстрогеновых рецепторов, кальцитонин и бисфосфонаты, основной механизм действия которых – снижение активности остеокластов.
Ко второму анаболическому типу относят препараты паратиреоидного гормона, витамин D и стронция ранелат, которые проявляют свой эффект, усиливая дифференцировку и увеличивая выживаемость остеобластов [10].
Умеренный дефицит витамина D также является причиной переломов шейки бедра у мужчин и женщин в возрасте 70 лет [11]. В пожилом возрасте ухудшается усвоение людьми кальция и наблюдается снижение уровня витамина D3 в сыворотке, а поскольку витамин D необходим для адекватной абсорбции кальция в кишечнике и нормального костного метаболизма, его хронический дефицит вызывает вторичный гиперпаратиреоз, а как следствие – активацию костного метаболизма и быструю потерю костной массы. Поэтому, согласно клиническим рекомендациям, пациенты старше 65 лет должны получать минимум 400 МЕ витамина D3 в день, а в случаях возможного развития дефицита
витамина D (пациенты, ведущие малоподвижный образ жизни или не выходящие из дому) или при его лабораторном подтверждении рекомендуемая для приема доза витамина D3 – 800 МЕ в день [12].
Недавно опубликованный метаанализ продемонстрировал, что добавление витамина D3 в дозах 400 МЕ в день и выше уменьшает риск переломов на 26 % [13]. Эти исследования подтверждают важность приема витамина D3 как ключевого элемента лечения и профилактики ОП, а также в качестве эффективного дополнения к препаратам антирезорбтивного ряда, особенно алендронату, что максимально оптимизирует остеобластогенез и одновременно минимизирует адипогенез (табл. 2).
Таблица 2. Эффекты современных антиостеопорозных средств.
Таким образом, современные цели лечения и профилактики ОП у пожилых людей должны включать формирование высококачественной новой костной ткани (т. е. увеличение толщины трабекулярной и более низкой пористости кортикальной ткани), что уменьшает риск перелома. С точки зрения нормальной физиологии костной ткани этот эффект достигается только в том случае, если остеобласты в состоянии нормально функционировать, именно поэтому необходимо в первую
очередь снижать обусловленную старением активность остеокластов.
Выбор оптимального препарата для лечения или профилактики ОП должен проводиться с учетом особенностей каждого пациента при полном понимании клеточных механизмов, вовлеченных в процесс развития ОП в той или иной клинической ситуации, чтобы обеспечить влияние на большинство из них для достижения эффективного лечения (табл. 2). Хотя действие большинства имеющихся в распоряжении врача препаратов обусловлено либо регулированием резорбции костной ткани, либо стимулирующим анаболическим эффектом, современные исследования уже положили начало развитию нового направления в лечении и профилактике ОП, сочетающего комбинацию двух агентов, обладающих взаимопотенцирующим действием. Такой препарат, сочетающий мощный антирезорбтивный и анаболический аспекты терапии и профилактики ОП, сегодня представлен в единственном числе – это Фосаванс, содержащий оригинальный алендронат в дозе 70 мг и 2800 МЕ витамина D3 с кратностью лечебного приема 1 раз в неделю, профилактического – 1 раз в 2 недели.
На сегодняшний день накоплено множество клинических данных, свидетельствующих об эффективности Фосаванса для лечения и профилактики ОП. Проведенные 3–5-летние рандомизированные исследования продемонстрировали эффективность назначения оригинального алендроната (Фосаванса) для лечения ОП. Наиболее крупные из них – это FOSIT – многоцентровое (34 страны) рандомизированное двойное слепое плацебо-контролируемое исследование, включившее 1908 постменопаузальных женщин с ОП, получавших ежедневно в течение 12 месяцев оригинальный алендронат [14], и FIT – многоцентровое (11 центров США)
рандомизированное двойное слепое плацебо-контролируемое исследование с участием 2027 постменопаузальных женщин, получавших оригинальный алендронат в течение 3 лет [15], а также длительное 10-летнее наблюдение пациенток, продолжавших получать ежедневно оригинальный
алендронат либо плацебо [16]. Прием оригинального алендроната повышал МПК во всех областях измерения от 5,4 до 13,7 %, достоверно снижал риск переломов разной локализации на 50 % (позвонков – на 47 %, бедра – на 51–56 % и предплечья – на 48 %), а среди лиц, имевших переломы позвонков в анамнезе, в 64 % случаев уменьшалось прогрессирование их деформаций. Эффективность лечения не зависела от возраста, начальной МПК и числа предшествовавших переломов. Исследования, проведенные в России, также подтвердили эффективность применения оригинального алендроната [17–19].
Лечение Фосавансом представляется сегодня действительно эффективным, т. к. оно способствует улучшению количественного и качественного состава костной ткани, ее обновлению, снижению количества накопленных микроповреждений и предотвращает быстрое развитие ожирения
костного мозга в условиях иммобилизации. Фосаванс по праву является препаратом первого выбора терапии и профилактики не только постменопаузального ОП, глюкокортикоидного ОП и ОП у мужчин, но и ОП в постинсультном периоде.
Дополнительный важный аспект – приверженность больных терапии, что значимо влияет на ее клиническую эффективность. Это особенно актуально для пациентов пожилого возраста, имеющих спектр соматических заболеваний и ежедневно получающих терапию более чем пятью препаратами. В таких условиях соблюдать ежедневное правило по дополнительному приему витаминных добавок не всегда удается, поэтому единственный в своем классе комбинированный оригинальный препарат Фосаванс, содержащий недельную дозу витамина D, с успехом решает подобные затруднения.


