Коморбидность является одной из наиболее значимых клинических проблем в практике врачей всех специальностей, поскольку требует от курирующего врача междисциплинарной подготовки и ориентировки в вопросах диагностики и ведения пациентов с сочетанной патологией.
В понимании сущности коморбидности и ее дефиниции нет единого подхода. Одни авторы понимают под коморбидностью сочетание у больного двух или более заболеваний, патогенетически связанных между собой. По мнению других, коморбидность представляет собой клиническую ситуацию, характеризующуюся наличием у больного двух или более заболеваний, различных по этиологии, патогенезу, подходам к лечению. Следует отметить, что по мере прогресса в понимании механизмов развития и течения многих заболеваний появляется все больше и больше фактов о патогенетической
связи между различными, как казалось ранее, не связанными между собой по своей сущности патологическими процессами, формирующими многообразные клинико-лабораторные синдромы. К таким клинико-лабораторным синдромам относится анемия, в основе развития которой могут лежать различные патогенетические механизмы (дефицит гемопоэтических факторов, гемолиз, костномозговая недостаточность и др.) при самых разнообразных патологических процессах (острые и
хронические кровопотери, гемобластозы, заболевания почек, опухолевые поражения желудочно-кишечного тракта [ЖКТ] и др.).
Анемия является одной из коморбидностей у кардиологических больных и ставит перед врачом ряд дополнительных проблем при ведении пациентов с сердечно-сосудистыми заболеваниями. Решение этих проблем сводится главным образом к своевременному выявлению анемии, определению патогенетического варианта и причины его развития, оценке “клинического вклада” анемии в течение заболевания, назначению адекватных методов коррекции анемии с учетом конкретной клинической ситуации.
1. Клинические ситуации у кардиологических больных с наличием анемии
1.1. Ишемическая болезнь сердца (стенокардия, инфаркт миокарда, острый коронарный синдром)
Рядом исследований установлено, что у больных ишемической болезнью сердца (ИБС) имеется связь между уровнем гемоглобина (Hb), другими показателями эритрона, с одной стороны, и течением заболевания, его прогнозом, летальностью, с другой. Выявлена взаимосвязь анемии с
частотой госпитализаций по поводу сердечно-сосудистой патологии [1, 2]. У больных с многососудистым поражением коронарных артерий отмечены наиболее низкие показатели Hb, гематокрита (Ht) и эритроцитов, средней концентрации Hb в эритроците, сывороточного железа (Fe), трансферрина и общей железосвязывающей способности сыворотки [3, 4].
Показано, что уровень Hb является независимым фактором летальности в течение 24 месяцев после острого инфаркта миокарда (ОИМ); в частности, при уровне Hb ниже 130 г/л число выживших было значительно меньше по сравнению с пациентами, у которых этот показатель был выше [5]. В группе
больных ОИМ (n = 1841) низкий уровень Hb (ниже 100 г/л) был независимым предиктором смертельного исхода за 30 дней (отношение шансов [ОШ] = 1,76, 95 % доверительный интервал [ДИ] – 1,08–2,85; р = 0,02), причем смертность в группе больных ОИМ с анемией была достоверно выше (21,6 против 9,3 %; р < 0,001) [6].
Ретроспективный анализ течения ИБС у 78 984 пациентов в возрасте ≥ 65 лет показал выраженную обратную взаимосвязь смертности и уровня Ht в первые 30 дней стационарного лечения ОИМ. Пациенты с уровнем Ht > 39 % имели летальность в первые 30 дней в 17,2 % случаев, с исходным Ht от
30,1 до 33 % – 30,0 %, а при Ht < 30 % летальность отмечена в 36,0 % случаев. Кроме того, исследователи обратили внимание на достаточно высокий процент больных ИБС с наличием анемии.
Так, при Ht < 39 % у пациентов с ИБС в 43,4 % случаев была выявлена анемия [7].
В ряде исследований была показана неблагоприятная роль анемии для различных категорий больных
острым коронарным синдромом (ОКС) [8–10]. У больных ОКС, включенных в регистр РЕКОРД, наличие
анемии (уровень Hb < 110 г/л) являлось независимым предиктором смерти за время госпитализации (ОШ = 4,6, 95 % ДИ – 1,9–11,2; р = 0,001) [11].
Проведенный скрининг 2473 больных ИБС [12] показал, что у 1595 (64,5 %) пациентов выявлено снижение уровня Hb и числа эритроцитов, причем в половине случаев показатели Hb не превышали 90 г/л. При этом у большинства (92,9 %) пациентов имела место гипохромная анемия, у 6,2 % – гиперхромная и у 0,9 % – нормохромная анемия. Обращает на себя внимание, что у 39,5 % больных, по данным исследователей, имелись анамнестические сведения о кровотечениях. Из всех пациентов с
верифицированной постгеморрагической анемией у 147 (25,1 %) больных в течение последнего месяца имело место клинически значимое кровотечение, преимущественно желудочнокишечное (82,3 %). С учетом гипохромного характера анемии у большинства пациентов есть основания считать, что
главным патогенетическим вариантом анемии для больных ИБС была железодефицитная анемия (ЖДА).
Очевидно, что наличие анемии у больных ИБС усугубляет гипоксию миокарда, что может проявляться клинической манифестацией заболевания (приступы стенокардии, нарушения ритма сердца, сердечная недостаточность) при меньшей степени стенозирования коронарных артерий по сравнению с пациентами с нормальными показателями Hb. Так, среди 417 пожилых больных ИБС с наличием анемии отмечены более выраженная тяжесть заболевания (80 и 46 % соответственно), бóльшая частота развития сердечной недостаточности (32 и 18 %) и нарушений ритма (41 и 16 %), а также более высокая летальность (13 и 4 %) по сравнению с пациентами с нормальным уровнем Hb [13].
Наряду с негативным прогностическим значением низкого уровня Hb у больных ИБС наличие анемии ограничивает применение антикоагулянтов и антиагрегантов, а также задерживает принятие решения о проведении инвазивных методов лечения (ангиопластика, аортокоронарное шунтирование – АКШ) данной категории пациентов. Кроме того, больные с низким уровнем Hb (особенно в России)
мало изучены, поскольку они остаются вне рандомизированных исследований [11].
А.М. Шилов и А.О. Осия [14] приводят возможные причины развития анемии при ИБС, которые сводятся к следующим причинам:
• ишемическое повреждение костного мозга;
• снижение синтеза эритропоэтина (ЭПО) в почках;
• нарушение захвата ЭПО костным мозгом;
• снижение высвобождения Fe из клеток макрофагальной системы;
• токсическое действие цитокина фактора некроза опухоли α (ФНО-α);
• микрокровотечения вследствие длительного приема препаратов ацетилсалициловой кислоты;
• подавление синтеза ЭПО при длительном приеме ингибиторов ангиотензинпревращающего фермента (ИАПФ).
Как показывает клиническая практика, дефицит Fe и анемии легкой степени у больных ИБС не часто верифицируются и не всегда выносятся в окончательный диагноз. Внимание врачей привлекает, как правило, лишь значительное снижение показателей Hb. При этом не в полном объеме выполняются необходимые лабораторные исследования для исключения или подтверждения столь частого синдрома, как ЖДА (показатели сывороточного Fe, общая и латентная железосвязывающая способность сыворотки крови, трансферрин, ферритин). В связи с этим уделяется недостаточно
внимания на связь между клиническими проявлениями ИБС при железодефицитных состояниях легкой степени и не проводится соответствующая коррекция этих состояний [15]. Эти данные свидетельствуют о важности своевременного выявления и коррекции анемии у пациентов с различными формами ИБС.
1.2. Хроническая сердечная недостаточность
В настоящее время хроническая сердечная недостаточность (ХСН) уже не является исключительно “кардиологической” проблемой и приобретает ряд междисциплинарных аспектов для специалистов различных областей клинической медицины. Все большее внимание исследователей привлекает сочетание ХСН и анемии, которая зачастую лечится неадекватно или не корригируется вообще, а порой даже не выносится в клинический диагноз. Распространенность анемии среди пациентов c ХСН, по разным данным, составляет от 10 до 50 %. Такой большой разброс показателей можно объяснить отсутствием единого подхода к диагностике анемий, различиями в возрастном и половом составах пациентов [16], наличием сопутствующей патологии, в частности хронической почечной недостаточности и артериальной гипертензии, степенью тяжести ХСН [17].
Причины и патогенетические механизмы анемии при ХСН неоднозначны. Крупное канадское исследование [18], посвященное эпидемиологии анемии при ХСН и охватившее 12 065 пациентов, показало, что в 58 % случаев имела место ЖДА, в 27 % выявлена В12-дефицитная анемия, в 8 % — фолиеводефицитная, а у 7 % больных — анемия хронических заболеваний (АХЗ). Еще больший удельный вес в структуре всех анемий при ХСН составила ЖДА в другом исследовании [19], по
данным которого ЖДА диагностировалась в 73 % случаев, АХЗ – в 18,9 %, 5,7 % пациентов страдали гемодилюцией, а в 2,4 % анемия трактовалась как следствие приема лекарственных средств. По мнению исследователей, ЖДА у больных ХСН может развиваться из-за синдрома мальабсорбции
и скрытых желудочно-кишечных кровотечений, вызванных приемом ацетилсалициловой кислоты. Согласно данным J.N. Nanas и соавт., снижение запаса Fe в костном мозге обнаруживается среди 73 % пациентов. При этом уровень сывороточного Fe, ферритина и ЭПО в сыворотке оставался в пределах нормы, а средний объем эритроцита (MCV) соответствовал нижней границе нормы, что не укладывалось в микроцитарный характер анемии [19]. Эти данные свидетельствуют скорее о
возможном “перераспределении” Fe при ХСН из костного мозга в другие макрофагальные депо, где оно оказывается недоступным для эритропоэза даже при нормальном уровне сывороточного Fe и ферритина, как это происходит при АХЗ [20]. Таким образом, абсолютный или относительный
дефицит Fe довольно часто встречается среди пациентов с ХСН и приводит к развитию анемического синдрома.
Дефицит витамина В12 и фолиевой кислоты у пациентов с ХСН встречается довольно редко [21].
Больные ХСН нередко страдают дисфункцией почек с нарушением продукции ЭПО. Основным сигналом
повышения выработки ЭПО служит снижение парциального давления кислорода. Как известно, почка весьма чувствительна к гипоксии, несмотря на то что получает около 25 % от сердечного выброса и использует менее 10 % полученного кислорода. Согласно данным ряда авторов, уровень эндогенного ЭПО в крови пациентов с ХСН достоверно выше, чем у здоровых людей, причем, чем тяжелее степень ХСН, тем выше концентрация ЭПО [22]. В то же время у больных ХСН с наличием анемии чаще встречается низкая концентрация ЭПО. По-видимому, усиление выработки этого гормона почками в ответ на снижение перфузии при застойной ХСН непродолжительно. При снижении фракции выброса на фоне ХСН происходит уменьшение почечного кровотока, что в конечном итоге приводит к почечной дисфункции, которая обусловливает снижение выработки ЭПО с последующим развитием анемии [23].
Среди обследованных нами 100 больных ХСН с наличием анемии у 75 % диагностирована ЖДА, у 6,2 % –В12-дефицитная анемия, а у 18,8 % больных ХСН была выявлена анемия легкой степени, не связанная с дефицитом Fe или витамина В12. При этом скорость клубочковой фильтрации у этой группы пациентов составила 46,1 ± 6,4 против 68,6 ± 8,3 мл/мин/1,73 м² у пациентов с ХСН без анемии р < 0,05), что дает основание предполагать патогенетическую связь анемии с почечной дисфункцией на фоне тяжелой ХСН у данной категории пациентов [24].
Анемия при ХСН может развиваться из-за нарушений в ренинангиотензиновой системе, а также
вследствие приема ИАПФ. Ренинангиотензиновая система играет важную роль в регуляции объема плазмы и числа эритроцитов. Увеличение концентрации ангиотензина II (А-II) в плазме приводит к изменению перитубулярного парциального давления кислорода [25]. Снижение парциального
давления кислорода в перитубулярных фибробластах коркового вещества способствует повышению концентрации активных форм кислорода внутри клетки, которые активируют фактор гипоксии HIF-1 (hypoxia-inducible factor 1), увеличивая экспрессию гена ЭПО [26], т. е. А-II увеличивает секрецию ЭПО
за счет эффектов снижения почечного кровотока и усиления реабсорбции в проксимальных канальцах. Имеются данные о том, что А-II оказывает прямое стимулирующее воздействие на эритроидный росток костного мозга [27].
При развитии ХСН отмечено нарастание концентрации ФНО-α, интерлейкина-6 (ИЛ-6) и других провоспалительных цитокинов [28], а также С-реактивного белка [29], что может приводить к уменьшению концентрации Hb [30]. Показано, что ИЛ-6 и ФНО-α ингибируют синтез ЭПО в почках путем активации гена GATA II и нуклеарного фактора В [31]. Это объясняет, почему у пациентов с ХСН
снижается выработка эндогенного ЭПО после кратковременной стимуляции его синтеза. Кроме того, интерлейкины способны напрямую ингибировать эритроидный росток костного мозга [32], усугубляя анемию, хотя механизмы их действия остаются невыясненными. Еще один механизм развития анемии в условиях высокой концентрации ИЛ-6 – увеличение синтеза гепсидина печенью, который в свою очередь уменьшает всасывание Fe в кишечнике. Кроме того, ИЛ-6 ингибирует экспрессию белка ферропортина на мембране клеток-депо Fe (энтероцитов, гепатоцитов, макрофагов). Снижение количества этого белка, отвечающего за транспорт Fe из клетки наружу, приводит к нарушению высвобождения Fe из депо [33]. Аналогичный механизм развития анемии наблюдается у онкологических пациентов [34]. Таким образом, активация провоспалительных цитокинов – основной механизм АХЗ – во многом обусловливает развитие анемии у пациентов с ХСН. На рис. 1 представлены основные патогенетические механизмы анемии у больных ХСН.
Рисунок 1. Механизмы развития анемии при ХСН (I. S. Anand, 2008 с изменениями).
Негативное влияние анемии на прогноз больных ХСН у большинства исследователей не вызывает
сомнений и подтверждается клиническими наблюдениями. По данным Фрамингемского исследования, анемия сама по себе расценена независимым фактором риска для ХСН [35]. У пациентов с тяжелой ХСН снижение содержания Hb оказалось независимым предиктором смертности (относительный риск = 1,131, 95 % ДИ –1,045–1,224 для снижения уровня Hb на 1 г/дл) [36]. В исследовании Tang и соавт. пациенты ХСН с анемией имели 3-летний прогноз, значительно хуже, чем лица с нормальным уровнем
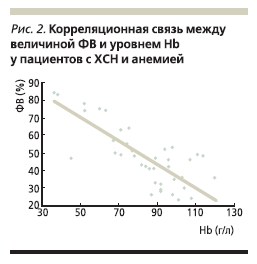
Hb: общая смертность составила 47 и 26 % соответственно (р < 0,0001). При дальнейшем мониторинге общая смертность за 3 года составила 58 % при персистирующей анемии и 45 % при вновь выявленной анемии против 31 % в отсутствие анемии [37]. Существуют данные о более частых повторных госпитализациях больных ХСН с наличием анемии по сравнению с пациентами, имеющими нормальные показатели Hb [38]. Анализ исследования SOLVD (Studies оf Left Ventricular Dysfunction) показал, что при снижении на каждый 1 % уровня Ht до рандомизации риск смерти среди больных ХСН возрастает на 6 % [39]. По-видимому, неблагоприятное влияние анемии на прогноз пациентов с ХСН обусловлено ремоделированием миокарда левого желудочка (ЛЖ) в условиях нейрогуморальной активации [40], перегрузки объемом и дополнительной гипоксии. В исследовании RENAISSANCE (Randomized Etanercept North American Strategy to Study Antagonism of Cytokines) было показано, что увеличение уровня Нb на 10 г/л в течение 24 недель у больных ХСН сопровождается снижением массы миокарда ЛЖ на 4,1 г/м² [41]. По-видимому, наличие анемии может приводить к развитию гипертрофии миокарда, что подтверждается данными Е.В. Гончаровой и соавт. [42]. Исследователи показали, что у больных ЖДА в 89,3 % случаев развивается кардиомиопатия, характеризующаяся на поздних стадиях заболевания глобальной диастолической дисфункцией обоих желудочков и развитием гипертрофии миокарда ЛЖ, в основном за счет межжелудочковой перегородки. Не исключено, что развивающаяся гипертрофия миокарда на фоне анемии носит транзиторный характер и при нормализации уровня Hb может подвергаться обратному развитию. В проведенном нами исследовании [43] было показано, что у большинства пациентов ХСН с наличием тяжелой анемии (91 %) происходит инотропная стимуляция миокарда с развитием гиперкинетического типа кровообращения, причем выявлена сильная обратная корреляционная связь (r = -0,78, p < 0,05) между величиной фракции выброса (ФВ) ЛЖ и уровнем Hb (рис. 2).
В результате инотропной стимуляции миокарда на фоне анемической гипоксии ЛЖ способен развивать
бóльшее напряжение и силу сокращения кардиомиоцитов при одной и той же величине конечного диастолического объема. Таким образом, тяжелая анемия вызывает у больных ХСН своеобразную эндогенную инотропную стимуляцию ЛЖ, что может оказывать негативное влияние на прогноз данной категории пациентов. Такое предположение базируется на результатах многочисленных многоцентровых двойных слепых рандомизированных плацебо-контролируемых исследований, которые показали, что использование негликозидных инотропных стимуляторов увеличивает риск смерти больных ХСН. Так, в исследовании PROMISE (Prospective Randomized Milrinon Survival Evaluation trial) было показано, что применение инотропного препарата милринон пациентами с ХСН вызывало рост общей смертности на 28 %, сердечно-сосудистой – на 34 %, а летальность – в наиболее тяжелой группе больных с застойной ХСН IV функционального класса (ФК) по NYHA (New York Heart Association)
возросла на 53 % [44].
1.3. Анемия на фоне лечения ИАПФ
Поскольку доказано, что применение ИАПФ позволяет снижать заболеваемость и смертность среди больных ХСН, эти препараты считаются основным компонентом терапии ХСН [45]. О влиянии ИАПФ на эритропоэз стало известно уже около 30 лет назад, когда было показано, что ИАПФ снижают уро-
вень Hb у здоровых добровольцев [46]. В дальнейшем подобный эффект ИАПФ был отмечен у больных, которым проводился гемодиализ [47], а также при эритроцитозе после трансплантации почек [48–50] и высокогорном эритроцитозе [51]. Хотя в этих исследованиях была выявлена связь между применением ИАПФ и снижением концентрации Hb, бóльшая часть из них представляла собой описание серии случаев или небольшие и непродолжительные перекрестные исследования.
Поэтому представляет особый интерес масштабное рандомизированное плацебо-контролируемое исследование, посвященное влиянию одного из ИАПФ, эналаприла, на показатели Hb у больных ХСН [53]. Частота развития новых случаев анемии в группе эналаприла и плацебо через год после рандомизации составила 11,3 и 7,9 % соответственно (ОШ = 1,48 при 95 % ДИ 1,20–1,82). При проведении анализа с учетом вмешивающихся факторов (изменение концентрации креатинина
в крови и массы тела) шанс развития анемии при использовании эналаприла по сравнению с плацебо оказался на 56 % выше (ОШ = 1,56 при 95 % ДИ – 1,26–1,93). При этом применение эналаприла по сравнению с плацебо сопровождалось увеличением частоты развития новых случаев анемии на 52 % (ОШ = 1,52 при 95 % 1,22–1,89). Применение эналаприла по сравнению с плацебо приводило
к снижению уровня Ht, причем различие в уровне Ht между группами отмечалось уже через 6 недель после рандомизации. Прием эналаприла по сравнению с плацебо сопровождался более низким уровнем Ht через год после рандомизации как при наличии анемии в исходный период, так и в ее
отсутствие. Авторы не анализировали зависимость между частотой развития анемии и применяемой дозой эналаприла, поскольку выбор дозы определялся клиническими факторами и был индивидуальным для каждого больного. Несмотря на увеличение частоты развития анемии, применение эналаприла сопровождалось повышением выживаемости даже среди пациентов с исходной анемией. В представленном анализе впервые показано, что у больных ХСН и исходно нормальным уровнем Ht применение эналаприла в течение года приводит к увеличению частоты развития анемии, причем
снижение уровня Ht отмечалось уже через 6 недель от начала терапии и сохранялось в течение всего периода исследования. Влияние эналаприла на уровень Hb было умеренным и отмечалось лишь у отдельных больных.
Механизмы развития анемии, обусловленной применением ИАПФ, точно не установлены. Результаты
исследований in vitro свидетельствуют о том, что А-II стимулирует образование предшественников эритропоэза за счет активации рецепторов А-II 1-го типа, расположенных на бластобразующей единице – эритроиде [27, 53]. Применение ИАПФ приводит к уменьшению циркулирующего А-II и,
соответственно, к подавлению предшественников эритропоэза. Кроме того, в других исследованиях было показано, что прием ИАПФ вызывает уменьшение уровня инсулиноподобного фактора роста, который также стимулирует эритропоэз [49]. Наконец ИАПФ подавляют катаболизм N-ацетилсериласпартилпролина, который угнетает пролиферацию предшественников эритроцитов [54].
1.4. Анемия на фоне приема антиагрегантов
Имеющаяся на сегодняшний день большая доказательная база относительно эффективности и безопасности различных антиагрегантов, а также Европейские и Российские рекомендации по ведению больных стабильной стенокардией, ОКС, мерцательной аритмией, при профилактике тромбоза и реокклюзии после АКШ, ангиопластики позволяют утверждать, что антиагреганты являются неотъемлемым компонентом долгосрочной фармакотерапии и вторичной медикаментозной
профилактики пациентов с различными проявлениями ИБС. Существуют достоверные доказательства снижения риска смерти, сердечно-сосудистых осложнений и улучшения прогноза больных ИБС при проведении им антитромбоцитарной терапии [55]. Из всех антитромбоцитарных лекарственных средств наибольшее распространение получила ацетилсалициловая кислота (АСК), применяющаяся как в условиях монотерапии, так и в составе комбинированной терапии с другими антиагрегантами.
Вместе с тем антитромботическая и антитромбоцитарная терапия наряду с уменьшением частоты тромботических осложнений увеличивает риск геморрагических проявлений различной локализации, прежде всего со стороны ЖКТ [56]. При этом наряду с клинически манифестируемыми кровотечениями на фоне антиагрегантной терапии могут наблюдаться оккультные (скрытые) кровопотери, проявляющиеся только анемией различной степени и некоторыми лабораторными признаками (гипохромной анемией, снижением содержания сывороточного Fe). С учетом этого становится актуальной проблема раннего выявления ЖДА у данной категории пациентов и ее своевременной коррекции.
В многоцентровом исследовании CAPRIE (Clopidogrel versus Aspirin in Patients at Risk of Ischaemic Events) [57] среди 19 185 пациентов, которые получали клопидогрел или АСК, общая частота кровотечения составляла 9,3 %. Частота тяжелых случаев составила 1,4 %для клопидогрела и 1,6 % для АСК. У пациентов, применявших клопидогрел, желудочно-кишечное кровотечение наблюдалось с частотой 2,0 % и требовало госпитализации в 0,7 % случаев. Для пациентов, которым назначали АСК, соответствующие частоты составляли 2,7 и 1,1 %. Частота других видов кровотечений была выше
среди лиц, принимавших клопидогрел, чем в случаях применения АСК (7,3 против 6,5 %). Однако частота тяжелых случаев была одинаковой в обеих опытных группах (0,6 против 0,4 %). Более частыми явлениями в обеих опытных группах были пурпура/синяки/гематома и носовые кровотечения. Реже наблюдались гематомы, гематурия и кровоизлияние в глаз (в первую очередь в конъюнктиву).
Таким образом, анемия – один из “клинических спутников” кардиологического больного и вносит свой
негативный вклад в течение заболевания (острые формы ИБС, ХСН и др.). Анемия может возникать на
разных этапах заболевания либо как проявление различных коморбидных состояний, не связанных с заболеванием сердечно-сосудистой системы (опухолевый процесс, хронические кровопотери различной локализации, гемолиз, костномозговая недостаточность и др.), либо как следствие имеющейся кардиальной патологии (ХСН, затяжной септический эндокардит), в т. ч. и терапевтического вмешательства (ИАПФ, антиагреганты, антикоагулянты) [рис. 3].
Рисунок 3. Анемия у больных с сердечно-сосудистой патологией.
2. Место препаратов железа при коррекции анемии у кардиологического больного
В случаях выявления истинной “коморбидной” ЖДА, не связанной с имеющейся кардиальной патологией (опухоли желудка и кишечника, кровоточащий геморрой, меноррагии у женщин, синдром мальабсорбции, гастроэзофагеальная рефлюксная болезнь, алиментарная недостаточность и др.),
лечение должно быть направлено на устранение этой причины (по возможности) или коррекцию имеющихся нарушений (эрозивно-язвенных и опухолевых поражений ЖКТ, миомы матки, энтеритов и др.). При выявлении корригируемой причины ЖДА необходимы лечение (медикаментозное, хирургическое) основного заболевания и патогенетическая терапия препаратами железа (ПЖ). При наличии неустранимой или трудноустранимой причины (беременность, носовые кровотечения при наследственной геморрагической телеангиэктазии, меноррагии и др.) патогенетическая терапия
ПЖ остается единственным способом коррекции дефицита Fe.
2.1. ПЖ при анемии у больных ИБС
В одном из исследований, посвященных проблеме сочетания ИБС с анемией, было показано, что у больных ИБС в сочетании с анемией легкой степени (Нв – 130–110 г/л) и латентным дефицитом Fe при коррекции показателей Hb, сывороточного Fe, общей железосвязывающей способности сыворотки на фоне применения препарата Сорбифер Дурулес (железа сульфат + АСК) уменьшились частота, длительность и интенсивность приступов стенокардии, снизилась потребность в приеме нитроглицерина, увеличилась толерантность к физическим нагрузкам, уменьшилась выраженность коморбидных клинических проявлений: отеки, одышка, ощущение сердцебиения, частоты сердечных сокращений [15].
2.2. ПЖ при анемии у больных ХСН
Лечение ПЖ анемии при ХСН вызывает достаточно большой интерес среди исследователей, т. к. оно относительно недорогое и имеются доказательства его эффективности, хотя остается немало нерешенных вопросов [58]. Заслуживают внимания результаты исследования, продемонстрировавшего эффективность внутривенного введения ПЖ 16 пациентам с ХСН без сопутствующей терапии ЭПО, на
фоне чего были достигнуты достоверное увеличение среднего уровня Hb со 112 до 126 г/л, улучшение переносимости физической нагрузки по данным теста 6-минутной ходьбы и качества жизни в целом [59]. В другом исследовании на фоне лечения препаратами солей железа (Ферро-Фольгамма) и железосодержащих комплексов (Венофер) отмечены уменьшение выраженности клинических признаков сердечной недостаточности и переход пациентов в более благополучный ФК [60].
Было выполнено три рандомизированных плацебо-контролируемых исследования, посвященных применению ПЖ больными ХСН с наличием анемии. В одном из них 40 больных были рандомизированы и получали внутривенно ПЖ или плацебо [61]. Через 6 месяцев показатели Hb на фоне применения ПЖ повышались в среднем от 103 до 118 г/л и оставались стабильными в группе плацебо. Наряду с этим при лечении ПЖ отмечена положительная динамика концентрации натрийуретического пептида, показателей С-реактивного белка, ФВ ЛЖ и теста 6-минутой ходьбы. Другое исследование включило 35 больных ХСН, в течение 16 недель получавших внутривенно ПЖ или плацебо [62]. Было отмечено снижение ФК сердечной недостаточности по NYHA, улучшение общего состояния больных, по их самооценке, без улучшения толерантности к нагрузке, по данным тредмил-теста. Еще одно
более масштабное рандомизированное плацебо-контролируемое исследование эффективности ПЖ среди больных ХСН включило 429 больных ХСН с наличием анемии [63]. Показано, что на фоне внутривенного введения препарата железополимальтозного комплекса наряду с повышением концентрации Hb отмечено значительное или умеренное улучшение состояния, по данным самооценки пациентов (50 и 28 %), уменьшение ФК ХСН по NYHA (47 и 30 %), улучшение показателей теста 6-минутной ходьбы и качества жизни по сравнению с пациентами, получавшими плацебо. Поскольку не у всех больных улучшение сопровождалось повышением уровня Hb, было высказано предположение, что эффект от ПЖ у пациентов ХСН не только связан с повышением показателей Hb, но и может быть обусловлен улучшением функции и работы мышц, в т. ч. сердечной. В пользу данного предположения свидетельствуют результаты экспериментальных исследований, в которых было показано, что у крыс, получавших ПЖ, улучшались показатели работы мышц [64, 65].
В исследовании И.Р. Ким и соавт. на фоне приема пероральных ПЖ в сочетании со стандартной терапией пациентов с сочетанием ХСН и ЖДА также была отмечена положительная динамика в виде не только увеличения концентрации Hb с 97,1 ± 3,7 до 106,7 ± 3,9 г/л, но и повышения толерантности к физической нагрузке (расстояние, пройденное за 6 минут, возросло с 284,8 ± 26,1 до 420,3 ± 31,4 метра) и улучшения клинического статуса пациентов. Были также отмечены изменения центральной
гемодинамики в виде увеличения ФВ с 37,1 ± 3,6 до 49,04 ± 4,2 %, p < 0,05, и ударного объема от 43,7 ± 5,6 до 66,3 ± 6,2 мл [66].
В проведенном нами исследовании на фоне лечения коррекции анемии (ПЖ, витамин В12) у больных ХСН с выраженной анемией (Нb менее 70 г/л) в отличие от пациентов с исходно менее выраженной анемией было отмечено улучшение толерантности к нагрузке и сокращение доли больных с высоким ФК ХСН по NYHA, несмотря на уменьшение исходных показателей ФВ, ударного, конечного систолического объемов [43].
К проблеме ведения больных ХСН с наличием анемии, в частности тактики применения ПЖ, остается ряд вопросов [67], которые сводятся к следующему:
• Необходимо ли всегда применять парентеральные ПЖ или такой же эффект оказывают ПЖ для приема внутрь?
• Существует ли различие в ответе на терапию ПЖ у больных ЖДА и АХЗ?
• Улучшается ли функция ЛЖ после лечения ПЖ?
• Оказывают ли ПЖ многосторонний, не только “гематологический”, эффект на больных выраженной
ХСН?
• Необходимо ли более широко использовать ПЖ для внутривенного введения пациентам с наличием
АХЗ?
• Как долго можно применять парентеральные ПЖ пациентам с АХЗ и существуют ли опасения об отложении Fe в ткани печени или сердца при длительном введении ПЖ?
Для ответов на эти вопросы необходимо проведение дальнейших исследований в этом направлении.
2.3. ПЖ при применении ЭПО больными ХСН с наличием анемии
Имеется ряд сообщений об успешном применении препаратов ЭПО пациентами с ХСН с наличием анемии. В рандомизированное плацебоконтролируемое исследование D. Mancini и соавт. [68], в котором 26 больных ХСН III–IV ФК по NYHA и Ht < 35 % наряду с ЭПО получали пероральный ПЖ (325 мг) и 1 мг/сут фолиевой кислоты, уровень Hb повысился с 110 ± 0,6 до 140 ± 1,2 г/л (р < 0,0001), а максимальное потребление кислорода возросло с 11 ± 0,8 до 12,7 ± 2,8 мл/мин/кг (р < 0,05).
В контрольной группе достоверных различий показателей не было. В другом исследовании [69] пациентов с ХСН и наличием анемии, получавших рекомбинантный человеческий ЭПО (50 МЕ/кг 2 раза в неделю внутривенно) в сочетании с парентеральным введением ПЖ, продемонстрировано не только достоверное увеличение уровня Hb, толерантности к физической нагрузке, по данным теста с 6-минутной ходьбой, и ФВ, но и достоверно лучшая выживаемость за 3-летний период наблюдения (16 из 29 человек по сравнению с 7 из 26, р < 0,05, ОР = 1,27).
Уменьшение ФК ХСН, снижение потребности во внутривенном введении диуретиков, уменьшение сроков госпитализации и стабилизации почечной функции в сочетании с достоверным увеличением ФВ на фоне терапии препаратами ЭПО в сочетании с парентеральным введением ПЖ были отмечены и в исследовании D. Silverberg и соавт. [70].
В большинстве исследований назначали ПЖ для внутривенного введения, которые, по мнению многих,
имеют преимущество перед пероральными ПЖ. Однако эффективность ПЖ для приема внутрь во многом определяется биодоступностью конкретного препарата. Так, в одном из исследований не удалось отметить достоверных различий в динамике прироста уровня Hb у больных ЖДА, леченных препаратами солей Fe внутрь (Сорбифер Дурулес) или железосодержащими комплексами
внутривенно (Феррум Лек) [71]. С учетом этих данных ПЖ для приема внутрь должны занять более широкое место в различных клинических ситуациях, требующих кор-рекции дефицита Fe, в т. ч. и в лечении ЭПО больных ХСН с наличием анемии.
2.4. ПЖ при анемии на фоне приема антиагрегантов
Проблема назначения ПЖ больным, получающим антиагреганты и антикоагулянты, имеет два клинических аспекта. С одной стороны, одним из осложнений антиагрегантной терапии больных ИБС являются кровотечения с развитием ЖДА, что требует своевременной диагностики и назначения
ПЖ. Однако ПЖ получают только около половины (48,4 %) находящихся в стационаре больных ИБС с наличием ЖДА и значительно меньшее число (24 %) больных в отделении кардиореанимации. Что касается больных ЖДА легкой степени, то ПЖ получают лишь 6,5 % пациентов [12].
С другой стороны, имеющаяся анемия, особенно при значительном снижении показателей Hb (Ht), считается наряду с другими признаками (сахарным диабетом, сердечной недостаточностью, уровнем креатинина, величиной артериального давления и др.) одним из предикторов кровотечения при лечении антиагрегантами (шкала CRUSADE). Это, по понятным причинам, ограничивает врачей в использовании жизненно важных для больных ИБС антикоагулянтов и антиагрегантов.
Действительно, частота назначения антикоагулянтов пациентам с ОКС с и без подъема сегмента ST при наличии гипохромной анемии легкой степени составляет 97,1 и 93,1 %, в то время как при анемии средней тяжести и тяжелой ЖДА – 39,9 и 4,3 % соответственно [12].
Таким образом, наличие анемии у лиц с сердечно-сосудистой патологией представляет серьезную проблему как с точки зрения расшифровки патогенетической связи с основными заболеванием, так и при ведении данной категории пациентов. Независимо от того, является ли анемия истинной коморбидностью или оказывается патогенетически ассоциированной с кардиальной патологией, в каждой конкретной ситуации необходимы своевременная диагностика анемии, верификация патогенетического варианта и причины ее развития, адекватная коррекция с помощью антианемических, главным образом железосодержащих, препаратов.


