Остеоартроз (ОА) – самое частое заболевание суставов среди болезней опорнодвигательного аппарата. Распрост-раненность этого заболевания в популяции коррелирует с возрастом, достигая максимальных значений (60–70%) в возрасте старше 65 лет [1]. Женщины болеют почти в 2 раза чаще мужчин. По данным эпидемиологического исследования, в России ОА с преимущественным поражением коленных и/или тазобедренных суставов страдают 13,0% населения. Прогрессирование ОА приводит к значимому ухудшению качества жизни пациентов из-за постоянного болевого синдрома, вызывая нарушения функционального состояния суставов и часто приводя к инвалидности, что является важной социально-экономической проблемой [2, 3].
Как правило, у больных ОА в возрасте старше 50 лет встречается более 5 болезней [4]. Среди пациентов среднего и пожилого возраста с первичным ОА редко можно встретить только одну патологию. В 1970 г. A. Feinsten, врач, исследователь и эпидемиолог, предложил использовать термин «коморбидность» (латинское со – вместе, morbus – болезнь) [5]. Принципиальное уточнение термина «коморбидность» дали H.C. Kraemer и M. Akker, определив его как сочетание у одного больного нескольких хронических заболеваний [6, 7]. Установлено, что ОА относится к заболеваниям с высокой коморбидностью и наиболее часто сочетается с артериальной гипертензией (АГ) и другими сердечно-сосудистыми заболеваниями (ишемическая болезнь сердца – ИБС, атеросклероз), ожирением, сахарным диабетом (СД), хроническими заболеваниями почек, хроническими заболеваниями легких, заболеваниями желудочно-кишечного тракта [8].
Боль в суставах при ОА – основная проблема пациентов, она является первым симптомом болезни и основной причиной, приводящей больного к врачу. Усилия врачей должны быть направлены на купирование болевого синдрома, поскольку именно боль вызывает ограничение физической активности пациентов и способна приводить к функциональным нарушениям сердечно-сосудистой, пищеварительной и дыхательной систем и др. Известно, что интенсивная боль является независимым предиктором прогрессирования заболевания и уменьшения продолжительности жизни среди лиц женского пола [9, 10]. Высокий уровень смертности среди больных ОА объясняется уменьшением физической активности на фоне поражения суставов нижних конечностей и наличием коморбидных заболеваний, а также отрицательным действием лекарственных препаратов, направленных на симптоматическое лечение ОА. Высокая частота коморбидных состояний при ОА определяет значительные трудности в симптоматической терапии и недостаточную ее эффективность. Дифференцированный подход к назначению нестероидных противовоспалительных средств (НПВС) больным ОА базируется на оценке факторов риска развития осложнений на фоне НПВС-терапии, что диктует необходимость тщательной оценки предполагаемой пользы и возможного риска от назначаемой терапии ОА. Нерациональное назначение лекарств на фоне коморбидности и без учета особенностей их взаимодействия приводит к резкому возрастанию частоты нежелательных эффектов терапии и, соответственно, усугублению течения всех заболеваний. В рекомендациях Международного общества по изучению остеоартроза (OARSI – Тhe Osteoarthritis Research Society Internetion, 2014) [11] сделана попытка выделить среди больных определенные формы ОА с учетом локализации поражения суставов и коморбидности и на основании этого предложен дифференцированный подход к лечению. Как и в предыдущих рекомендациях, в них подчеркивается необходимость комбинации немедикаментозных и медикаментозных методов лечения ОА.
В 2003 г. Европейская антиревматическая лига (EULAR – European League Against Rheumatism) особо выделила группу лекарственных средств, определяемых как препараты замедленного действия для симптоматической терапии ОА (SYSADOA – symptomatic slow acting drugs for osteoarthritis).

К настоящему времени накоплен большой научный и клинический опыт, позволивший сделать выводы о возможном наличии структурно-модифицирующего эффекта, присущего этим препаратам.
На сегодняшний день наиболее изученным препаратом, обладающим как симптомодифицирующими, так и структурномодифицирующими свойствами, является хондроитин сульфат (ХС). ХС позволяет поддерживать нормальный состав хряща благодаря увеличению пула гликозамингликанов, которые хондроциты используют для синтеза протеогликанов, а также способствуют снижению воспаления, ингибируя комплемент, снижая активность простагландинов и ферментов в синовиальной жидкости. Это обусловливает возможность использования ХС для лечения дегенеративных заболеваний суставов и позвоночника [12, 13].
ХС является естественным гликозаминогликаном и одним из основных препаратов базисной терапии ОА. Он стимулирует синтез протеогликанов хрящевого матрикса, ингибирует окисление свободных радикалов, угнетает активность ферментов, вызывающих повреждение хрящевой ткани, а также увеличивает продукцию синовиальной жидкости [14].
Препараты ХС обладают хорошей переносимостью. Так, при приеме 1200 или 2000 мг/сут только у 3% больных отмечалась тошнота, 97% пациентов хорошо переносили терапию [15].
В Кокрановском обзоре [16] проанализировано 43 рандомизированных контролируемых исследования, включивших 4962 пациента, получавших лечение ХС, и 4148 пациентов, принимавших плацебо. Бóльшая часть исследований проведена с участием больных гонартрозом. Длительность исследований составила от месяца до 3 лет. У пациентов, получавших ХС менее 6 месяцев, отмечено достоверное снижение выраженности болевого синдрома по сравнению с группой плацебо по визуально-аналоговой шкале (ВАШ).
В исследованиях, длившихся более 6 месяцев, снижение боли в коленном суставе более чем на 20% отмечено по шкале WOMAC (Western Ontario and McMaster Universities osteoarthritis Index).
В двух мета-анализах (R.M. Eugenio-Sarmiento и соавт. (1999) и B.F. Lebb (2000) и соавт. [17–19]), включивших двойные слепые контролируемые исследования больных ОА коленных и тазобедренных суставов, были также получены данные о наличии у ХС обезболивающего и противовоспалительного эффектов, что проявлялось в снижении болевого синдрома, скованности, увеличении объема движений в суставах.
Бóльшая часть ХС выпускается в виде форм для перорального применения, биодоступность препарата при различных способах его введения составляет 13–38% [20, 21]. Внут-римышечный (в/м) способ введения ХС увеличивает биодоступность и долю нативных молекул в системном кровотоке, благодаря чему может повышаться эффективность про-водимой терапии, быстрее развиваться симптоматический эффект. Поэтому представляется важным возможность использования ХС для в/м введения. В настоящее время в России зарегистрирован и применяется препарат Хондрогард, раствор для в/м введения, содержащий ХС натрия 100 мг/мл (ЗАО «ФармФирма «Сотекс», Россия).
Для Хондрогарда используется наиболее изученная в мире европейская субстанция ХС СS Bioactive®, Биоиберика С.А.У. (Испания). Субстанция СS Bioactive® производится в Европе, соответствует требованиям Европейской и Американской фармакопей, ее эффективность и безопасность подтверждены в 20 международных клинических исследованиях с участием более 5000 пациентов. Результаты исследований были представлены на международных ревматологических симпозиумах EULAR, OARSI и других конгрессах и конференциях по изучению и лечению ОА. Также накоплен достаточный научный опыт применения Хондрагарда в России.
Так, в открытом многоцентровом рандомизированном исследовании, проведенном Л.К. Пошехоновой и соавт. в 2012 г. у больных ОА коленных и тазобедренных суставов, было показано, что в группе, получавшей Хондрогард по 2 мл в/м № 25 и НПВС, по сравнению с группой контроля, получавшей только НПВС, наблюдалось более быстрое и статистически достоверное уменьшение болевого синдрома, скованности и улучшение функционального состояния суставов [22].
В другом исследовании, проведенном в ФГБНУ НИИР им. В.А. Насоновой в 2013 г., оценивали эффективность, переносимость и безопасность ХС (препарат Хондрогард) для 70 пациентов с ОА коленных суставов при в/м применении препарата. Терапия ХС в виде в/м инъекций была эффективной для подавляющего большинства больных. Были выявлены статистически значимые улучшения как отдельных показателей: боли, скованности, функциональной недостаточности (ФН), так и показателей по шкале WOMAC в целом. Из 63 пациентов, отметивших положительный эффект от проводимой терапии, полностью прекратили прием НПВС 44% человек. Уменьшили дозу в 2 раза или стали принимать НПВС не чаще 1 раза в 3 дня 33% больных. Отметили улучшение состояния, но продолжали принимать прежнюю дозу НПВС только 22% человек [23].
В ФГБНУ НИИР им. В.А. Насоновой было проведено исследование эффективности, переносимости и безопасности применения препарата Хондрогард пациентами с ОА коленных суставов и коморбидностью.
Целью данного исследования являлась оценка эффективности и переносимости препарата Хондрогард пациентами с ОА коленных суставов и его возможное влияние на течение сопутствующих заболеваний.
Материал и методы
В 2-месячное проспективное исследование были включены 70 пациентов с достоверным диагнозом ОА коленных суставов 2–3-й стадий по Kellgren–Lawrence и наличием сопут-ствующей патологии (СД 2 типа, ИБС, АГ). Сопутствующие заболевания в группе пациентов представлены в табл. 1.
Диагноз ОА устанавливался на основе классификационных критериев АКР (American College of Rheumatology) 1986 г. Критерии включения: мужчины и женщины в возрасте 45–70 лет, установленный диагноз первичного ОА в тибиофеморальном отделе сустава, согласно критериям АКР, и имеющие сопутствующие заболевания (АГ, ИБС, СД 2 типа), боль при ходьбе – не менее 40 мм по ВАШ, II или III рентгенологические стадии по Kellgren–Lawrence, потребность в приеме НПВС в стабильной дозе длительностью не менее 30 дней за предшествовавшие 3 месяца, подписанное информированное согласие.
Критерии исключения из исследования: вторичный гонартроз, внутрисуставное введение любых препаратов за последние 6 недель до начала исследования; случаи хондрокальциноза, асептического некроза мыщелков бедренных и большеберцовых костей, оперативных вмешательств на коленном суставе; наличие известной повышенной чувствительности к ХС; тяжелые сопутствующие заболевания (язва желудка или 12-перстной кишки в течение последнего месяца, кровотечения в анамнезе, тромбофлебиты; беременность и период лактации; прием препаратов, обладающих симптоматическими и структурно-модифицирующими свойствами за последние 3 месяца). Разрешалось использование НПВС, которые пациенты принимали на момент включения в исследование. Не допускалось проведения внутрисуставных инъекций, включая глюкокортикоиды и препараты гиалуроновой кислоты, прием антикоагулянтов, антиагрегантов, фибринолитиков, проведение физиотерапевтических процедур. Препарат назначался в/м в дозе 1 мл (100 мг) через день (первые 3 инъекции), 4-я и последующие инъекции – в дозе 2 мл (200 мг) через день. Всего было выполнено 30 инъекций в течение 2 месяцев. Первые инъекции пациентам проведены в условиях стационара. Исследование включило 3 визита: V0 – визит скрининга и V1 – начало терапии (могли совпадать по дате), V2 – через месяц от начала терапии, V3 – через 2 месяца от начала терапии (окончание терапии). Пациенты вели дневники, где фиксировались данные артериального давления (АД) утром и вечером и терапия АГ, данные измерений глюкозы (при наличии СД).

В исследование вошли 70 пациентов в возрасте от 45 до 70 лет, средний возраст – 62,0±6,46 года. Длительность ОА составила в среднем 9,9±5,1 года. Индекс массы тела (ИМТ) – 31,9+5,9. Большинство (80%) пациентов имели 2-ю стадию гонартроза, 3-я стадия определена у 20% пациентов. Характеристика участников исследования представлена в табл. 2.
В качестве показателей эффективности использовались динамика индекса WOMAC в целом, а также отдельных параметров: значения уровня боли, скованности и ФН.
Оценивали динамику времени, затраченного на вставание со стула и прохождение 5 метров (тест «встань и иди»), потребность в НПВС на протяжении исследования, общую оценку эффективности лечения врачом и пациентом, время наступления эффекта, а также оценку влияния препарата на АГ (снижение АД, повышение АД, отсутствие динамики) и оценку влияния на уровень гликемии (повышение, снижение, отсутствие динамики показателей глюкозы в крови).
В качестве показателей безопасно-сти оценивали частоту и характер нежелательных явлений, развившихся за период наблюдения, их связь с исследуемым препаратом (связи нет, маловероятна, возможна, вероятна, определенна, неизвестна).
Результаты исследования
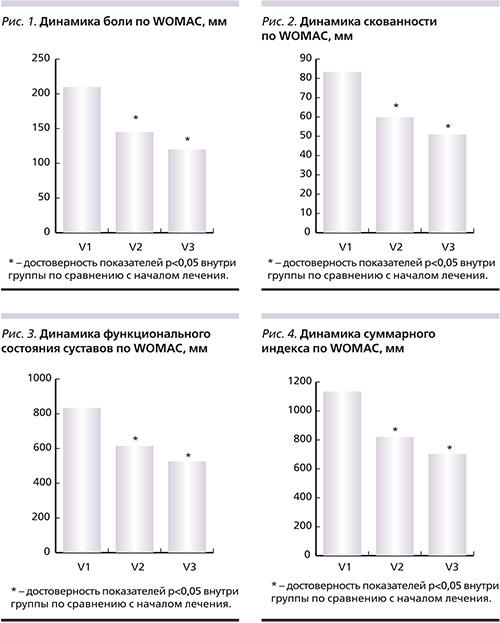
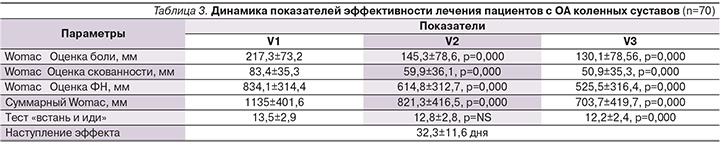
Исследование завершили все 70 пациентов. Анализ результатов позволил установить достоверное снижение боли по WOMAC, отмеченное к концу первого месяца терапии и сохранявшееся в течение всего периода наблюдения (рис. 1). Статистически значимое снижение показателей скованности также отмечено уже на V2 и сохранялось до конца лечения (рис. 2). Достоверное улучшение функцио-нального состояния суставов и снижение суммарного индекса WOMAC наблюдались на V2 и V3 (рис. 3, 4; табл. 3).
Таким образом, улучшение по всем составляющим индекса WOMAC отмечено на всем протяжении терапии и ни один из показателей не вернулся к исходному уровню к концу лечения, при этом выявленные различия были статистически достоверными. Анализ теста «встань и иди» показал достоверное уменьшение затрачиваемого времени на V3 (через два месяца лечения). Наступление эффекта от проводимой терапии препаратом Хондрогард больные отметили в среднем через 32,3±11,6 дня.
Оценка эффективности лечения, проведенная пациентом и врачом, практически не отличалась друг от друга.
«Значительное улучшение» и «улучшение» к V2 отметили 11,4 и 64,4% больных, к V3 – 20,0 и 74,3% соответственно. Отсутствие эффекта наблюдалось у 24% больных к V2 и у 5,7% – к концу лечения (табл. 4). Снижение дозы НПВС и отмену этих препаратов отметили к концу 1-го месяца лечения 58,5 и 13% больных соответственно, а к концу лечения 47 и 46% соответственно и лишь 7% больных не снизили дозу НПВС за период наблюдения (табл. 5).
Следует отметить хорошую переносимость препарата. Побочных эффектов и нежелательных явлений зарегистрировано не было. У больных СД 2 типа уровень гликемии оставался на прежнем уровне до конца лечения, а у 2 (14%) больных отмечено снижение уровня глюкозы.
У всех больных, страдавших АГ, повышения уровней АД на всем протяжении исследования отмечено не было.
Таким образом, на основании полученных результатов можно заключить, что Хондрогард достаточно быстро и эффективно снижает болевой синдром и скованность, улучшает функциональное состояние суставов и при этом является безопасным препаратом. Препарат Хондрогард может быть рекомендован пациентам с коморбидностью при сочетании ОА с АГ и СД 2 типа. Важным преимуществом препарата Хондрогард является быстрота наступления эффекта за счет в/м применения, позволяющая быстрее снизить дозу НПВС или вовсе отказаться от приема НПВС, что очень важно для пациентов с ОА и коморбидностью.
Выводы
- Препарат Хондрогард эффективно уменьшает боль, улучшает функциональное состояние суставов при ОА коленных суставов.
- Препарат может быть рекомендован для курсового приема при ОА коленных суставов у пациентов с коморбидностью.



