Введение
Использование статинов в реальной клинической практике за последние десятилетия неуклонно растет. В то же время доля пациентов, для которых это лечение малоэффективно, весьма велика. Большинство причин этой неэффективности можно считать субъективными. Со стороны пациентов – это неаккуратное следование предписаниям врача и нерегулярный прием препарата, самостоятельное снижение предписанной дозы вплоть до прекращения лечения. Со стороны врачей – это низкая мотивировка больных на постоянное лечение, слабый контроль его результатов, несвоевременное изменение (повышение) дозы статинов при недостаточной эффективности лечения, низкая информированность о современных научных данных. Среди причин малой эффективности гиполипидемической терапии следует помнить о пациентах с семейными формами нарушений липидного обмена, при которых применение статинов даже в средних дозах или в комбинации с нестатиновым липотропным препаратом не позволяет добиваться целевого уровня холестерина липопротеидов низкой плотности (ХС ЛПНП).
Семейная гиперхолестеринемия (СГХС) — одно из самых распространенных наследственных заболеваний. Считается, что всего на Земле проживают 24–34 млн людей с различными формами СГХС [1]. Статистика о распространенности СГХС в Российской Федерации отсутствует, однако исходя из численности населения страны и данных европейских исследований, свидетельствующих о частоте 1:250, предполагается, что это 300–500 тыс. человек. В большинстве стран заболевание своевременно диагностируется менее чем в 1% случаев, т.е. подавляющее большинство пациентов даже не знают, что уровень холестерина в крови у них высок и развивается поражение сосудов [2]. В ряде европейских стран выявляемость таких пациентов с последующим назначением лечения колеблется от 4% (Словакия и Дания) до 71% (Нидерланды) [3]. Самым точным методом диагностики СГХС является лабораторное исследование с подтверждением мутаций определенных генов. Для повседневной практики на этапе первичного врачебного звена достаточно информативны диагностические критерии гетерозиготной СГХС, разработанные голландскими липидными клиниками (DLCN – Dutch Lipid Clinic Network). Модифицированные голландские критерии учитывают данные семейного и персонального анамнезов, физикального исследования и уровень ХС ЛПНП без результатов генетического анализа (см. таблицу) [3].
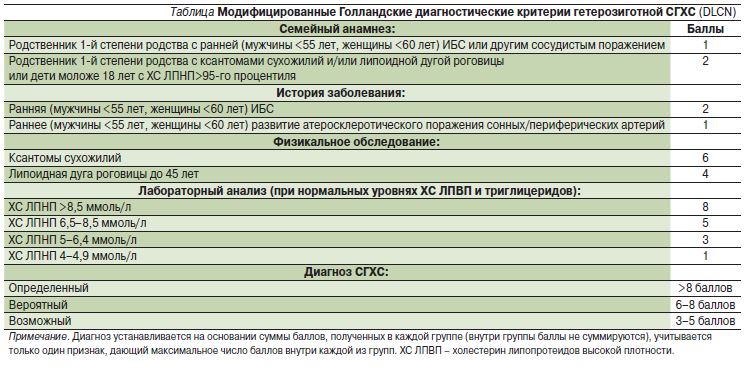
При впервые выявленной гиперхолестеринемии для решения вопроса о начале и степени интенсивности лечения нужно провести комплексную оценку риска фатальных сердечно-сосудистых осложнений по шкале SCORE – Systematic COronary Risk Evaluation [4, 5]. Однако в тех случаях, когда у лиц старше 18 лет уровень общего холестерина (ОХС) в повторных анализах превышает 8,0 ммоль/л и/или уровень ХС ЛПНП превышает 4,9 ммоль/л, следует заподозрить СГХС. Для детей и подростков пороговые уровни ОХС и ХС ЛПНП составляют 6,5 и 4,1 ммоль/л соответственно. Важно помнить, что у пациентов с диагнозом СГХС для оценки риска сердечно-сосудистых осложнений применять шкалу SCORE и другие оценочные шкалы не следует [2]. У таких больных риск сердечно-сосудистых осложнений сразу считается высоким либо очень высоким. Следовательно, им необходимо начинать медикаментозную терапию статинами одновременно с немедикаментозными мероприятиями по коррекции образа жизни. В этом случае можно существенно отсрочить манифестацию ишемической болезни сердца (ИБС) и ее осложнений. Сразу после подтверждения диагноза взрослым начинают лечение с максимальных доз статинов, чтобы снизить уровни ХС ЛПНП до 1,8 или 2,5 ммоль/л в зависимости от категории риска. К настоящему времени наиболее изучено применение взрослыми высоких доз аторвастатина (до 80 мг/сут), симвастатина (до 80 мг/сут) и розувастатина (до 40 мг/сут). При резистентности к лечению либо при невозможности назначения статинов (например, из-за непереносимости) пациентам старше 18 лет назначают дополнительно эзетимиб в дозе 10 мг/сут и/или подкожные инъекции моноклональных антител, ингибирующих пропротеиновой конвертазы субтилизин-кексинового типа 9 PCSK9 (алирокумаб, эволокумаб) [4, 5].
Даже после подтверждения диагноза лечение СГХС в нашей стране остается «традиционным» и базируется прежде всего на постоянном приеме статинов, соблюдении низкожировой диеты. Применяемые в США «новейшие» при гомозиготной СГХС гиполипидемические пероральные средства— ломитапид и мипомерсен – в Российской Федерации не зарегистрированы, аферез липопротеидов проводится лишь в немногих медицинских учреждениях, недавно разработанные инъекционные моноклональные антитела к PCSK9 отличаются высокой стоимостью и пока мало доступны российским пациентам.
Представляет интерес клинический случай длительного наблюдения за пациентом с гетерозиготной формой СГХС, который длительное время принимает аторвастатин (Липримар) в высоких дозах, а также за его детьми, у которых вероятна СГХС и им требуются меры профилактики атеросклероза.
Клинический случай
Пациент – молодой мужчина 1970 г.р., рост – 172 см, масса тела – 76 кг, в 19 лет во время службы в армии перенес инфекционное заболевание с генерализованной сыпью и лихорадкой, выставляли диагноз краснухи. В возрасте 24 лет через 5 месяцев после появления стенокардии высоких напряжений перенес нижний Q-образующий инфаркт миокарда. В феврале 1995 г. в Институте сердечно-сосудистой хирургии им. А.Н. Бакулева была выполнена коронарная ангиография (КАГ) и вентрикулография: выявлены аневризмы левой огибающей и правой коронарной артерий, нестенотические изменения всех магистральных артерий и гипокинез базального сегмента задней стенки левого желудочка. В сентябре 1995 г. был направлен в Отдел атеросклероза НИИ клинической кардиологии им. А.Л. Мясникова Российского кардиологического научно-производственного комплекса (РКНПК) в связи с выраженной гиперхолестеринемией. На момент манифестации ИБС показатели липидного профиля были следующими: общий холестерин (ОХС) – 9,3 ммоль/л, триглицериды (ТГ) – 1,6 ммоль/л, ХС ЛПВП – 0,9 ммоль/л, ХС ЛПНП – 7,0 ммоль/л, внешних признаков СГХС не отмечено. В отделе была начата терапия симвастатином 40 мг/сут вместо ловастатина 40 мг/сут, назначенного при госпитализации по поводу острого инфаркта миокарда в 1994 г., в дополнение к ацетилсалициловой кислоте и атенололу. В июле 1999 г. пациент перенес острое респираторное заболевание, после чего возобновился дискомфорт за грудиной и в области шеи при нагрузках. Во время повторной госпитализации в РКНПК в августе 1999 г. при КАГ был выявлен стеноз на 75% проксимального сегмента левой передней нисходящей артерии. Велоэргометрия была прекращена вследствие усталости; изменения на электрокардиограмме не были зарегистрированы, толерантность к физической нагрузке была высокой, однако при умеренных физических нагрузках пациент испытывал приступы стенокардии. С целью улучшения качества жизни 23.03.2000 была выполнена имплантация голометаллического стента 3,5×13 мм в проксимальный сегмент передней нисходящей артерии с оптимальным результатом. С того же времени больной начал прием аторвастатина 40 мг/сут, что привело к дополнительному снижению уровня ХС ЛПНП до 4,2 ммоль/л. В последующем использовалась также комбинация эзетимиба с различными статинами. В октябре 2006 г. при уровне ХС ЛПНП 4,2 ммоль/л (на фоне приема розувастатина в дозе 10 мг/сут и эзетимиба 10 мг/сут) развился повторный нижний инфаркт миокарда, при экстренной КАГ выявлена тромботическая окклюзия проксимального сегмента правой коронарной артерии. После реканализации были визуализированы гемодинамически значимые стенозы на всем протяжении правой коронарной артерии, что потребовало имплантации трех стентов с лекарственным покрытием. В стационаре была начата терапия аторвастатином 40 мг/сут и эзетимибом 10 мг/сут, что привело к снижению уровня ХС ЛПНП до 2,7 ммоль/л. С 2008 г. доза аторвастатина была увеличена до 80 мг/сут с достижением уровня ХС ЛПНП 2 ммоль/л, в дальнейшем приступы стенокардии отсутствовали, каких-либо побочных эффектов, изменений в биохимическом анализе крови не отмечено. Динамика уровня холестерина на фоне различных схем гиполипидемической терапии на протяжении 23 лет наблюдения представлена на рис. 1.
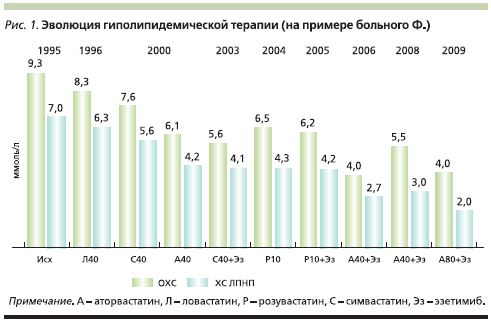
История жизни и семейный анамнез. Из других факторов риска атеросклероза выявлены следующие: курение с 1988 по 1994 г. по 10 сигарет в день и отягощенный семейный анамнез по сердечно-сосудистым заболеваниям (отец перенес инсульт в 55 лет и умер в возрасте 63 лет после повторного инсульта, у матери были ИБС, стенокардия с 37 лет, уровень ОХС 12 ммоль/л, ХС ЛПНП 10 ммоль/л, в возрасте 68 лет погибла от острого инфаркта миокарда). У сына 1999 г.р. ОХС 9 ммоль/л, ХС ЛПНП 7,3 ммоль/л, у дочери 2005 г.р. ОХС 8 ммоль/л, ХС ЛПНП 6 ммоль/л. У жены и старшего родного брата уровень ОХС около 5 ммоль/л. Сын с 15 лет принимает эзетимиб 10 мг/сут, дочь без терапии.
Обсуждение
Вопросы взаимозаменяемости статинов довольно интенсивно обсуждались ранее. К настоящему времени существует согласованное мнение об эквивалентных дозах статинов, отраженное в последней версии рекомендаций Европейского Общества кардиологов 2016 г. [4]. Согласно этой точке зрения, влияние различных доз статиновых препаратов на ХС ЛПНП можно считать сравнимым (рис. 2), однако доказательная база о действии лечения на клинические и прогностические показатели для разных препаратов неодинакова.
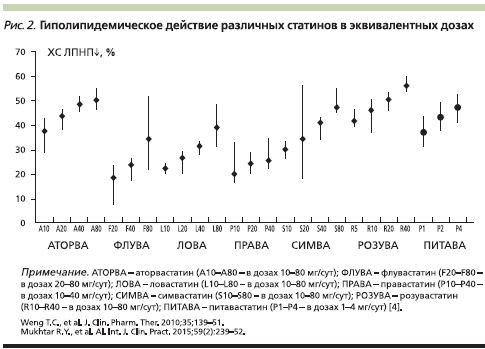
К настоящему времени самыми изученными препаратами считаются аторвастатин, симвастатин и розувастатин. В небольшом ретроспективном исследовании было показано, что в условиях реальной клинической практики аторвастатин в высокой дозе (80 мг/сут) оказывал достоверно более выраженное гиполипидемическое действие, чем симвастатин (также в дозе 80 мг/сут). При этом переносимость лечения обоими препаратами была одинаковой [6]. Данный вывод согласуется с наблюдением за нашим пациентом, который перенес коронарное осложнение (повторный инфаркт миокарда), несмотря на длительный прием симвастатина и розувастатина, при нецелевом уровне ХС ЛПНП. Рецидив ИБС был расценен как показатель неэффективности терапии, после чего розувастатин был заменен на аторвастатин в максимально разрешенной дозе и к лечению был добавлен эзетимиб. В исследовании PCI-PROVE IT (n=2868) показано, что применение аторвастатина в дозе 80 мг/сут по сравнению с правастатином 40 мг/сут [7] после эндоваскулярного лечения по поводу острого коронарного синдрома приводит к снижению частоты коронарных осложнений на 22%, причем значимо уменьшается частота повторной реваскуляризации как целевой, так и других коронарных артерий. Применение аторвататина в дозах 40–80 мг/сут перед чрескожными коронарными вмешательствами ассоциируется со значительным снижением риска перипроцедурного повреждения миокарда, а также 30-дневной частотой инфаркта миокарда и коронарной смерти [8]. По результатам длительного наблюдения (20 лет) за пациентами с диагнозом СГХС, комбинированное интенсивное лечение высокими дозами статинов лучше снижает показатели липидного спектра и уменьшает выраженность атеросклероза в сонных артериях по сравнению с монотерапией статинами в средних дозах [9].
Особую важность представляет наблюдение за детьми нашего пациента. Лечение детей и подростков с диагнозом СГХС, согласно существующим рекомендациям, осуществляется по тем же принципам, что и лечение взрослых, однако целевые уровни СГХС у детей другие. Целью терапии детей в возрасте 8–10 лет является снижение уровня ХС ЛПНП до 4,0 ммоль/л, или на 50% от исходного уровня, детей 10–18 лет – снижение уровня ХС ЛПНП до 3,5 ммоль/л [3].
В отношении детей с диагнозом гетерозиготной СГХС следует стремиться начинать лечение с 8 лет. Наряду с рекомендациями по коррекции диеты и образа жизни детям с этого возраста можно назначать небольшие дозы статинов (как правило, это аторвастатин 10 мг/сут или симвастатин в дозе 10–20 мг/сут), а с 10 лет при выявленных показаниях можно проводить монотерапию эзетимибом 10 мг/сут. Рандомизированных испытаний действия статинов на детей не проводилось, однако в сравнительных наблюдательных исследованиях показана безопасность лечения детей статинами [4]. Израильские и американские ученые сообщили, что моно- и комбинированная терапия статинами детей и подростков с диагнозом СГХС эффективно снижает у них уровни липидов и предотвращает развитие сердечнососудистых осложнений, потребность в реваскуляризации в течение длительного времени (средняя продолжительность наблюдения составила 13 лет) [10]. Лечение таких пациентов в пубертатном возрасте обязательно проводят совместно с педиатром.
Несомненно, следует подчеркнуть, что длительный (более 20 лет ) прием статинов, в т.ч. аторвастатина в максимальной дозе 80 мг/сут с 2009 г., не привел к развитию каких-либо побочных эффектов, включая сахарный диабет 2 типа (СД2). В 2016 г. опубликованы результаты ретроспективного исследования, в котором оценивали заболеваемость СД2 на фоне длительного лечения статинами по различным показаниям [11]. Проанализировав данные 18 рандомизированных исследований с общим числом участников 163 тыс. (из которых 141 тыс. изначально не страдала СД), авторы пришли к выводу, что в среднем лечение статинами на 12% повышало заболеваемость СД. Из каждых 255 больных, принимающих статины, 1 в течение 4 лет заболевает СД. По вполне понятным этическим причинам все исследования в этой области ретроспективные, поэтому интерпретировать все сообщения на эту тему следует крайне осторожно, с учетом исходных параметров обследованных больных, применявшихся препаратов и доз.
Заключение
Врачам и пациентам важно помнить, что в отечественной кардиологии сегодня не существует эффективной альтернативы статинам как высокоэффективному средству для массовой и «адресной» профилактики, а также лечения сердечно-сосудистых заболеваний и осложнений. Диетические мероприятия без медикаментозной поддержки обычно малоэффективны, а строгое их выполнение бывает даже более сложным, чем регулярный прием медикаментозных препаратов 1–2 раза в сутки. Ингибитор абсорбции холестерина эзетимиб не может считаться самостоятельной и полноценной заменой статинам и, как правило, эффективен лишь в комбинации с ними. Некоторые традиционные классы препаратов (ионообменные смолы и никотиновая кислота), а также «новейшие» лекарственные средства (ломитапид и мипомерсен) в Российской Федерации не используются. Фибраты (производных фиброевой кислоты) не оказывают существенного влияния на сердечно-сосудистый риск. Ингибиторы PSCK9 при своей несомненной гиполипидемической эффективности пока чрезвычайно дороги. Кроме того, все перечисленные средства по эффективности и безопасности не обладают и малой частью той доказательной базы при самых разных сердечно-сосудистых заболеваниях, которая существует к настоящему времени для статинов. В этом смысле оригинальный аторвастатин (Липримар), благодаря уникальной доказательной базе рандомизированных клинических исследований, проведенных на больных очень высокого сердечно-сосудистого риска, является эталонным препаратом с возможностью длительного и безопасного использования в максимальной дозировке.



