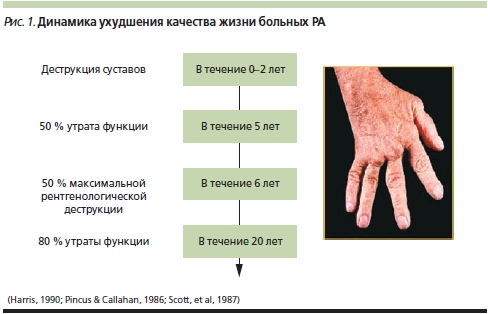
Ревматоидный артрит (РА) – одно из самых тяжелых заболеваний человека, основой которого является хронический пролиферативный синовит, поражение внутренних органов и систем (васкулит или гранулемы) с многолетним персистированием активности воспаления и постепенным разрушением структур суставов и периартикулярных тканей (рис. 1).
Тяжесть болезни определяется следующими факторами:
• хроническим течением иммунного воспаления синовиальной оболочки;
• развитием деструкции суставного хряща и головок суставных костей;
• поражением периартикулярных тканей (сухожилий, связок, мышц) с формированием необратимых анатомических изменений кистей и стоп;
• быстрой инвалидизацией больных: в течение первых 5–8 лет болезни до сих пор более 40 % больных РА становятся инвалидами [1, 2];
• уменьшением продолжительности жизни больных РА в среднем на 10 лет по сравнению с популяцией [3, 4].
РА – болезнь с неизвестной этиологией, чрезвычайно сложным многокомпонентным патогенезом, поэтому терапия его в течение многих лет осуществлялась по сути ex juvantibus. В 1940-е гг. в практику ревматологов были внедрены лекарственные средства, ранее использованные в других отраслях медицины: аминохинолиновые препараты (хлорохин, гидроксихлорохин), соли золота, а также специально созданный для лечения РА сульфасалазин. Позже стали применять Д-пеницилламин, цитостатики (алкилирующие и антиметаболиты). Эти препараты обладают медленным подавляющим воздействием на синовиальное воспаление и внесуставные проявления болезни, однако более выраженным и стойким, чем применяемые ранее симптоматические класса нестероидных противовоспалительных средств (аспирин, индометацин). В зарубежной литературе они получили название “болезнь-модифицирующие антиревматические лекарства” – DMARD’s (disease modifying antirheumatic drugs), в отечественной литературе в последнее время используется термин “базисные противовоспалительные препараты” (БПВП). В последние годы наибольшее распространение получили препараты цитостатического ряда, заимствованные из онкологии, обладающие более быстрым, чем другие БПВП, развитием эффекта, лучшей переносимостью. В 1950-е гг. появились мощные стероидные противовоспалительные препараты: производные кортизола. С 1970-х гг. стали появляться новые нестероидные противовоспалительные средства (НПВС), которые обладали отчетливым анальгетическим и противовоспалительным действиями и при этом переносились лучше аспирина, который применяли с конца ХIX в.
Конец ХХ в. ознаменовался изменением терапевтической стратегии при РА. Вместо длительного лечения больных симптоматическими средствами и назначения БПВП только при наличии всех диагностических критериев РА, предложенных в 1987 г., т. е. только после появления первых эрозий [5], в практику активно внедряется раннее применение БПВП для улучшения отдаленных исходов болезни. Задачу раннего назначения БПВП значительно облегчила разработка новых диагностических критериев РА совместными усилиями Европейской антиревматической лигии – EULAR (European League Against Rheumatism) и Американского колледжа ревматологов – ACR (American College of Rheumatology) [6] (табл. 1).
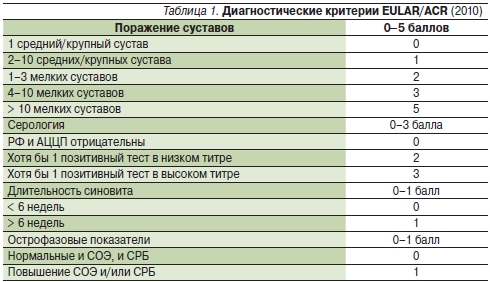
Примечание: РФ – ревматоидный фактор; АЦЦП – антитела к циклическому цитруллинированному пептиду; СРБ – С-реактивный белок. Общее число баллов ≥ 6 указывает на определенный диагноз РА.
Последнее десятилетие ознаменовалось появлением еще одного класса средств для лечения РА – генно-инженерных биологических препаратов (ГИБП), которые оказывают влияние на различные патогенетические звенья заболевания непосредственно в синовиальной оболочке. Эти препараты обладают уникально быстрым началом действия (дни, недели), выраженностью эффекта с развитием ремиссии у многих больных в первые месяцы лечения. Высокая стоимость этих препаратов ограничивает их широкое внедрение в клиническую практику в нашей стране и требует тщательного отбора пациентов для терапии ГИБП.
Таким образом, в настоящее время клиницист обладает широким спектром противовоспалительных лекарственных средств как симптоматического, так и патогенетического воздействия. Однако тактика врачей часто различается, а отдаленные результаты лечения больных нередко не утешительны. Это определяется многими причинами, которые мы собираемся обсудить в данном сообщении.
В настоящий момент созданы международные рекомендации как по ведению больных ранним артритом, так и по стратегии лечения РА.
Общие принципы ведения больных РА можно сформулировать следующим образом [7]:
• ревматолог является специалистом, который должен осуществлять ведение больных РА;
• лечение РА требует постоянного контакта между больным и врачом;
• РА является дорогостоящим заболеванием.
В последние годы большинство стран Европы, включая и Российскую Федерацию, поддержали инициативу “Лечение РА до достижения цели” (Treat to target – Т2Т) [8]. Основанием к созданию основных принципов ведения больных РА и рекомендаций для практических врачей послужили результаты ряда исследований (табл. 2), которые показали, что тщательный и частый контроль активности болезни на фоне терапии и при необходимости быстрая коррекция лечения дают лучший, чем рутинное ведение больных с осмотром их 3–4 раза в год, результат [9–13].
Общие принципы инициативы Т2Т:
• лечение РА следует проводить на основании совместного решения пациента и ревматолога;
• основная цель лечения больного РА – обеспечить максимально продолжительное сохранение высокого качества жизни, связанного с состоянием здоровья, путем контроля клинических проявлений, предотвращения структурного поражения суставов, нормализации функционирования и социальных возможностей пациента;
• устранение воспаления — наиболее важный способ достижения этих целей;
• для оптимизации исходов при РА лечение следует проводить до достижения определенной цели, контролируя активность заболевания и соответствующим образом корригируя терапию.
Первый пункт этих рекомендаций ставит перед врачом задачу обязательного обучения больного, для того чтобы он осознанно участвовал в лечении. Пациент, у которого впервые возникли артриты, испытывает тревогу, желает быстрого “излечивания” своей болезни, склонен искать учреждение, где с болезнью справятся наилучшим способом. Специалист-ревматолог обязан объяснить больному, что, к сожалению, он заболел хроническим заболеванием, излечивание которого на сегодняшний день невозможно. Кроме того, неизвестно, какой именно препарат может наилучшим образом помочь именно ему. Следует объяснить пациенту, что на сегодняшний день существует много различных лекарственных средств, эффективных при РА, но подбор препарата, его дозы займут несколько недель, а может быть, и месяцев. Это отрицательные моменты лечения.
С другой стороны, и это мы всегда говорим пациенту, успех лечения зависит от начала терапии в раннюю стадию болезни, когда большинство противоревматических препаратов наиболее эффективны, а также оттого, что он попадает под наблюдение специалистов, которые будут регулярно следить за эффективностью и переносимостью лечения, при необходимости менять дозы или препараты. Этот момент в общении с больным весьма важен. Пациент в ранней стадии хронической болезни нуждается в уверенности, что его наблюдает и лечит квалифицированный специалист, знающий особенности его заболевания, имеющий опыт лечения РА различными средствами. Больной должен знать сроки развития эффекта при лечении тем или иным препаратом и оценивать его появление; следить за своим состоянием и при возникновении нежелательных явлений активно сообщать об этом лечащему врачу, своевременно проводить обследования, которые предписывает ему врач. Таким образом, определяется круг обязанностей больного в ходе лечения недуга. Личный опыт свидетельствует о том, что информация о сроках развития эффекта от применения БПВП (2–3 месяца, а при лечении некоторыми БПВП и 3–6 месяцев) обычно воспринимается больными с пониманием, тем более что на период до наступления эффекта от БПВП врач обязательно назначает симптоматические средства для облегчения имеющегося состояния.
Основные рекомендации инициативы Т2Т определяют основную цель лечения – достижение клинической ремиссии или низкой активности РА, которые должны поддерживаться на протяжении всей болезни (рис. 2). Для достижения этой цели больных с умеренной/высокой активностью болезни необходимо осматривать ежемесячно, при стабильно низкой активности реже – раз в 3–6 месяцев, с регистрацией количественных параметров активности и использованием валидированных индексов. В соответствии с классификацией РА, принятой на Пленуме Ассоциации ревматологов России в 2007 г. [14], активность РА оценивается по индексу активности DAS28 (Disease Activity Score-28) [15]. Для вычисления этого индекса врач на каждом визите должен оценивать и регистрировать число болезненных и припухших суставов [16], определять СОЭ и С-реактивный белок (СРБ), а пациент должен по визуальной аналоговой шкале (ВАШ) отмечать свое общее состояние.
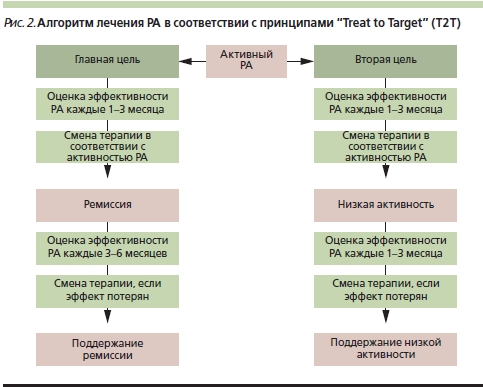
Таким образом, врач на каждом визите может объективно оценивать динамику активности болезни. В отсутствие достижения цели – ремиссии (DAS28 < 2,6) или низкой (2,6 <DAS28 < 3,2) активности – через 3 месяца следует принять решение о коррекции терапии. Если врач видит отчетливую, стабильно нарастающую тенденцию к улучшению, нет необходимости менять терапию каждые 3 месяца; смена терапии становится обоснованной, когда улучшение прекращается.
В соответствии с рекомендациями EULAR лечение РА начинают с монотерапии БПВП, а не с комбинации препаратов. Первым БПВП сразу после установленного диагноза РА должен быть метотрексат (МТ) [7]. По рекомендациям ACR первыми БПВП могут быть МТ и лефлуномид. Метотрексат является высокоэффективным препаратом [17, 18].
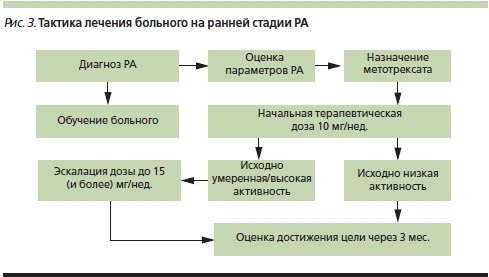
Минимальная терапевтическая доза МТ составляет 10 мг в неделю, но при умеренной/высокой активности РА она должна быть увеличена в течение первых месяцев лечения до 15 мг в неделю (рис. 3), а далее доза корригируется в зависимости от успеха лечения. При достижении цели (ремиссия или низкая активность) терапия продолжается, в отсутствие достижения цели коррекция терапии зависит от наличия или отсутствия прогностически неблагоприятных факторов: ревматоидного фактора (РФ), антител к циклическому цитруллинированному пептиду (АЦЦП), раннего появления эрозий, быстрого прогрессирования, высокой активности болезни. В отсутствие прогностически неблагоприятных факторов проводят последовательное увеличение дозы МТ до 20–30 мг в неделю либо переводят больного на препарат МТ для подкожного введения (рис. 4). Известно, что препарат для подкожного введения обладает большей биодоступностью (до 94 %) по сравнению с пероральной формой (75 %). Его достоверно бoльшая эффективность по сравнению с таблетированной формой МТ была доказана в рандомизированном контролируемом двойном слепом исследовании [19]. Особенно интересно, что у пациентов с отсутствием эффекта от 15 мг в неделю таблетированного МТ увеличение дозы пероральной формы до 20 мг в неделю было менее эффективным, чем перевод на подкожное введение МТ в той же дозе (15 мг в неделю).
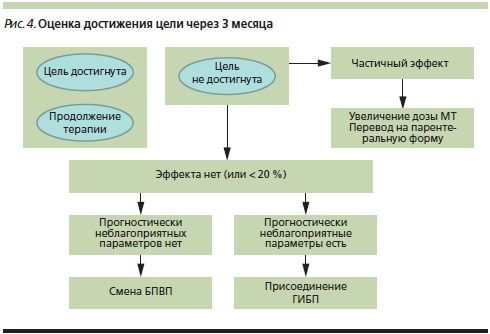
Отсутствие улучшения на фоне эскалации дозы или изменения пути введения МТ в течение 6 месяцев диктует необходимость смены БПВП. При наличии прогностически неблагоприятных факторов после неадекватного ответа на первый БПВП можно ставить вопрос о назначении ГИБП. Показания к назначению ГИБП в Российской Федерации [20]:
• достоверный РА с умеренной/высокой активностью DAS28 ≥ 3,2/> 5,1;
• неэффективность двух БПВП, один из которых МТ, в течение 6 месяцев либо их непереносимость;
• наличие умеренной/высокой активности РА должно быть подтверждено 2-кратным определением в течение месяца;
• отсутствие противопоказаний.
В настоящий момент в России зарегистрировано 7 ГИБП (табл. 3).
Примечание. ФНО – фактор некроза опухоли.
Их эффективность выше при использовании в комбинации с МТ, за исключением тоцилизумаба [21] и цертолизумаба пегола [22], для которых доказана равная эффективность их использования в виде монотерапии по сравнению с комбинированным лечением. Адалимумаб, абатацепт и тоцилизумаб можно применять в комбинации с любым БПВП, что бывает необходимо при непереносимости МТ. Все ГИБП обладают равной эффективностью, демонстрируют быстрое развитие эффекта при недостаточном эффекте терапии БПВП.
Четких предикторов эффективности ГИБП мало: данные Шведского регистра [23] показали, что при высокой активности РА достоверно выше эффективность ингибиторов ФНО-α. Кроме того, по данным исследования ASPIRE [24], по мере нарастания концентрации СРБ, отражающей степень активности РА, нарастала и степень подавления деструкции суставов. При оценке эффективности терапии ингибиторами ФНО-α 2879 пациентов с РА, вошедших в Регистр биопрепаратов Британского ревматологического общества [25], из которых 1267 получали этанерцепт и 1612 – инфликсимаб, худший ответ на лечение отмечен среди курильщиков и пациентов с более высоким индексом HAQ (Health Assessment Questionnaire Disability Index), а лучший – среди получавших НПВС и МТ (т. е. у активных больных). Основным предиктором эффекта любого ГИБП при РА является выраженная активность болезни (как указывается в Российских рекомендациях – DAS28 > 3,2). Ритуксимаб более эффективен для больных, серопозитивных по РФ, особенно для больных с повышенными уровнями и РФ, и АЦЦП, и иммуноглобулина IgG.
Применение этих агентов при раннем РА у больных, никогда не получавших БПВП, ограниченно. Назначение ингибиторов ФНО в качестве первого лечебного средства возможно только при высокой активности заболевания (уровень доказательности С). При низкой и умеренной активности в дебюте заболевания ингибиторы ФНО в ранние сроки болезни не показаны. Устойчиво высокая активность (более 3 месяцев) при наличии факторов плохого прогноза, отсутствии организационных препятствий может быть показанием к использованию ингибиторов ФНО [26–30].
Однако предупреждение прогрессирования РА у больных, т. е. лечение ранней стадии для профилактики развития необратимой утраты функции суставов, в настоящее время является наиболее актуальной задачей лечения хронического ревматоидного воспаления. В международном многоцентровом рандомизированном клиническом исследовании ASPIRE (Active Controlled Study of Patients receiving Infliximab for Treatment of Rheumatoid Arthritis of Early Onset), включившем 1049 больных активным РА с длительностью болезни более 3 месяцев и менее 3 лет, показано отчетливое преимущество комбинации инфликсимаба и МТ в подавлении прогрессирования РА у больных по сравнению с лечением МТ.
На основании данных этого исследования были выделены прогностически неблагоприятные факторы, при наличии которых лечение МТ не сдерживает появления новых эрозий:
• исходное число эрозий (в модификации van der Hejide D.) более 2,6;
• исходный уровень СРБ > 0,6 мг/дл;
• исходный уровень СОЭ > 28 мм/ч (по Вестгрен);
• исходное число припухших суставов > 3.
С помощью многофакторного анализа [30] показано, что даже при нормальных показателях СОЭ и СРБ лечение МТ не позволяет уменьшать риск прогрессирования до низкого. А комбинация инфликсимаба и МТ снижает риск прогрессирования до низкого независимо от исходного уровня острофазовых показателей (табл. 4).
Примечание. Указан относительный риск быстрого прогрессирования.
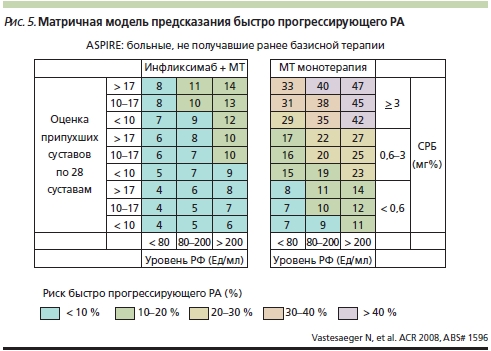
Далее была разработана матричная модель предикторов риска быстрого прогрессирования деструкции в мелких суставах кистей и стоп с оценкой четырех показателей: число припухших суставов, СОЭ, СРБ и РФ [31]. В соответствии с этой моделью монотерапия МТ при раннем РА может оказаться эффективной (риск быстрого прогрессирования < 10 %) при ограниченном суставном поражении, нормальном уровне СРБ и нормальном уровне или низких титрах РФ (рис. 5). В остальных случаях даже на ранних стадиях болезни надежное подавление прогрессирования деструкции возможно только при комбинации МТ и ГИБП. Естественно, возможность раннего использования комбинации БПВП и ГИБП для профилактики деструкции и связанной с ней утратой функции больных определяется экономическими условиями.
При лечении ГИБП для достижения стабильного эффекта большинству больных следует придерживаться следующих правил. В соответствии с принципами программы Treatment to Target [8] лечение РА проводится под контролем количественных показателей, ежемесячно оцениваемых у больных с высокой/умеренной активностью РА, а в отсутствие достижения ремиссии (или альтернативной цели – низкой активности) через 3 месяца решается вопрос о коррекции терапии. Соответственно, в течение первых 3 месяцев лечения при появлении или отсутствии эффекта от терапии не следует торопиться с изменениями в лечении симптоматическими или базисными препаратами.
При анализе нескольких рандомизированных клинических исследований показано, что не исходная активность заболевания, а активность через 3 месяца лечения БПВП или ингибиторами ФНО-α определяет ответ через год лечения: наличие или отсутствие эффекта на лечение можно отчетливо предсказать для 75 % больных [32]. Нередко при появлении быстрого и выраженного улучшения в начале лечения ГИБП врач начинает снижать дозу глюкокортикоидов и/или БПВП, что может сопровождаться временной активацией болезни и быть неверно принятой за неэффективность применения ГИБП. Обычно ГИБП назначают пациентам с наиболее устойчивой высокой активностью РА, часть из них до лечения ГИБП получали внутрисуставно бетаметазон, пульс-терапию (метод в настоящее время не одобрен для лечения РА). В таких случаях начало терапии ГИБП может совпасть с “синдромом отмены” глюкокортикоидов, что также может быть принято за отсутствие эффекта от применения биологического препарата. Из вышеизложенного следует: если больному планируется терапия ГИБП, не следует использовать глюкокортикоиды в массивных дозах; между последним введением в сустав бетаметазона и началом введения ГИБП должно пройти не менее 4 недель.
Согласно международным рекомендациям [7], если больной находится в стойкой ремиссии (на сегодняшний день стойкой считается ремиссия не менее 6 месяцев), доза глюкокортикоидов может быть осторожно снижена, далее возможно обсуждение снижения дозы ГИБП. И только в случае длительной стойкой ремиссии может быть обсуждено осторожное титрование дозы БПВП как общее решение врача и пациента.
Таким образом, улучшение отдаленных исходов РА зависит от своевременной диагностики заболевания, раннего начала терапии БПВП, отсутствия переоценки значимости симптоматической терапии и жесткого контроля результатов проводимой терапии со своевременной коррекцией лечения.



