Сахарный диабет (СД) является величайшей в истории человечества неинфекционной эпидемией. При этом на долю СД 2 типа (СД2) приходится 85–97 % больных диабетом [1, 2]. В Российской Федерации, как и во всем мире, отмечается рост заболеваемости СД2 [3, 4]. В настоящее время диабетом страдает примерно 7 % населения, среди лиц старше 60 лет этот показатель превышает 20 % [5].
Несмотря на достижения в области диагностики и лечения СД, его хронические осложнения до сих пор остаются главной проблемой для большинства больных диабетом. При впервые диагностированном СД2 осложнения наблюдаются примерно у половины больных [8]. Согласно данным исследования CODE-2 (Cost of Diabetes in Europe – Type 2), в котором оценивалась распространенность хронических осложнений СД2, они отмечены у 59 % обследованных, причем у 23 % было 2, у 3 % – 3 и более осложнений [7]. Наряду с постоянно растущей распространенностью заболевания свой вклад в рост числа сосудистых осложнений СД и высокую смертность вносят низкая приверженность пациентов
лечению, а также применение неэффективных режимов терапии.
Велик и экономический урон, наносимый осложнениями СД2. Показано, что их развитие в среднем удорожает лечение заболевания в 3–10 раз [3]. Примерно 80 % затрат на лечение СД связано именно с терапией хронических осложнений [8].
В крупных эпидемиологических и обсервационных исследованиях в области диабета получены убедительные доказательства наличия тесной связи между эволюцией СД2, нарушением углеводного обмена и возрастающим риском микро- и макрососудистых осложнений заболевания [9, 10]. Вместе с тем имеются данные о долгосрочном влиянии раннего метаболического контроля на клинические исходы СД2. На основании этих наблюдений была предложена концепция “метаболической памяти” [11]. Ранняя и эффективная профилактика микро- и макрососудистых осложнений требует оптимального лечения СД с достижением и длительным поддержанием целевых метаболических показателей, проводимого с момента установления диагноза и в течение всей жизни пациента. Поэтому многие национальные и международные диабетологические ассоциации четко определили целевой показатель важнейшего параметра метаболического контроля – гликированного гемоглобина (HbA1c): ADA/EASD < 7 %, IDF ≤ 6,5 %; в РФ основной целью лечения СД2 является снижение уровня HbA1c < 7 % [3, 5].
Следует признать, что на сегодняшний день остаются нерешенными многие проблемы, связанные с обеспечением оптимального метаболического контроля. В России, как и во многих других странах, 2/3 пациентов с СД2 не достигают рекомендованных целей терапии [3, 12].
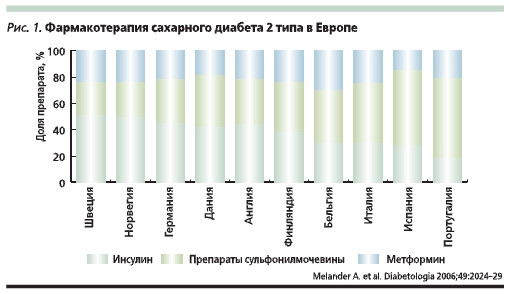
Осознание необходимости срочного подбора эффективной сахароснижающей терапии, обеспечивающей быстрый результат, основано в первую очередь на современном понимании патофизиологии СД2 – непрерывно прогрессирующего заболевания с последовательным ухудшением пока-зателей гликемии, а также того факта, что успех любого метода лечения этого недуга зависит от остаточной функции β-клеток [13, 14]. К числу наиболее известных и широко применяемых при СД2 лекарственных средств относятся препараты сульфонилмочевины (ПСМ; рис. 1). Целесообразность использования ПСМ не подлежит сомнению, т. к. важнейшее патогенетическое звено СД2 – это секреторный дефект β-клеток, в первую очередь отсутствие ранней фазы секреции инсулина [15]. При манифестации СД2 секреция инсулина в среднем снижается на половину, а чувствительность к инсулину – на 70 % [14]. В дальнейшем функция β-клеток ухудшается со скоростью примерно 4–6 % в год, периферическая чувствительность к инсулину остается относительно сохранной. В отношении эффективности ПСМ доказано, что они снижают уровень НbА1с примерно на 1,5–2,0 % [15, 16].
Молекулярный механизм действия ПСМ связан главным образом со стимуляцией β-клеток поджелудочной железы, сопровождающейся мобилизацией и усилением эндогенной секреции инсулина, особенно в присутствии глюкозы [17, 16]. Наличие в островках Лангерганса функционально активных β-клеток является основой для проявления эффекта этих сахароснижающих препаратов [14].
Характер функционирования β-клеток играет ключевую роль в течении СД2 и определяет ответ на все виды терапии. Исследования последних лет позволили получить точную информацию о взаимодействии различных ПСМ с рецепторами поджелудочной железы и объяснить различия в их клиническом действии [15, 17]. ПСМ связываются со специфическими рецепторами SUR-1 на β-клетках, представляющих собой белки АТФ- зависимых К+-каналов их клеточных мембран [18]. Важно отметить, что АТФ-зависимые К+-каналы обнаружены не только в поджелудочной железе, но и в различных тканях: сердце, гладкой мускулатуре сосудов и ткани мозга. Принципиально важной характеристикой ПСМ является селективность связывания с β-клеточными рецепторами.
В настоящее время роль АТФ-зависимых К+-каналов β-клеток в процессе регуляции секреции инсулина считается ключевой [19]. Они состоят из двух компонентов – внутренней части калиевого канала (Kir6.2) и рецепторов SUR-1. После взаимодействия ПСМ с рецептором развивается цепь последовательных событий: закрытие калиевых каналов, прекращение трансмембранного потока ионов калия и деполяризация мембраны. Последний процесс активирует кальциевые каналы: значительно увеличивается приток кальция внутрь β-клеток. Это способствует движению гранул, содержащих инсулин, через клеточную мембрану и секреции инсулина в кровоток [18].
Детальное изучение ПСМ показало, что при в целом сходном механизме действия каждый из препаратов имеет фармакокинетические и фармакодинамические особенности, а также дополнительные фармакологические эффекты, которые необходимо учитывать при лечении пациентов с СД2 [15, 16, 20]. Основными характеристиками разных ПСМ, имеющими реальное клиническое значение, являются селективность взаимодействия с АТФ-зависимыми К+-каналами β-клеток, связь/диссоциация с β-клеточными рецепторами, длительность действия, путь выведения из организма и свойства метаболитов. Неодинаковая аффинность ПСМ к специфическим рецепторам β-клеток поджелудочной железы обусловливает различия в их сахароснижающей активности [15,
16]. Чем выше сродство препарата к рецептору, тем длительнее его подавляющее влияние на АТФ-зависимые К+-каналы, а значит – тем сильнее будет стимулироваться эндогенная секреция инсулина за счет поступления в β-клетки ионов кальция. Важно отметить, что чрезмерная стимуляция
секреции инсулина, вызываемая некоторыми ПСМ, может способствовать преждевременному истощению функциональной активности β-клеток, увеличению риска гипогликемий и прибавке массы тела у некоторых пациентов [18]. Поэтому выбор того или иного ПСМ должен основываться на оценке баланса эффективности, безопасности и доступности препарата для пациента.
Новые данные по высокой клинической эффективности гликлазида (Диабетон МВ), полученные в исследовании ADVANCE, открыли многообещающие возможности в лечении СД2 и профилактике его сосудистых осложнений [21]. Исследование включило 11 140 пациентов с СД2 из разных стран мира, в т. ч. из России. Это были больные с длительным течением СД2 (в среднем более 8 лет), имеющие факторы высокого кардиоваскулярного риска, причем 32 % из них перенесли неблагоприятные сердечно-сосудистые события. Уровень HbA1c в группе интенсивного контроля, где терапия основывалась на Диабетоне МВ, снижался постепенно – в среднем до 6,5 % (была достигнута поставленная цель), тогда как в группе стандартного лечения этот показатель составил в среднем 7,3 %. Значения HbA1c, достигнутые к концу первого года наблюдения в группе интенсивной терапии, удерживались на этом уровне на протяжении всего исследования – в течение 5 лет. Кроме того,
режим интенсивного контроля гликемии, основанный на Диабетоне МВ, позволил достичь целевых значений HbA1c у гораздо большего числа пациентов с СД2, чем стандартное лечение (см. таблицу).
Таблица. Доли пациентов с СД2, достигших целевых уровней HbA1c на момент завершения исследования ADVANCE.
В соответствии с предложенной схемой титрования дозы на момент завершения периода наблюдения большинство пациентов (70 %) в группе интенсивного контроля получали Диабетон МВ в дозе 120 мг в сутки утром во время завтрака. Эти данные демонстрируют принципиальную важность увеличения дозы Диабетона МВ с целью проявления всего спектра эффективности препарата.
Применяющиеся в клинической практике ПСМ являются эффективными средствами с точки зрения снижения уровня гликемии, однако существенно отличаются друг от друга в плане безопасности [20, 22, 23]. Хорошо известно, что гипогликемия является лимитирующим фактором любой сахароснижающей фармакотерапии.
К примеру, глибенкламид – высокоэффективный сахароснижающий препарат, что обусловлено его длительной связью с β-клеточными рецепторами и как следствие – пролонгированной секретогенной активностью, порой приводит к чрезмерной гиперинсулинемии, чреватой высоким риском развития гипогликемий, а в прогностическом плане – более быстрым истощением функциональной активности
β-клеток [24]. Особенно это опасно для пожилых пациентов, более предрасположенных к гипогликемическим состояниям.
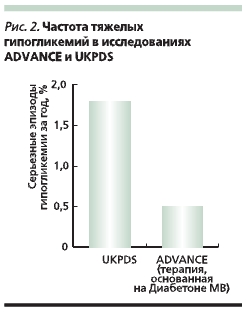
Тяжелые и длительные эпизоды гипогликемии на фоне приема ПСМ могут сопровождаться повышенной смертностью, особенно больных СД2 пожилого возраста. В частности, в исследовании UKPDS гипогликемические состояния были отмечены в течение первого года лечения примерно у трети больных, получавших глибенкламид [25]. Кроме того, у пациентов, получавших длительно действующие ПСМ, была установлена обратная связь между концентрацией глюкозы натощак и в послеобеденные часы [24]. Иначе говоря, неадекватно высокая доза пролонгированных ПСМ в утренние часы может обусловливать развитие гипогликемии в послеобеденное время. Поэтому особого внимания заслуживает то обстоятельство, что стратегия достижения гликемического контроля у пациентов с СД2, предложенная в исследовании ADVANCE и основанная на применении Диабетона МВ, ассоциировалась с очень низкой частотой эпизодов гипогликемии при одновременном обеспечении эффективного контроля гликемии [21]. Число гипогликемий было вчетверо меньшим, чем в исследовании UKPDS, несмотря на более низкий уровень HbA1c, достигнутый у пациентов группы интенсивного контроля в ходе исследования ADVANCE (рис. 2). Такие результаты могут быть обусловлены способностью гликлазида восстанавливать первую фазу секреции инсулина, в первую очередь нарушающуюся при СД2, что не только максимально приближает к физиологическому ответу β-клеток на прием пищи, но и достоверно снижает риск эпизодов гипогликемий.
В ходе пятилетнего наблюдения в группе интенсивного контроля, основанного на применении Диабетона МВ, по сравнению с группой стандартного лечения было достигнуто достоверное снижение частоты основных микро- и макрососудистых осложнений СД2 на 10 % (p = 0,013). Причем стратегия интенсивной терапии СД2 привела к достоверному снижению на 14 % (р = 0,01) риска микрососудистых осложнений, что обусловлено главным образом выраженным падением частоты развития новых случаев нефропатии и ее прогрессирования на 21 % (p = 0,006). Что касается диабетической нефропатии, то отмечено достоверное снижение на 9 % (p = 0,018) риска микроальбуминурии [21]. Существенно, что интенсивная сахароснижающая терапия по сравнению со стандартной достоверно снижает на 30 % (p < 0,001) частоту макроальбуминурии – доказанного маркера высокого сердечно-сосудистого риска. С учетом этих данных становится понятным, что применение Диабетона МВ способствует решению еще одной важнейшей задачи лечения пациента с СД2 – улучшению отдаленных исходов заболевания [26, 23]. Ведь хорошо известно, что диабетическая нефропатия – это одно из наиболее серьезных и инвалидизирующих последствий СД2, от которого погибает каждый пятый пациент [27].
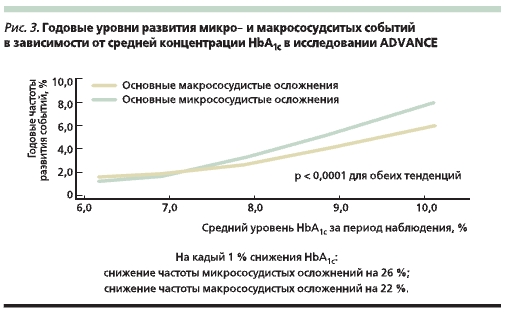
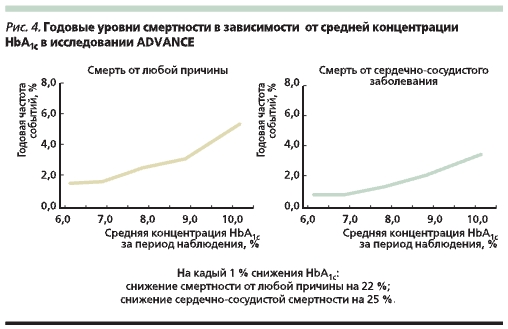
Полученные новые результаты доказывают высокую клиническую и прогностическую эффективность Диабетона МВ: в рамках исследования ADVANCE продемонстрировано, что уменьшение уровня HbA1c на 1 % приводило к снижению риска микро- и макрососудистых событий на 26 и 22 % соответственно, уменьшению сердечно-сосудистой смертности на 25, а общей смертности на 22 % (рис. 3 и 4). Следовательно, интенсивная стратегия лечения имеет определяющее значение для снижения риска развития сосудистых осложнений, что дает повод рекомендовать Диабетон МВ как более предпочтительный ПСМ для терапии больных СД2, особенно с признаками сердечно-сосудистой патологии, перенесших сердечно-сосудистое событие, а также с выраженными факторами риска.
На сегодняшний день имеются научные доказательства существования относительно не зависимых от гликемического контроля факторов (окислительный стресс, нарушение реологии крови, дисфункция эндотелия), способствующих ускорению атерогенеза и повышающих риск сердечно-сосудистых нарушений при СД2 [26, 27]. Помимо эффективного контроля уровня гликемии Диабетон МВ обеспечивает и не зависящие от уровня гликемии эффекты, блокируя ключевые этапы патогенеза сосудистых осложнений [5]. Хорошей иллюстрацией вышесказанного служат результаты исследований, продемонстрировавших способность Диабетона МВ снижать риск тромбообразования, подавлять агрегацию тромбоцитов, повышать время между воздействием прооксидантов на липопротеиды низкой плотности и началом их окисления, угнетать оксидативный стресс за счет активации супероксиддисмутазы, нормализовать баланс между простациклином и тромбоксаном А2, а также
улучшать эндотелиальную функцию [28, 29]. Собственно, сосудистые эффекты гликлазида свидетельствуют об антиатерогенном действии препарата у больных СД2. Эти и другие благоприятные свойства Диабетона МВ обусловлены его химической структурой: наличием в отличие от других ПСМ аминоазобициклооктанового кольца [28].
Заслуживает внимания еще один аспект проблемы лечения СД2: у большинства больных монотерапия пероральными сахароснижающими препаратами не обеспечивает долгосрочного эффективного гликемического контроля [5, 15]. По результатам исследования UKPDS монотерапия одним из пероральных сахароснижающих препаратов через 3 года от начала лечения была эффективной только у половины пациентов, а через 9 лет – лишь у четверти, что ведет к необходимости назначения комбинированной терапии [25]. Диабетон МВ может эффективно использоваться в комбинированной терапии как с метформином, инкретиномиметиками, так и с инсулином [16, 20].
В заключение следует подчеркнуть, что ПСМ играют важную роль в терапии СД2. Диабетон МВ обладает рядом уникальных свойств, определяющих подтвержденную исследованием ADVANCЕ целесообразность включения препарата в лечение СД2. Учитывая, что большинство больных в исследовании ADVANCE получали 120 мг Диабетона МВ, компанией Сервье создана новая форма Диабетона МВ, содержащая 60 мг в одной таблетке. Преимущества Диабетона МВ 60 мг перед его предшественником состоит в уменьшении числа таблеток на прием и повышении приверженности больных лечению.
Таким образом, широкое внедрение в клиническую практику Нового Диабетона МВ 60 мг будет способствовать достижению эффективного гликемического контроля у большего числа больных. Применение Диабетона МВ соответствует решению основной цели лечения СД2 – достижению и поддержанию безопасного долгосрочного контроля гликемии в качестве компонента многофакторного подхода, направленного на снижение сосудистого риска.



