В настоящее время в лечении больных сахарным диабетом (СД) широко используются препараты, способные корригировать свободнорадикально-опосредованный окислительный стресс (ОС). Одно из таких препаратов – Дибикор, действующим веществом которого является таурин, непосредственно влияющий на антиоксидантную систему клетки [1]. Известно, что он может уменьшать концентрацию гипохлорной кислоты за счет образования N-хлортаурина [2], который ингибирует супероксидные радикалы [3], снижает продукцию фактора некроза опухоли, образование пероксилнитрита [4], а также косвенным образом стимулирует образование супероксиддисмутазы (СОД) [1]. Препарат Дибикор в таблетках разработан сотрудниками Российского кардиологического научно-производственного комплекса, Института биофизики и Волгоградского государственного медицинского университета. Действующее начало Дибикора – таурин, является естественным продуктом обмена серосодержащих аминокислот: цистеина, цистеамина, метионина. Препарат используется в лечении больных СД типа 2 (СД2) (патент РФ 2054936) [5]. Данных о влиянии таурина на активность других антиоксидантных ферментов (в частности, каталазы – КАТ) и окислительную модификацию белков в доступной литературе нами не найдено.
Цель исследования: уточнить некоторые механизмы антиоксидантного действия препарата Дибикор (таурин) и оценить его возможности в коррекции окислительного стресса у больных СД2.
Материал и методы
Обследованы 20 пациентов, страдающих СД2. Средний возраст больных составил 56,2 (52,4–63,7), длительность заболевания – 4, 3 (2,8–6,6) года, уровень гликозилированного гемоглобина (Hb) – 7,8 (7,1–8,4) %. Дополнительно к базисной сахароснижающей терапии пациенты в течение 2 месяцев получали препарат Дибикор в суточной дозе 1 г (по 2 таблетки по 0,25 г 2 раза/сут).
Группу контроля составили 14 пациентов, больных СД2, получавших стандартную базисную терапию. По полу, возрасту, длительности заболевания, уровню гликозилированного Hb, объему проводимой базисной сахароснижающей терапии пациенты обеих групп статистически значимо не различались.
До и после курса лечения оценивалась выраженность OC: интенсивность свободнорадикального окисления (Imax СРО) и общую антиоксидантную активность (ОАА). Оценивали молекулярные продукты перекисного окисления липидов (ПОЛ), окислительную модификацию белков (ОМБ), активность антиоксидантных ферментов (АОФ): СОД и каталазы (КАТ), содержание метаболитов оксида азота (нитратов и нитритов).
Интенсивность (Imax – максимальная интенсивность свечения, свидетельствующая о свободнорадикальной активности) и ОАА определены методом индуцированной хемилюминесценции. Imax измерена в mV, ОАА – в относительных единицах (относ. ед.). Молекулярные продукты ПОЛ плазмы крови – диеновые конъюгаты (ДК), триеновые конъюгаты (ТК), малоновый диальдегид (МДА) – определены по методу Folch (1957), измерены в единицах оптической плотности на 1 г ткани (ед. опт. пл./г общих липидов) [6].
Для определения активности СОД использован метод, разработанный Nishicimi (1972), в адаптации Дубининой Е.Е. и соавт. (1988). Для определения активности КАТ использован метод, разработанный Aebi (1970), в адаптации Королюк и соавт. (1988), Чевари и соавт. (1991). Активность выражена в единицах активности на 1 мг Hb (ед. акт./мг Hb) [6].
Оксид азота и его метаболиты в плазме крови определены по восстановлению нитрата до нитрита с помощью реакции Грисса; концентрация NO выражалась в мкг/мл [6].
Для определения ОМБ использован метод, предложенный Levine (1990), в модификации Дубининой Е.Е. (1995). Оценивали ОМБ по уровню карбонильных производных, выявленных в реакции с 2,4-динитрофенилгидразином: альдегиддинитрофенилгидразонов (АДФГ) и кетондинитрофенилгидразонов (КДФГ). Спонтанную и металлозависимую (индуцированную) ОМБ анализировали одновременно. Оптическую плотность образовавшихся соединений регистрировали при длинах волн 270 и 363 нм, измерение проводилось в относительных единицах. Для расчета применен коэффициент молярной экстинкции 22 × 10-3 М-1 см-1 [7].
Спонтанные АДФГ (АДФГс) являются наиболее ранним маркером повреждения, свидетельствующим о нарушении окислительного потенциала клетки, КДФГ – поздним маркером окислительной деструкции белка [8].
Полученные в ходе исследования результаты обработаны с помощью общепринятых методов статистики на компьютере IBM PC с использованием пакета прикладных программ для обработки медицинской и биологической информации Statistica 6.0 (StatSoft, Inc.,США). Характер распределения оценен с помощью критериев Вилка–Шапиро. Непараметрические данные были представлены в виде медианы, нижнего квартиля (25 процентиль) и верхнего квартиля (75 процентиль) в формате Me (25p;75p). Для определения различий между двумя зависимыми и независимыми группами использован критерий Вилкоксона и Манна–Уитни соответственно [9].
Результаты и обсуждение
При использовании Дибикора в терапии больных СД2 отмечено статистически значимое повышение ОАА и КАТ (табл. 1).
Примечание. pд – сравнение до и после лечения в группе с Дибикором; pк – сравнение до и после лечения в группе контроля.
В контрольной группе изменения ОАА не были статистически значимыми (p = 0,41).
У пациентов, принимавших Дибикор, ОАА повышалась на 31,6 % (p = 0,016), в контрольной группе динамика составляла 4,3 % (р = 0,41). Активность СОД в обеих группах изменялась незначительно (р = 0,33 и р = 0,35 в группе Дибикора и в контрольной соответственно), однако в группе Дибикора статистически значимо повышалась активность КАТ (43 %, p = 0,028; см. рисунок).
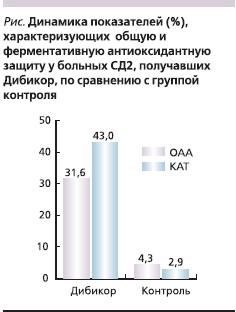
Повышение активности КАТ, вероятно, свидетельствует о более высоком уровне антиоксидантной защиты тогда, когда адаптационные резервы СОД исчерпаны.
Интенсивность СРО в исследуемых группах до начала терапии достоверно не различалась (p = 0,22). В процессе лечения Дибикором статистически значимо снижалась Imax СРО (p = 0,002), в частности уровень МДА (p = 0,027). В контрольной группе статистически значимых изменений не было, однако отмечена тенденция к снижению уровня МДА в процессе лечения (р = 0,117) (табл. 2).
Примечание. рд – сравнение до и после лечения в группе Дибикора; рк – сравнение до и после лечения в группе контроля.
Значительное снижение уровня именно карбонильных производных (МДА) свидетельствует об адекватном включении в процесс детоксикации КАТ, что согласуется с литературными данными [10].
С учетом статистически значимого различия I СРО до и после лечения Дибикором кроме уточнения динамики молекулярных продуктов ПОЛ нами предпринята попытка уточнения влияния препарата на ОМБ.
В процессе лечения Дибикором статистически значимо уменьшалось количество КДФГ – поздних маркеров окислительной деструкции белка (табл. 3).
Примечание. АДФГс – альдегиддинитрофенилгидразоны спонтанные; АДФГи – альдегиддинитрофенилгидразоны индуцированные; КДФГс – кетондинитрофенилгидразоны спонтанные; КДФГи – кетондинитрофенилгидразоны индуцированные.
Под влиянием Дибикора на 37 % уменьшилось количество АДФГи (p = 0,059), на 64,3 % – КДФГс (p = 0,027) и на 44,2 % снизилось содержание КДФГи (p = 0,026). Изменения в группе контроля не имели статистической значимости (p = 0,91).
Следовательно, таурин (Дибикор) ограничивает ОМБ, а значит, корректирует ОС на самых ранних этапах, т. к. ОМБ рассматривается как один из ранних и надежных маркеров ОС [10]. Возможно, этот механизм действия таурина объясняет, почему при включении препарата в комплексную и монотерапию пациентов с СД2 можно достичь достоверного улучшения гликемического контроля и снижения индекса инсулинорезистентности [11].
При использовании Дибикора имеется тенденция к увеличению содержания косвенных маркеров содержания оксида азота – его метаболитов (табл. 4).
С учетом того, что повышение содержания метаболитов оксида азота наблюдалось на фоне уменьшения ОС, полученные данные следует считать доказательством тенденции к коррекции эндотелиальной дисфункции.
Добавление Дибикора способствует активизации более высоких уровней антиоксидантной защиты и его возможно использовать в виде как моно-, так и в комплексной терапии больных СД2, что подтверждают литературные данные [11].
Известно, что наиболее чувствительными к окислению являются серосодержащие (метионин, цистеин) и ароматические (гистидин, триптофан, тирозин и фенилаланин) аминокислотные остатки протеинов [10]. В результате захвата электронов такими группами происходит образование активных центров. Окислительное повреждение протеинов, связанное с образованием радикальных центров, является причиной инактивации большой группы ферментов, в частности глицеральдегид-3-фосфатдегидрогеназы, глюкзо-6-фосфат-дегидрогеназы, глутатион-S-трансферазы, глутатионредуктазы, что способствует, с одной стороны, прогрессированию метаболических нарушений, с другой – генерации свободных радикалов [10].
Таурин является естественным продуктом обмена серосодержащих аминокислот цистеина и метионина. Стимулируя активность КАТ, Дибикор ограничивает ОМБ и, следовательно, ОС, а также тот каскад метаболических нарушений, который имеет место у больных СД2 при недостаточном гликемическом контроле. С другой стороны, он служит поставщиком немодифицированных серосодержащих аминокислот – антиоксидантов третьей линии антиоксидантной защиты.
Выводы:
1. Антиоксидантное действие Дибикора реализуется, в частности, через повышение активности антиоксидантного фермента каталазы, что способствует повышению общей антиоксидантной активности.
2. При использовании Дибикора статистически значимо ограничивается интенсивность свободнорадикального окисления.
3. В результате применения Дибикора статистически достоверно ограничивается окислительная модификация белков, корректируя окислительный стресс на самых ранних этапах.
4. Ограничение пероксидации липидов и окислительной модификации белков способствует коррекции эндотелиальной дисфункции, о чем свидетельствует тенденция к увеличению содержания метаболитов оксида азота у пациентов, лечившихся Дибикором.
5. Препарат Дибикор статистически значимо корректирует свободнорадикальное окисление и может быть использован в лечении больных СД в самом начале заболевания.
6. С учетом положительной тенденции к коррекции эндотелиальной дисфункции применение препарата должно быть длительным.



