Введение
Распространенность сахарного диабета (СД) во всем мире постоянно растет. По данным Международной диабетической федерации, численность больных СД в мире за последние 10 лет увеличилась более чем в 2 раза и к концу 2021 г. достигла 537 млн человек [1].
Цели лечения СД 2 типа (СД2): достижение хорошего метаболического контроля показателей углеводного обмена, артериального давления и липидного спектра крови, снижение избыточной массы тела, предупреждение острых осложнений, таких как гипогликемия, кетоацидоз, профилактика или замедление развития поздних осложнений.
СД2 является хроническим, постоянно прогрессирующим заболеванием, лечение которого требует многофакторного поведенческого и фармакологического воздействия для предотвращения развития осложнений и улучшения качества жизни (рис. 1). Использование современных сахаро-снижающих препаратов с кардиоренопротективными эффектами позволяет эффективно управлять гликемией, кардиоваскулярными факторами риска, контролировать массу тела.
Консенсус ADA/EASD 2022
В сентябре 2022 г. эксперты ADA (American Diabetes Association) и EASD (European Association for the Study of Diabetes) предоставили консенсус по ведению пациентов с гипергликемией при СД2.
Ведение пациента с СД2 должно быть организовано и структурировано определенным образом, необходимо использовать личностно-ориентированный подход к повышению вовлеченности пациента в управление своим заболеванием. Для каждого пациента рекомендуют индивидуализированные цели и стратегию лечения с формированием пошагового цикла принятия решений для управления гликемией (рис. 2).

Работу с циклом принятия решений необходимо начинать с определения разумных целей, которые должны быть конкретными, измеримыми, достижимыми, реалистичными, ограниченными во времени [2].
Поставленные цели согласуются с пациентом, осуществляются постоянная поддержка и мониторинг, оценивается результат. На каждом этапе цели могут быть скорректированы. Необходимо использовать разные варианты достижения целей: системы дистанционного мониторирования, очные посещения врача и групповое обучение. Наиболее важными показатели для мониторинга – это уровни липидов крови, гликированного гемоглобина (НbА1с), артериальное давление (АД), показатели гликемии, массы тела, физическая активность. Оценка уровня НbА1с применяется во всем мире как эффективный и безопасный критерий адекватности сахароснижающей терапии. Достижение целевых показателей гликемии приводит к существенному и стойкому снижению частоты возникновения и прогрессирования микрососудистых осложнений.
К важным аспектам в лечении пациентов СД2 относятся рациональное питание, адекватная физическая нагрузка, психологическая поддержка.
Поскольку СД2 является весьма гетерогенным заболеванием с различным возрастом начала заболевания, ожирением разной степени выраженности, резистентностью к инсулину и склонностью к развитию осложнений, требуется использование препаратов с плейотропными эффектами. Устранение полиморбидности с учетом индивидуальных предпочтений пациента имеет большое значение для эффективного лечения [3]. Совместное принятие решений, обсуждение пользы и риска альтернативных вариантов лечения являются обязательной опцией успешной терапии.
Снижение массы тела
Поскольку 80–90% пациентов с СД2 имеют избыточную массу тела или ожирение, снижение массы тела служит основополагающим фактором в комплексной терапии заболевания. Раньше снижение массы тела в основном рассматривалось как стратегия нормаизации уровня HbA1c и снижения риска осложнений, связанных с весом.
Недавно было высказано предположение, согласно которому потеря массы тела на 5–15% должна быть основной целью лечения для больных СД2. Более высокая степень потери массы тела обеспечивает лучшие результаты. Потеря массы тела на 5–10% способствует улучшению обмена веществ; потеря массы тела на 10–15% и более может оказывать модифицирующее действие на заболевание и приводит к ремиссии диабета [4].
Ремиссия СД2 наблюдается при нормальном уровне глюкозы в крови в течение 3 месяцев или более в отсутствие фармакологической терапии [5]. Потеря массы тела может приносить пользу, выходящую за рамки контроля гликемии, для улучшения факторов риска кардиометаболических заболеваний и качества жизни [4]. В основе лечения СД2 лежит модификация образа жизни с определенными подходами к качеству рациона питания. Не существует единого соотношения потребления углеводов, белков и жиров, которое было бы оптимальным для каждого человека с СД2. Вместо этого рекомендуется индивидуально подобранный режим питания, в котором особое внимание уделяется продуктам с доказанной пользой для организма с учетом индивидуальных предпочтений. Важно придерживаться гипокалорийного питания для снижения массы тела.
Сетевой мета-анализ 10 различных подходов к 12-недельному рациональному питанию продемонстрировал снижение уровня HbA1c от -0,82 до -0,47% при всех изучаемых вариантах питания по отношению к контрольной диете. Более существенные гликемические преимущества получены на средиземноморской и низкоуглеводной диетах [6]. В исследованиях продолжительностью более 6 месяцев средиземноморская диета продемонстрировала большее снижение массы тела и уровня HbA1c, отсрочку назначения гипогликемических препаратов и показала преимущества для сердечнососудистой системы [7]. Голодание не рекомендовано при СД2, т.к. может приводить к увеличению частоты гипогликемий у пациентов на инсулинотерапии или на фоне приеме препаратов сульфонилмочевины.
В то же время клиническое исследование (DiRECT) продемонстрировало, что с помощью программы контроля массы тела можно добиться длительной ремиссии диабета на фоне снижения и удержания массы тела. Структурированная программа интенсивного снижения массы тела включала полную замену рациона (825–853 ккал/сут. в течение 3–5 месяцев) с последующим поэтапным восстановлением питания для поддержания долгосрочной потери массы тела. Ремиссия СД2 напрямую зависела от степени потери массы тела [8]. В популяционных исследованиях показано, что если человек удерживает не менее 10 кг от потерянной массы тела, то в 64% случаев достигается ремиссия диабета. В исследовании DiRECT только 24% участников в группе вмешательства сохранили потерю массы тела на 10 кг [9]. Известно, что снижение сердечно-сосудистых событий и смертности наблюдается при снижении массы тела от >5 до ≥15% от исходного.
Роль физической нагрузки
Важным дополнительным фактором, позволяющим улучшать состояние сердечно-сосудистой системы и снижать показатели гликемии при СД2, служит физическая нагрузка. Регулярные аэробные упражнения (т.е. с участием больших групп мышц, ритмичные) улучшают контроль гликемии и снижают уровень HbA1c на ≈0,6% [10]. Считается, что постпрандиальный период – наилучшее время для занятий физической нагрузкой. Рекомендуемая длительность занятий ≥45 минут (рис. 3).

Препараты для лечения СД
В консенсусе по ведению пациентов с гипергликемией при СД2 2022 г. уточнены позиции в отношении назначения метформина, ингибиторов натрий-глюкозного котранспортера-2 (иНГЛТ2) и агонистов рецепторов глюкагоноподобного пептида 1-го типа (арГПП-1) как препаратов первой линии, обладающих органосохраняющими свойствами (рис. 4).
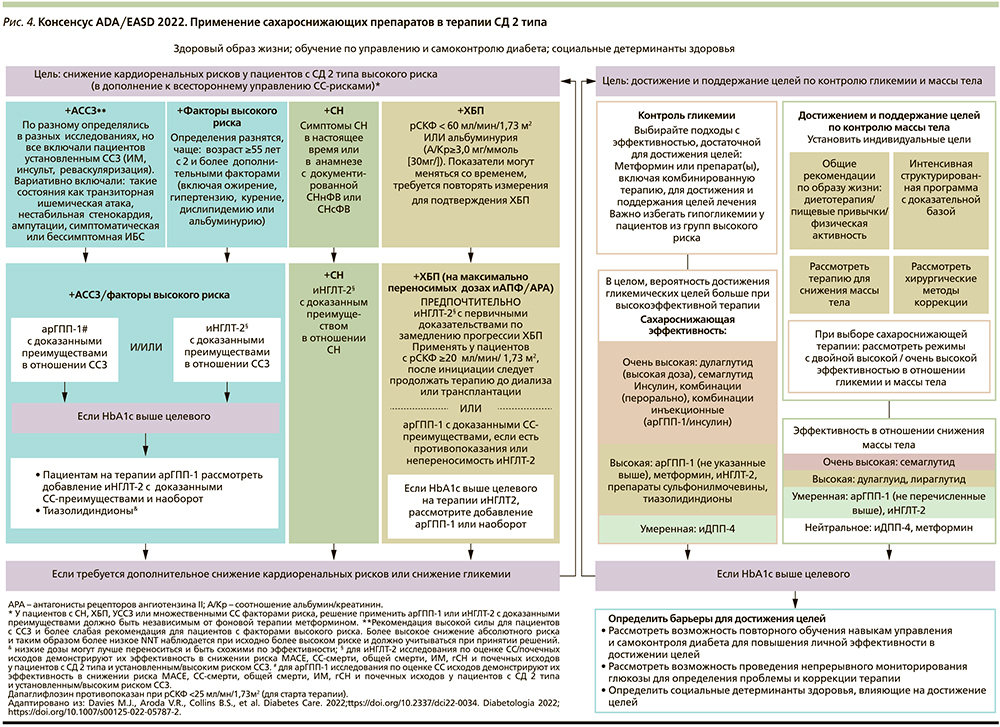
Выбор препаратов для терапии СД2 зависит от наличия сопутствующих заболеваний и цели лечения. Наиболее широко используемым препаратом первой линии остается метформин, особенно для пациентов с избыточной массой тела.
В 2016 г. внесены изменения в инструкцию по применению, согласно которой метформин не следует применять при расчетной скорости клубочковой фильтрации (рСКФ)<30 мл/мин1,73 м², а также рассматривать возможность снижения дозы при рСКФ<45 мл/мин на 1,73 м² [11].
Если пациенту требуется назначение препарата с доказанными кардиоренопротекторными свойствами, в качестве лекарственного средства первой линии целесообразно использовать арГПП-1 или ингибиторы натрий-глюкозного котранспортера-2 (иНГЛТ-2). Препараты группы арГПП-1 усиливают глюкозозависимую секрецию инсулина, подавляют секрецию глюкагона, замедляют опорожнение желудка, снижают уровень HbA1c, постпрандиальные колебания глюкозы, аппетит, потребление пищи и массу тела. В клинических исследованиях показано, что дулаглутид, лираглутид и инъекционный/пероральный семаглутид снижают риски развития комбинированных серьезных неблагоприятных сердечно-сосудистых событий (MACE) у пациентов СД2 и установленными сердечно-сосудистыми заболеваниями (ССЗ). Кроме того, дулаглутид влияет на комбинированную точку МАСЕ пациентов с СД2 и множественными сердечно-сосудистыми факторами риска. Для снижения и поддержания массы тела рекомендовано использовать подкожные инъекции лираглутида (титрация с 0,6 до 3,0 мг/сут.) или семаглутида (тиртация с 0,5 до 2,4 мг 1 раз в неделю) [12].
В исследовании AWARD-11 участвовали больные СД2 с нецелевым уровнем гликемии на мототерапии метформином. Показано, что дополнительная инъекция дулаглутида в дозе 3,0 или 4,5 мг в неделю по сравнению с дозой 1,5 мг приводила к большему снижению уровня HbA1c (-1,77 против -1,54%) и массы тела (-4,6 против -3,0 кг) [13]. В исследовании SUSTAIN FORTE изучались эффекты инъекционного семаглутида в дозе 2,0 мг по сравнению с дозой 1,0 мг в неделю (длительность наблюдения – 40 недель). Отмечено снижение уровня HbA1c от исходного значения (-2,1 против -1,9%) и массы тела (-6,4 против -5,6 кг) [14]. Не было отмечено повышения риска развития панкреатита, рака поджелудочной железы и медуллярного рака щитовидной железы на терапии большими дозами этих препаратов. Назначение арГПП-1 противопоказано людям с семейным анамнезом медуллярного рака щитовидной железы, множественной эндокринной неоплазией типа 2, вызванной С-клеточными опухолями щитовидной железы. Увеличение частоты развития ретинопатии, которое наблюдалось в исследовании SUSTAIN, 6, по-видимому, связано с величиной и скоростью снижения уровня HbA1c у лиц с уже существующей диабетической ретинопатией и высоким уровнем гликемии [15]. Терапия арГПП-1 связана с более высоким риском развития заболеваний желчного пузыря и желчевыводящих путей.
Определенной когорте пациентов с СД2 в дебюте заболевания необходимо использовать препараты группы иНГЛТ-2 с целью кардионефропротекции. В клинических исследованиях иНГЛТ-2 продемонстрировали снижение риска MACE, смерти от ССЗ, инфаркта миокарда, госпитализаций по поводу сердечной недостаточности, всех причин смертности и улучшение почечных исходов у лиц с СД2 с установленным высоким риском ССЗ. Последние данные продемонстрировали высокий уровень безопасности иНГЛТ-2. На фоне терапии иНГЛТ-2 повышен риск грибковых генитальных инфекций, которые чаще протекают в легкой форме. При назначении иНГЛТ-2 нужно обратить внимание на риск развития диабетического кетоацидоза (ДКА). Показано, что в группах активного лечения частота ДКА составляла 0,1–0,6% по сравнению с 0,1–0,3% в группе плацебо [38]. Риски побочны[ эффектов можно снижать путем обучения пациентов, прекращения приема препарата в клинических ситуациях, когда повышается риск кетоацидоза (при длительном голодании, острых состояниях, в первые 3 дня после оперативных вмешательств). В рандомизированном клиническом исследовании DARE-19, в котором участвовали пациенты с COVID-19 и СД2 на терапии дапаглифлозином, продемонстрирован низкий риск ДКА (0,3 против 0%) [17].
За последние годы опубликованы результаты завершившихся клинических исследований по кардиоренальной безопасности различных препаратов иНГЛТ-2. В исследовании VERTIS CV проведена оценка эффективности и безопасности эртуглифлозина для пациентов с СД2 и установленными ССЗ. Не было отмечено преимуществ эртуглифлозина в отношении основной точки MACE, почечных исходов, за исключением хронической сердечной недостаточности (ХСН) [18].
В июне 2020 г. завершилось международное многоцентровое рандомизированное исследование Dapa-CKD. В исследовании проведенs анализ влияния дапаглифлозина на почечные исходы и сердечно-сосудистую смерть пациентов с хронической болезнью почек (ХБП), оценка почечной и сердечнососудистой безопасности и эффективности дапаглифлозина по сравнению с плацебо для 4304 пациентов с ХБП. Пациенты с рСКФ 25–75 мл/мин/1,73 м², стойкой альбуминурией и соотношением альбумин/креатинин в моче 200–5000 мг/г наблюдались в течение 3 месяцев и более. Первичная конечная комбинированная точка включала развитие устойчивого снижения рСКФ минимум на 50% и более или тяжелой почечной недостаточности (рСКФ<15 мл/мин/1,73 м², хронический диализ, трансплантация почки), сердечно-сосудистой или почечной смерти. Вторичные исходы предусматривали оценку отдельных компонентов первичной конечной точки, случаев смерти от ССЗ или госпитализаций по поводу сердечной недостаточности (СН), случаев смерти от любой причины. Дапаглифлозин приводил к снижению первичной конечной точки на 39% (относительный риск [ОР]=0,61, 95% доверительный интервал [ДИ]: от 0,51 до 0,72; р<0,001) по сравнению с плацебо. Комбинированный показатель почечных исходов регистрировался у меньшего числа пациентов основной группы по сравнению с группой контроля: 142 (6,6%) против 243 (11,3%), что привело к снижению ОР на 44% (ОР=0,56, 95% ДИ от 0,45 до 0,68; р<0,001). На фоне приема дапаглифлозина отмечено значимое уменьшение риска сердечно-сосудистой смерти или госпитализаций, связанных с СН, на 29% (ОР=0,71, 95% ДИ: 0,55–0,92; р=0,009) и риска смерти от любых причин на 31% (ОР=0,69, 95% ДИ: 0,53–0,88; р=0,004). Дапаглифлозин по сравнению с плацебо замедлял снижение рСКФ на 0,93 мл/мин/1,73 м² в год (95% ДИ: 0,61–1,25). Наблюдался более низкий темп снижения рСКФ в группе дапаглифлозина по сравнению с плацебо у пациентов с СД2: 2,26 мл/ мин/1,73 м² в год (1,88–2,64), чем у пациентов без СД2: 1,29 мл/мин/1,73 м² (0,73–1,85). Согласно результатам исследования, более выраженный нефропротективный эффект дапаглифлозина проявлен у пациентов с СД2 с более высоким исходным уровнем HbA1c и соотношением альбумин/креатинин в моче.
На фоне приема дапаглифлозина произошло снижение уровня альбуминурии по сравнению с плацебо. Дапаглифлозин увеличивал вероятность регресса имевшейся стадии альбуминурии (ОР=1,81, 95% ДИ: 1,60– 2,05) и снижал риска ее прогрессирования (ОР=0,41, 95% ДИ: 0,32–0,52).
У пациентов с ХБП и СД2 и без него дапаглифлозин значительно снижал альбуминурию, при этом относительное снижение было бóльшим у пациентов с СД2 [16, 19]. Таким образом, результаты исследования продемонстрировали преимущества дапаглифлозина в отношении комплексной почечной точки, отдельных ее компонентов, сердечно-сосудистой смерти или ХСН.
В исследовании EMPEROR отмечено снижение показателя первичной комбинированной конечной точки сердечно-сосудистой смерти или госпитализаций по поводу сердечной недостаточности у людей с ХСН и сниженной фракцией выброса (сФВ) независимо от наличия СД2 (50% участников) [20]. В исследовании EMPERORReduced эмпаглифлозин превосходил плацебо в плане улучшения прогноза больных ХСН с ФВ≤40%. При анализе вторичных конечных точек комбинированный почечный показатель, включивший хронический гемодиализ, трансплантацию почки, устойчивое снижение рСКФ, был достоверно меньше в группе эмпаглифлозина по сравнению с плацебо: 1,6 против 3,1% (ОР=0,50, 95% ДИ: 0,32–0,77; р<0,01).
Завершилось рандомизированное двойное слепое плацебо-контролируемое исследование III фазы, в котором оценивали эффективность и безопасность эмпаглифлозина в дозе 10 мг 1 раз в сутки по сравнению с плацебо у 5988 пациентов с ХСН с ФВ (средняя ФВ левого желудочка – 54,3±8,8%). В группе эмпаглифлозина показатель МАСЕ был на 21% меньше (ОР=0,79, 95% ДИ: 0,69–0,90; р<0,001) по сравнению с плацебо (в основном за счет снижения госпитализации по поводу СН). Проведенный мета-анализ показал, что препараты группы иНГЛТ-2 снижают MACE, ХСН и комбинированные почечные исходы в общей популяции пациентов по сравнению с плацебо.
Мета-анализ влияния арГПП-1 продемонстрировал снижение MACE и его компонентов, включая инсульт, ХСН и комбинированную почечную точку [21]. При оценке МАСЕ отмечено значимое влияние арГПП-1 на инсульт, менее значимое – на сердечно-сосудистую смерть и инфаркт миокарда. [22].
Только иНГЛТ-2 воздействуют на почечную точку, включая альбуминурию, хронический гемодиализ и трансплантацию почки [23]. Препараты этой группы снижают смертность от ССЗ, но не влияют на инсульт.
На фоне комбинированной терапии метформином и иНГЛТ-2 не было получено различия в MACE, смерти от ССЗ или госпитализаций по поводу СН, основных почечных исходов и смертности принимавших и не принимавших метформин [24]. На фоне комбинированной терапии метформином и арГПП-1 не было продемонстрировано различий в MACE и смертности среди принимавших метформин по сравнению с не принимавшими [25, 26].
Как было показано в сетевом метаанализе, эффективность арГПП-1 и иНГЛТ-2 выше у пациентов с установленными ССЗ, ХБП, ХСН, чем с факторами риска [27]. Сравнительная эффективность этих двух классов препаратов для пациентов с СД2 оценена в трех сетевых мета-анализах, которые показали, что иНГЛТ-2 превосходят арГПП-1 в плане влияния на ХСН, комбинированную почечную точку, в то время как арГПП-1 более эффективны в плане снижения риска инсульта [27, 28]. Не выявлено значимых различий между этими классами по смертности и другим сердечно-сосудистым показателям.
Полученные выводы подтверждают результаты крупного популяционного когорного исследования, проведенного в США, которое показало, что иНГЛТ-2 снижают показатель ХСН по сравнению с арГПП-1 у людей как с ССЗ (ОР=0,71, 95% ДИ: 0,64–0,79) так и без ССЗ (ОР=0,69, 95% ДИ: 0,56–0,81). Различия между двумя классами препаратов в отношении смертности и сердечно-сосудистых исходов клинически не значимы [29].
Заключение
Рациональное, гипокалорийное питание в комбинации с физической активность служит основой для улучшения метаболических показателей пациентов с СД2.
Современные подходы к терапии СД2 рекомендуют использовать иНГЛТ-2 или арГПП-1 на начальных этапах терапии при наличии у пациентов с атеросклеротическими ССЗ, СН, ХБП или факторов риска атеросклеротических ССЗ, ожирения независимо от уровня НbА1с. Пациенты с СД2, высоким риском развития инсульта или ХБП и выраженной протеинурией, ожирением будут иметь максимальные преимущества при использовании препаратов группы арГПП-1. Пациентам с СД2, атеросклеротическими ССЗ, СН, ХБП или факторами риска атеросклеротических ССЗ целесообразно назначать иНГЛТ-2.
Вклад авторов. М.Б. Анциферов – разработка дизайна статьи, утверждение рукописи для публикации. О.М. Котешкова – обзор публикаций по теме статьи, написание текста рукописи.



