Большинство периферических полиневропатийсопровождается клиническими или субклиническами признаками дисфункции вегетативнойнервной системы (ВНС). Наиболеечасто поражение ВНС развиваетсяпри невропатиях “малых волокон”,когда преимущественно поражаютсятонкие, плохо миелинизированныеА-дельта нервные волокна и немиелинизированные С-волокна [16].ВНС регулирует функцию висцеральных органов, гладкой мускулатуры сосудистой стенки, эндокринных и экзокринных желез, иммуннойсистемы и трофику мягких тканей.Симптомы ее поражения включают сердечно-сосудистые, желудочно-кишечные, мочеполовые и терморегуляторные расстройства, а такжетрофические нарушения, псевдопарезы и дизрегуляцию зрачка.
Различают следующие периферические вегетативные невропатии:
• диабетическую;
• амилоидную;
• синдром Гийена–Барре;
• острые и подострые автономныеневропатии;
• аутоиммунные и паранеопластические невропатии: анти-Hu-антитела (1-й тип анти-нейрональных нуклеаоных антител, ANNA-1); антитела кклеткам Пуркинье 2-го типа (PCA-2);
CRMP-5 (Collapsin response mediatorprotein 5); нейрональные антителак никотиновым и ацетилхолиновымрецепторам; антитела к кальциевымканалам P/Q-типа; антитела к ацетилхолиновым рецепторам;
• паранеопластические невропатии,связанные с заболеваниями соединительной ткани (болезнь Шегрена,системная красная волчанка, ревматоидный артрит, смешанные заболевания соединительной ткани);
• наследственные невропатии: наследственные сенсорно-вегетативныеневропатии, болезнь Фабри, невропатия индейцев Навахо, болезньТанжера, множественная эндокринная неоплазия (тип 2b);
• невропатии при инфекциях (болезнь Чага, ВИЧ-инфекция, ботулизм,лепра, дифтерия): токсические невропатии (органические растворители, акриламид, соли тяжелых металлов, вакор, винкристин, цисплатин, паклитаксел, доксорубицин, цитозин арабинозид, амиодарон, пентамидин, препараты золота, подофиллин, токсины морскихгадов).
Сахарный диабет (СД) являетсясамой частой причиной вегетативнойневропатии (ВН) [2–6]. При этом впопуляции больных СД типа 1 достоверная ВН выявляется у 8,5 %, а вероятная –у 16,8 % больных; при СД типа 2 –у 12,2 и 22,1 % больных соответственно[9]. Показано, что факторами рискаразвития ВН являются длительноетечение СД, плохой контроль уровня гликемии и мужской пол [5, 15, 19, 25]. Кардиоваскулярные осложнения ВН являются одними из главных причин инвалидизации и летальных исходов у больных СД. Наличиеу больных СД признаков ВН увеличивает риск развития диабетическойстопы и связанных с ней осложнений[13]. С момента появления клинической симптоматики ВН ожидаемаясмертность среди больных СД в течение следующих 5 лет составляет 50 %.
Экспериментально подтвержденные связи между предрасположенностью к летальным аритмиям и признаками повышенной симпатической или пониженной парасимпатическойактивности стимулировали развитиеисследований количественных показателей вегетативной активности дляранней диагностики ВН. В настоящее время выявлена существеннаявзаимосвязь между состоянием ВНС
и смертностью от сердечно-сосудистыхзаболеваний, включая внезапнуюсмерть [20, 23, 24, 27].
Клинические проявления кардиоваскулярной ВН
Основными клиническими проявлениями кардиоваскулярной ВН являются постоянная умеренная тахикардия и фиксированный пульс, ортостатическая гипотензия, безболевая ишемия и инфаркт миокарда, снижение циркадных влияний на вегетативную функцию, повышение риска возникновения сердечных аритмий вследствие увеличения симпатических влияний, диабетическая кардиомиопатия и нарушениефункции миокарда, осложнения прианестезии и операции в виде неожиданной остановки дыхания и сердцебиения [2, 11, 26, 28]. Развитие тахикардиив начале заболевания связано с поражением блуждающего нерва при относительном преобладании активностисимпатического отдела ВНС [22]. Помере прогрессирования ВН снижаетсяактивность и симпатического отдела, что может сопровождаться исчезновением тахикардии. На этой стадииотмечается отсутствие тахикардии,а в ответ на функциональные пробыи эмоциональный стресс выявляется т. н. денервированное сердце.
Безболевая ишемия или безболевойинфаркт миокарда регистрируютсяв 45–65 % случаев ВН по сравнениюс 4 % у пациентов с СД без признаковВН. Отсутствие характерных клинических признаков нарастающей ишемииявляется фактором риска формирования инфаркта миокарда и внезапной смерти. Механизм развития безболевой ишемии комплексный. В основе его лежит дисфункция кардиальных афферентных нервных волокон и измененный порог болевой чувствительности. Показано, что кардиальная форма ВН является четким прогностическим критерием безболевой ишемиимиокарда [27]. Наличие кардиоваскулярной ВН является прогностическинеблагоприятным признаком для развития терморегуляторных и сосудомоторных нарушений [29], мочеполовых расстройств [30] и других осложненийСД, например диабетической ретинопатии [10].
Методы диагностики вегетативной дисфункции
Ввиду высокой медико-социальной значимости кардиоваскулярной ВН выявление вегетативной дисфункции является одной из наиболее приоритетных задач современной диабетологии. Существует ряд опросников [7, 17] вегетативной дисфункции (см. таблицу), но все они являются субъективными, поэтому данные, полученные при использовании опросников, носят ориентировочный характер и не могутиспользоваться для верификации диагноза ВН.
Шкала представляет собой заполняемую врачом анкету, в которой каждыйсимптом оценивается по ряду характеристик:
1. Наличие конкретного симптома – в анкете на этот вопрос отвечаютоднозначно “да” или “нет”, зачеркивая соответствующий квадрат.
2. Степень выраженности симптома –исследователь определяет степеньвыраженности симптома у данного больного: (+) – симптом слабовыражен; (++) – умеренная степеньвыраженности; (+++) – значительная выраженность симптома. 3. Изменения симптома – исследователь определяет динамику симптомакак улучшение: (+) – незначительное; (++) – умеренное; (+++) – значительное); ухудшение: (-) – незначительное; (--) – умеренное; (---) –значительное или без изменений.Для более точной диагностики этогозаболевания применяются инструментальные методы исследования.Наиболее характерными признаками кардиоваскулярной ВН на ЭКГ являются: дисперсия интервала ST, удлинение интервала QT, инверсия положительного зубца Т, псевдокоронарныйподъем сегмента ST [18]. Однако эти изменения ЭКГ появляются на поздних стадиях заболевания, когда терапия ВН уже малоэффективна.Для проведения начальной диагностики ВН наиболее широкое распространение получил метод пятистандартных тестов по Ewing D.J. [14,19]. Этот метод удовлетворяет какклиническим, так и научным требованиям [25]:
1. Изменение частоты сердечныхсокращений (ЧСС) при медленномглубоком дыхании (6 в минуту). Наблюдаемые в норме ускорение ЧССна вдохе и урежение на выдохе исчезают по мере прогрессирования недостаточности парасимпатической иннервации сердца. Разница между минимальной и максимальной ЧССв 10 ударов и менее (норма >15) свидетельствует о нарушении парасимпатической иннервации сердца.
2. Тест Вальсальвы. При повышениивнутрилегочного давления (пациентнатуживается при дыхании в мундштук, соединенный с манометром,с целью поддержания давленияв спирометре на уровне 40 мм рт. ст.в течение 10–15 секунд) в нормеЧСС увеличивается с последующейкомпенсаторной брадикардией. Принарушении парасимпатической регуляции сердечной деятельности этотфеномен выпадает. Величина отношения максимального RR-интервалав первые 20 секунд после пробы к минимальному интервалу RR вовремя пробы менее 1,2 свидетельствует о наличии у больного ВН.
3. Тест Шелонга (ортостатическаяпроба). Пациент спокойно лежит наспине в течение 10 минут, после чегоизмеряется артериальное давление(АД). Затем пациент встает, и АДизмеряется на 2-й, 4-й, 6-й, 8-й и10-й минутах. Снижение АД на 30мм рт. ст. и более считается патологическим и свидетельствует о ВН с нарушением симпатической иннервации (норма < 10 мм рт. ст.).
4. Тест 30 : 15. Тест основан на учащении ЧСС при вставании с максимальным значением к 15-му удару с последующим урежениемритма с минимальным значением к 30-му удару. Отношение 15-го RR-интервала к 30-му с моментаначала вставания при ортопробе ниже 1,0 является диагностическим критерием ВН (норма > 1,04).
5. Проба с изометрической нагрузкой.При сжатии динамометра в течение3 минут до трети максимальной силыруки отмечается подъем диастолического АД. Повышение диастолического АД менее чем на 10 мм рт. ст.говорит о ВН с недостаточной симпатической иннервацией (норма >16 мм рт. ст.).
Использование данных тестов считается достаточным для выявленияраннего, субклинического пораженияВНС, в связи с чем они более десятилетия используются как “золотой стандарт” для диагностики ВН [21].
Таблица. Шкала невропатических симптомов и изменений.
Ввиду недостаточной чувствительности и специфичности вышеуказанных методик (нормальные показателивышеуказанных тестов значительноварьируются в зависимости от возраста, пола и индекса массы тела испытуемых) может использоваться усовершенствованный вариант диагностики ВН – количественное вегетативноетестирование (КВТ). В основе КВТлежит методика регистрации и оценкивысокочастотных дыхательных колебаний сердечного ритма, предложеннаяWheeler and Watkins [33]. Обследуемыйлежит спокойно, проводится фоноваязапись ЭКГ. Затем по команде пациентдышит глубоко и регулярно с частотой шесть раз в минуту (5 секунд вдохи 5 секунд выдох). КВТ представляетсобой исследование вариабельностиритма сердца, выполняемое синхронно с глубоким дыханием частотой 6 дыхательных циклов в минуту. При такойчастоте дыхания в наибольшей степени стимулируется блуждающий нерв, поэтому проба используется для оценки реактивности парасимпатическогоотдела ВНС. При данном вариантепроведения пробы оценивается разница между максимальной и минимальной ЧСС во время дыхательного цикла или экспираторно-инспираторное отношение.
У здоровых людей интервал времени от начала цикла одного сердечногосокращения до начала другого не является одинаковым, он постоянно меняется. Первым это обнаружил Hallerв 1760 г. Периодические составляющиевариабельности ритма сердца, выделенные на основании кратковременных записей в состоянии покоя, представлены высокочастотными, низкочастотными и очень низкочастотнымиколебаниями, как правило имеющимипериодичность в 0,2–0,4, 0,04–0,15
и 0,003–0,040 Гц соответственно. Для их обнаружения наиболее оптимальной является процедура спектрального анализа ритма сердца с использованием преобразования Фурье. Низкочастотные колебания связаны с активностью постганглионарных симпатических волокон и отражают модуляцию сердечного ритма симпатической нервной системой. Генез очень низкочастотных колебаний до сих пор неясен и, вероятнее всего, связан с влиянием надсегментарных (в первую очередь гипоталамических) центров вегетативной регуляции. Высокочастотные колебания сопряжены с дыханием и отражают преимущественно влияние парасимпатической системы на сердечную мышцу. Именно эти высокочастотные колебания и подвергаются анализу в процессе КВТ.
Проведение КВТ имеет ряд методологических особенностей. Существует линейная связь между изменчивостью сердечного ритма и объемом легких: величина экспираторно-инспираторного отношения возрастает с увеличением глубины дыхания. Однако не следует требовать слишком больших усилий от обследуемого, т. к. это может привести к активации не парасимпатического, а симпатического отдела ВНС. С ростом частоты дыхания экспираторно-инспираторное отношение падает (включаются симпатические модулирующие влияния). Резонансной в системе сердце–легкие является частота дыхания 5–6 циклов в минуту.
Проявления ВН затрагивают оба эфферентных звена ВНС – симпатические и парасимпатические нервные волокна, однако с учетом более раннего и более значимого поражения парасимпатических нервных волокон при СД количественную оценку состояния ВНС при диабетической ВН целесообразно проводить именно по низкочастотному компоненту вариабельности сердечного ритма. Обладая высокой чувствительностью и селективностью, методика КВТ позволяет диагностировать ВН уже на доклиническом этапе и количественно (в перцентилях) определять степень вегетативного дефицита, что особенно важно для контроля эффективности лечения [22]. КВТ может использоваться для раннеговыявления дисфункции тонких волокон при ВН наряду с такими ультрасовременными методами диагностики,как конфокальная микроскопия [31].
Принципы лечения ВН
Несмотря на огромные достижения в понимании патогенеза и развитии методов диагностики поражения периферических нервов, проблема лечения ВН остается в центре внимания клиницистов и фармакологов. До настоящего времени не разработано метода лечения, который стал бы “золотым стандартом” терапии ВН [32].
Базисная терапия ВН при СД кардинально не отличается от терапиисенсомоторной диабетической полиневропатии. На первом месте позначимости стоит компенсация СД.Гипергликемия запускает каскад метаболических и сосудистых нарушений,вызывающих развитие сенсомоторной диабетической невропатии и ВН.В связи с этим первоочередной задачей должно быть снижение уровня
сахара до величин, близких к норме[15]. Однако даже жесткий контрольуровня гликемии не всегда гарантируетотсутствие осложнений СД со сторонынервной системы [15, 32].
При гипергликемии множество процессов (оксидативный стресс, усиленное образование конечных продуктовизбыточного гликирования белков;активация перекисного окислениялипидов, индуцибельной NO-синтазы)приводит к избыточному образованию свободных радикалов – молекул,обладающих повышенной реагентной способностью. Свободные радикалы нарушают целостность клеточных структур, в первую очередь эндотелия, вызывая эндоневральную гипоксию и приводя к развитию невропатии при диабете. Активность собственной антиоксидантной системы организма (“ловушки” свободных радикалов – супероксиддисмутаза, каталаза, глутатион и др.) при диабете снижается, что обусловливает необходимость применения экзогенных антиоксидантов для преодоления окислительного стресса. Первое место среди антиоксидантов и вообще препаратов, использующихся для патогенетического лечения диабетической невропатии, сегодня занимает α-липоевая (тиоктовая) кислота – естественный липофильный антиоксидант. Оптимальным в начале лечения считается внутривенное капельное введение тиоктовой кислоты (600 мг на 200 мл физиологического раствора) в течение 15 дней с последующим приемом 600 мг препарата в виде таблеток один раз в сутки за 30–40 минут до еды в течение 3 месяцев [1, 8, 12, 35].
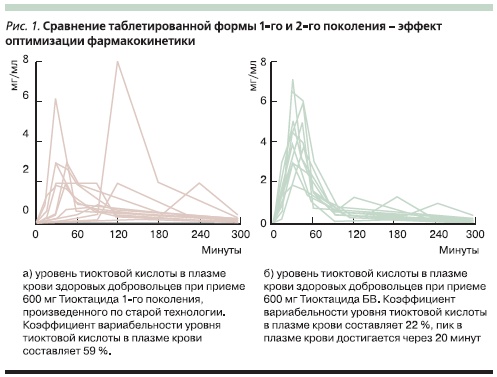
К сожалению, необходимость многократного внутривенного введенияпрепарата снижает приверженностьпациентов лечению, поэтому появление представителя нового поколениятиоктовой кислоты – Тиоктацида БВ (быстрого всасывания) – дало возможность повысить комплаентность терапии. Улучшение фармакокинетики препарата (через 20 минут достигается пик в плазме крови) и снижение коэффициента вариабельности (рис. 1) уровня тиоктовой кислоты в плазмекрови (с 59 до 22 % по сравнению с первым поколением Тиоктацида) позволяют заменить внутривенное введение препарата таблетированной формой Тиоктацида БВ в случаях умереннойвегетативной невропатии без выраженного синдрома мальабсорбции. Причем дозировка Тиоктацида БВ сохраняется прежней – 600 мг в сутки. Таким образом, с помощью БВ-формы становится возможным преодолеть резистентность к лечению полиневропатий Тиоктацидом в случаях, связанных с недостаточной абсорбцией препарата [36]. Вышеуказанные данные не могут быть экстраполированы на другие (генерические) аналоги тиоктовой кислоты, т. к. их эффективность не была подтверждена двойными слепыми рандомизированными плацебоконтролируемыми исследованиями по стандартам GCP, а главное – генерики тиоктовой кислоты до сих пор создаются с применением старых технологий, не предусматривающих БВ-форм таблетированных препаратов.
Собственный опыт
Наш собственный опыт включает динамическое наблюдение за 120 пациентами с СД типов 1 и 2 и периферической сенсомоторной невропатией на предмет наличия и оценки степени выраженности кардиоваскулярной ВН. КВТ проводилась с помощью прибора CASE IV в рамках исследования SYDNEY I [1, 12]. У 41 пациента была выявлена выраженная вегетативная кардиоваскулярная ВН с результатами 0–1 перцентиль, у 5 – умеренная ВН с результатами от 2 до 5 перцентилей. Таким образом, представленность кардиоваскулярной ВН в группе пациентов с диагностированной периферической полиневропатией оказалась достаточно высокой – более 34 %. Такая высокая распространенность ВН в исследуемой группе с неравномерным распределением в сторону более тяжелого течения может объясняться строгими критериями включения пациентов в исследование (выраженные нейрофизиологические изменения по данным электронейромиографии или КВТ).
В дальнейшем пациенты были рандомизированы в 2 группы и в течение 3 недель получали курс лечения либо Тиоктацидом в дозе 600 мг, либо плацебо внутривенно капельно в ходе двойного слепого рандомизированного клинического исследования SYDNEY I [1, 12]. Двадцать два пациента группы выраженной невропатии получали плацебо и 19 – Тиоктацид. Из пяти человек с умеренной кардиоваскулярной ВН один пациент был в группе плацебо и четыре – в группе Тиоктацида. Повторное КВТ проведено через 4 недели после первого теста. В группе с выраженной кардиоваскулярной ВН наблюдались следующие результаты: из 19 больных, получавших Тиоктацид, улучшение выявлено у 5 (26,3 %), причем у 2 пациентов параметры КВТ изменились до нормальных показателей. Из 22 больных, находившихся в группе плацебо, улучшение выявлено у 2 (9 %) человек. В группе пациентов, получавших Тиоктацид, не наблюдалось отрицательной динамики показателей КВТ
за 4 недели, в то время как в группеплацебо ухудшение параметров быловыявлено у 3 пациентов.
В группе умеренной ВН (5 человек) у 1 пациента, получавшего плацебо, никаких изменений выявлено небыло, в то время как у 2 из 4 больных,получавших Тиоктацид, наблюдаласьположительная динамика с нормализацией показателей количественного тестирования.
Таким образом, результаты проведенного обследования продемонстрировали улучшение параметров вариабельности сердечного ритма на фоне проведения инфузионной терапии Тиоктацидом в дозе 600 мг/сут в течение 15 дней, что объективно свидетельствует об уменьшении выраженности кардиоваскулярной ВН.
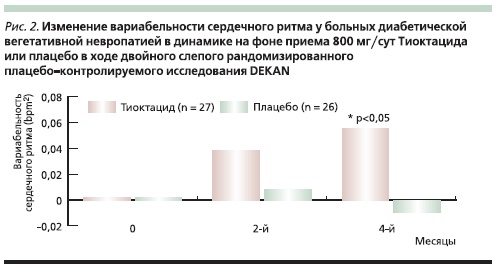
Наши результаты коррелируют с таковыми рандомизированного плацебо-контролируемого исследования DEKAN (рис. 2), в котором было продемонстрировано улучшение вариабельности сердечного ритма у пациентов с ВН при СД типа 2 на фоне лечения Тиоктацидом в таблетированной форме в дозе 800 мг/сут в течение 4 месяцев [34].
Наиболее сложной задачей терапии ВН является симптоматическое лечение ортостатической гипотензии, встречающейся у 1,0–3,4 % больных СД. Для симптоматической терапии этого состояния используют минералокортикоиды (флудрокортизон в дозе0,1–1,0 мг/сут). К препаратам второгоряда, применяемым в качестве дополнительной терапии ВН при неэффективности флудрокортизона или в качестве монотерапии при невозможности его применения, относят симпатомиметики (эфедрин, фенилпропаноламин, фенилэфрин, метилфенидат, декстроамфетамин, тирамин, мидодрин, клонидин, иохимбина гидрохлорид, DL-дегидроксифенилсерин). Синтетические аналоги вазопрессина (десмопрессин, лизин-вазопрессин), Эритропоэтин (эпоэтин бета), кофеин и ингибиторы циклооксигеназы (индометацин, флурбипрофен, ибупрофен, напроксен) относят к дополнительным препаратам, не используемым в качестве монотерапии [2].
Существуют нефармакологическиеметоды лечения этого состояния:
• медленное, постепенное изменениеположения тела;
• избегание напряжения, натуживанияи изометрических упражнений;
• использование компенсаторныхфизических упражнений;
• отмена антигипертензивных лекарственных средств;
• сон на кровати с приподнятымголовным концом;
• диета с высоким содержанием натрия(поваренной соли);
• специально разработанные комбинезоны, сдавливающие нижнюючасть тела.
Заключение
Таким образом, лечение ВН представляет собой сложную медико-социальную проблему, требующую максимального участия в процессе лечения самого пациента, а также создание окружающими необходимых условий для реабилитации на фоне проводимой патогенетической (тиоктовая кислота – Тиоктацид) и симптоматической (минералкортикоиды, симпатомиметики) терапии.



