Введение
Бронхиальная астма (БА) является широко распространенным во всем мире неинфекционным заболеванием с серьезными последствиями для общественного здоровья, характеризуется высокой заболеваемостью в любом возрасте и значительной смертностью при тяжелом течении. Воспаление и сужение просвета дыхательных путей, в т.ч. малых дыхательных путей (МДП), вызывают характерные симптомы БА, в т.ч. кашель, свистящее дыхание, одышку и стеснение в грудной клетке. По оценкам экспертов, в 2019 г. БА выявлялась у 262 млн человек и стала причиной 455 тыс. смертей [1–3]. Как известно, невозможно полностью вылечить БА, однако правильное лечение с помощью ингаляционных лекарственных средств помогает контролировать симптомы и предотвращать обострения заболевания у большинства больных, а также позволяет людям с БА вести активную полноценную жизнь.
К сожалению, в реальной клинической практике не все так благополучно и контролируемое течение БА констатируется едва ли у половины пациентов. Согласно результатам исследований, проведенных в различных европейских странах, у 45% их участников БА не контролировалась. На этом фоне обострения были весьма частым явлением: 44% респондентов сообщили, что использовали короткие курсы пероральных глюкокортикостероидов в течение предыдущих 12 месяцев, 24% посещали отделение неотложной помощи и 12% были госпитализированы [4]. В России, по данным многоцентрового исследования НИКА, в целом (при заболевании любой степени тяжести) контролируемая БА отмечалась у 23 % больных, частичный контроль и неконтролируемое течение заболевания – у 35 и 42 % соответственно [5]. Несмотря на совершенствование подходов к лечению, спустя 10 лет в нашей стране не произошло увеличения доли контролируемой БА: по результатам оценки контроля над БА с использованием валидизированных опросников показано, что среди участников исследования преобладали больные с неконтролируемой БА – 56%. Контролируемая и частично контролируемая БА диагностирована у 21 и 19% соответственно. Еще у 4% больных отмечалась тяжелая неконтролируемая БА [6]. При этом неконтролируемое течение ассоциировалось не только с тяжелыми формами заболевания, но и с БА легкого течения [7].
Плохо контролируемая БА снижает качество жизни и влияет на различные аспекты человеческой жизни, такие как повседневная активность, сон, профессиональная деятельность, психические функции, сексуальная активность [8, 9]. Другой негативной стороной низкого контроля над заболеванием является увеличение риска обострений, количества обращений за неотложной помощью и госпитализаций [10–12].
Причины недостаточного контроля БА можно разделить на несколько категорий: связанные с пациентом, оказанием медицинской помощи и терапией БА (табл. 1). Наиболее значимыми факторами со стороны пациента можно назвать ожирение, курение табака, недостаточное использование поддерживающей терапии БА, неспособность правильно использовать ингаляторы, недооценка симптомов БА [13–15].

К сожалению, серьезной проблемой по-прежнему остается недооценка степени выраженности бронхиального воспаления, даже у пациентов с легкой персистирующей или интермиттирующей БА. В исследовании непредлеченных подростков с легкой интермиттирующей БА подтверждено наличие воспалительных изменений в дыхательных путях и показана обоснованность раннего назначения ИГКС этой группе пациентов для улучшения контроля и снижения частоты обострений БА [17].
Значительный вклад МДП в патофизиологические механизмы бронхиальной обструкции и клинические проявления БА делают дистальные отделы бронхиального дерева обоснованной мишенью для фармакологического воздействия [18–20].
Оценка малых дыхательных путей
Изучение роли МДП началось в 1915 г. с работ F. Rohrer, который, проводя патологоанатомическое исследование спавшихся легких, предположил, что МДП вносят основной вклад в сопротивление дыхательных путей [21, 22]. Впрочем, это заключение оказалось ошибочным, поскольку F. Rohrer в свих аэродинамических расчетах не учел, что в воздушных легких общая площадь поперечного сечения проводящих дыхательных путей увеличивается экспоненциально по мере приближения к газообменной поверхности, и эти данные были уточнены E.R. Weibel только в 1963 г. [23]. В 1965 г. М. Green впервые рассчитал сопротивление дыхательных путей, объединив 2 важнейшие концепции, описывающие патофизиологию легких (уравнение Hagen-Poiseuille* и количественные морфометрические исследования E.R. Weibel) и продемонстрировал, что МДП составляют <10% от общего сопротивления дыхательных путей [24]. Вскоре после этого, в 1967 г., непосредственно измеряя сопротивление в дыхательных путях диаметром <2 мм (МДП) с помощью ретроградного катетера, P.T. Macklem и J. Mead подтвердили расчеты М. Green и продемонстрировали, как МДП обеспечивают очень низкое сопротивление в здоровых легких [25]. В 1968 г. термин «малые дыхательные пути» прозвучал в оригинальной статье J.C. Hogg et al., в которой описывались обструкция и высокое сопротивление МДП у пациентов с эмфиземой [26]. Исследования последующих десятилетий экспериментально подтвердили, что у здоровых людей дыхательные пути диаметром <2 мм (МДП) имеют очень низкое сопротивление, тогда как сопротивление значительно увеличивается при бронхиальной обструкции, в т.ч. у пациентов с хронической обструктивной болезнью легких (ХОБЛ). При этом различные авторы заключили, что высокое сопротивление может быть вызвано как сужением просвета, так и деформацией дыхательных путей в сочетании с признаками хронического воспаления, фиброза, закупорки бронхиальной слизью [27].
Согласно актуальным принципам Глобальной инициативы по лечению БА (GINA), спирометрия остается методом выбора при оценке функции внешнего дыхания [2]. Однако обычная спирометрия отражает главным образом факт бронхиальной обструкции, ее вариабельность и обратимость. Вклад МДП при оценке параметров форсированного выдоха можно попытаться описать значением МОС 25–75% (мгновенная объемная скорость после выдоха 25–75% форсированной жизненной емкости легких), однако лишь до определенной степени, в связи с низкой воспроизводимостью и большой вариабельностью этого показателя [28]. При бодиплетизмографии также косвенным образом определяется основной маркер патологии МДП – «воздушная ловушка», т.е. сужение и преждевременное закрытие дистальных дыхательных путей, задержка воздуха в альвеолах. Функциональным показателем, отражающим описанные процессы, может служить остаточный объем легких (ООЛ). T. Ueda et al. выявили корреляцию ООЛ с уровнем сопротивления МДП (при использовании эндобронхиальной катетеризации) и с выраженностью феномена «воздушной ловушки» (при проведении компьютерной томографии высокого разрешения). Исследователи представили повышение ООЛ и даже в большей степени отношение ООЛ к общей емкости легких (ОЕЛ) выше нормальных значений как надежный суррогатный показатель «воздушной ловушки» [29].
За последние годы разработаны более информативные тесты, которые могут лучше оценить дисфункцию МДП. В настоящее время эти методы постепенно внедряются в рутинную клиническую практику (табл. 2). Форсированная импульсная осциллография (ИО) – метод, который выявляет нарушения проходимости дыхательных путей на основе измерения различных видов бронхиального сопротивления. ИО позволяет проводить раздельную оценку периферических и проксимальных дыхательных путей и, по-видимому, является достаточно чувствительным инструментом скрининга для раннего выявления обструкции дыхательных путей [30]. Наиболее информативные в отношении периферических дыхательных путей и коррелирующие с ОФВ1 показатели ИО – резонансная частота (Fres), дистальный реактанс на 5 Гц (X5), а также бронхиальное сопротивление R5–R20 Гц (разница между общим сопротивлением дыхательных путей [R5 Гц] и сопротивлением проксимальных дыхательных путей [R20 Гц]). Поскольку у здоровых людей сопротивление МДП незначительно, показатель бронхиального сопротивления R5–R20 Гц невелик. При БА эта разница существенно возрастает, что дает возможность выявлять обструкцию МДП даже на ранних стадиях заболевания. При неконтролируемой БА значение обструкции МДП показано в исследовании S. Yixin et al. Резонансная частота и уровень бронхиального сопротивления R5–R20 Гц до приема бронходилататора короткого действия были достоверно выше в группе детей с неконтролируемой БА при сравнении с контролируемой БА и группой здоровых детей. При этом сопротивление проксимальных дыхательных путей (R20 Гц) существенно не различалось в различных группах [31].
Оценка оксида азота (NO) в выдыхаемом воздухе (FENO) служит важным маркером эозинофильного воспаления дыхательных путей и используется в клинической практике при наблюдении за пациентами с БА. Отдельная фракция NO, высвобождаемая из эпителиальных клеток дистальных дыхательных путей и альвеолоцитов II типа, отражает состояние МДП. Исследования с использованием методов, позволяющих выделить альвеолярную фракцию NO, показали более высокий уровень этого маркера у пациентов с ночными симптомами БА, а также у пациентов с тяжелой БА [32, 33]. Однако FENO и альвеолярная фракция NO могут повышаться и у пациентов с ХОБЛ независимо от статуса курения и тяжести заболевания [34, 35], а уровень показателя выше 20 ppb может быть связан с более высоким риском обострения [36].
Еще одним неинвазивным методом диагностики поражения МДП является тест вымывания азота при одиночном вдохе кислорода или множественном дыхании. Вентиляционная неравномерность и задержка воздуха в альвеолах в тесте вымывания азота при одиночном вдохе кислорода отражаются во время III и IV фаз кривой вымывания азота, в т.ч. по наклону кривой III фазы. «Воздушная ловушка» характеризуется двумя показателями: объемом закрытия и емкостью закрытия. При множественном дыхании в каждом дыхательном цикле анализируется кривая вымывания азота, по которой рассчитывается угол наклона III фазы, а также строится кривая, по которой можно оценить распределение вентиляции в проводящей (Scond) и респираторной зонах (Sacin).
Работы последних лет показывают, что увеличение емкости закрытия может коррелировать с тяжестью течения БА. A. Bourdin et al. сравнили результаты теста вымывания азота у больных БА различной степени тяжести (в т.ч. с нормальными спирометрическими показателями) и здоровых волонтеров. Результаты показали, что поражение МДП коррелирует с такими клиническими характеристиками БА, как уровень контроля и частота обострений [38]. В другом исследовании S. Battaglia et al. продемонстрировали взаимосвязь значений емкости закрытия и маркера воспаления в дыхательных путях – NO в выдыхаемом воздухе [39]. Уровень NO в выдыхаемом воздухе увеличивается даже при интермиттирующем течении БА. Отдельная фракция NO, освобождаемая из эпителиальных клеток дистальных дыхательных путей и альвеолоцитов II типа, отражает состояние МДП. Исследования с использованием методов, позволяющих выделять альвеолярную фракцию NO, показали более высокий уровень этого маркера у пациентов с ночными симптомами БА, а также у пациентов с тяжелой БА [40, 41].
Компьютерная томография (КТ) стала весьма полезным инструментом для неинвазивной оценки заболеваний МДП у пациентов с ХОБЛ и тяжелой БА. Кардинальным КТ-признаком заболевания МДП при БА является наличие «воздушных ловушек», которые визуализируются на экспираторных КТ как уменьшенные в объеме участки пониженной плотности [42–44]. «Воздушные ловушки» отражают задержку воздуха в альвеолах, связанную с обструкцией и/или ремоделированием МДП [45, 46]. Количественная оценка «воздушных ловушек» может предоставлять дополнительную информацию об эффективности ингаляционной терапии, достигающей МДП, дисфункцию которых не удается зафиксировать функциональными тестами [47]. Недавнее исследование А. Busacker et al. показало, что, используя оценку МДП с помощью КТ, можно выявить пациентов с высоким риском тяжелого течения БА. Так, распространенность «воздушных ловушек» коррелировала с частотой посещений отделений интенсивной терапии, госпитализаций по поводу БА и риском проведения искусственной вентиляции легких при тяжелых обострениях БА [48]. Новые возможности КТ высокого разрешения позволяют проводить прямую оценку ремоделирования МДП: компьютерный трехмерный анализ структуры дыхательных путей позволяет более точно измерять стенки дистальных дыхательных путей, что может иметь высокую корреляцию с параметрами ограничения воздушного потока у пациентов с БА [49]. Необходимо подчеркнуть, что регулярная оценка патологии МДП с помощью КТ в настоящее время не является частью рутинной клинической практики ведения пациентов с БА.
Нельзя не отметить, что «золотого» стандарта в диагностике изменений МДП на сегодняшний день не существует. Дальнейшие исследования должны быть направлены на изучение результатов комбинированной оценки с использованием различных неинвазивных методов для раннего выявления патологии периферических дыхательных путей [50].
Распространенность патологии малых дыхательных путей при бронхиальной астме
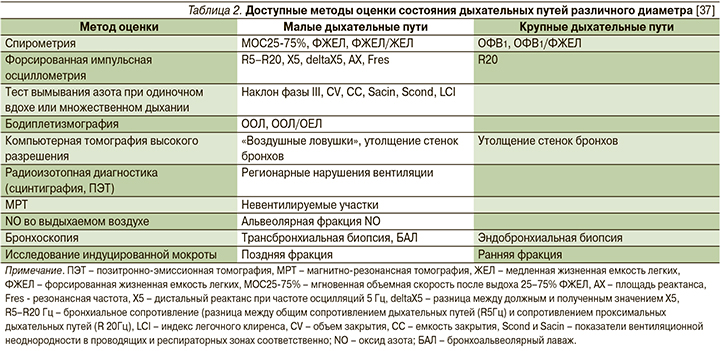
В целом, как показывают различные исследования, распространенность вовлечения МДП у пациентов с БА составляет около 50–60% [51–54]. При этом вовлечение МДП происходит независимо от тяжести течения БА, как показано на основании результатов ИО в когорте из 400 пациентов, находившихся на различных ступенях терапии, согласно GINA: патология МДП выявлена у 58,3% пациентов на ступени 2, у 60,9% – на ступени 3, у 63,3% – на ступени 4 и у 78,6% – на ступени 5 [55]. Не случайно, что патологический процесс в МДП более распространен при тяжелой БА, это подтверждается другими исследователями при обследовании больных на 4–5-й ступенях терапии [53].
В исследовании ATLANTIS, крупнейшем международном исследовании, изучавшем МДП, с помощью различных доступных методов оценки убедительно продемонстрировано, что МДП вовлечены в воспалительный процесс у 90,7% больных БА любой степени тяжести [51] (рис. 1).
Роль малых дыхательных путей
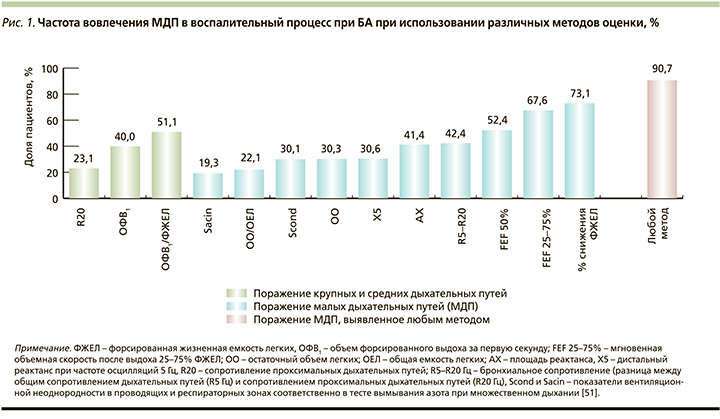
Независимо от распространенности при БА выявление патологии МДП может коррелировать со специфическими клиническими особенностями и более низким уровнем контроля над заболеванием [52]. Игнорирование этих ключевых аспектов снизило бы шансы на поддержание контроля над БА. Хорошо известны доказательства особой роли МДП для пациентов с тяжелой/неконтролируемой БА, для пациентов старших возрастных групп, особенно с длительным анамнезом БА, для курящих больных БА, наличием постоянной обструкции воздушного потока, для пациентов с ночными симптомами и симптомами, вызванными физической нагрузкой [56–59]. В большинстве ранних исследований анализировалась связь отдельных признаков БА с патологией МДП. В более поздних исследованиях проводился многофакторный анализ и моделирование, которые показали, что симптомы, вызванные физической нагрузкой, избыточная масса тела/ожирение, ночные симптомы, старший возраст, курение, Т2-тип воспаления и выраженная гиперреактивность бронхов являются сильным независимым предиктором вовлечения МДП у пациентов с БА [52, 53, 60, 61]. Эти ассоциации могут помочь в выделении популяции пациентов с преобладанием патологии МДП, особенно когда не может быть выполнена ИО или спирометрия оказывается малочувствительной в оценке состояния МДП.
Есть ли польза от фармакологической коррекции патологии МДП?
Воспалительный процесс при БА затрагивает как крупные, так и периферические дыхательные пути. Создание более высокой депозиции ИГКС в легких, а также во всех крупных и мелких дыхательных путях может улучшить эффект противовоспалительной терапии.
Технологические достижения последних лет в области разработки форм лекарственных средств и ингаляционных устройств доставки в бронхи привели к появлению нового поколения ингаляторов, генерирующих лекарственный аэрозоль с экстрамелкими частицами (с масс-медианным аэродинамическим размером частиц <2 мкм) с меньшей скоростью и большей продолжительностью распыления, с более высокими показателями легочной депозиции и более эффективным проникновением аэрозоля в МДП [62–64]. Хорошо известны устройства в форме гидрафторалканового (ГФА) дозированного аэрозольного ингалятора (ДАИ), доставляющие аэрозоли ИГКС (например, беклометазона дипропионат, циклесонид и флунизолид), длительно действующие β2-агонисты (ДДБА; например, формотерол) и комбинацию ИГКС/ДДБА в фиксированных дозах (например, беклометазона дипропионат/формотерол). Кроме того, недавно были разработаны многодозовый порошковый ингалятор, который доставляет комбинацию ИГКС/ДДБА с экстрамелкими частицами (беклометазона дипропионат/формотерол), и ингалятор с «мягким» аэрозолем (soft-mist), который доставляет аэрозоли бронходилататоров длительного действия (тиотропия бромид и олодатерол). Способность модифицированных аэрозолей с большей «уверенностью» достигать дистальных дыхательных путей позволяет ожидать лучшего контроля симптомов БА, снижения риска обострений, а также уменьшения нежелательных эффектов за счет более низкого орофарингеального распределения [20, 65].
Продолжительный период применения в широкой клинической практике, а также проведение контролируемых клинических исследований позволили выявить некоторые преимущества в лечении пациентов с БА при использовании экстрамелкодисперсных (ЭМД) форм ИГКС по сравнению с противовоспалительными препаратами, содержащими частицы стандартного размера (с масс-медианным аэродинамическим размером частиц 2–4 мкм).
Рандомизированные контролируемые исследования, в которых сравнивалась краткосрочная эффективность ЭМД беклометазона дипропионата и циклесонида с ИГКС с частицами стандартного размера, показали, что ЭМД-формы обеспечивают эквивалентную клиническую эффективность (в т.ч. влияние на симптомы БА и качество жизни) при назначении в дозе, равной половине дозы стандартных ИГКС [66–69]. В наблюдательных исследованиях БА во всех возрастных группах сообщалось о результатах сопоставимой или более высокой эффективности (при значительно меньших дозах) ЭМД беклометазона дипропионата и циклесонида в качестве монотерапии или комбинированной терапии с ДДБА по сравнению с ИГКС с более крупными частицами [70–76]. Мета-анализ 7 исследований с участием 33 453 больных БА в возра-сте 5–80 лет показал, что ЭМД беклометазона дипропионат и циклесонид ассоциировались с большей вероятностью достижения контроля БА при сравнении с ИГКС со стандартными частицами (отношение шансов – 1,34 [95% ДИ: 1,22–1,46]) [77]. Результаты когортного исследования 1244 пациентов с БА показывают, что противовоспалительная терапия с применением циклесонида связана с лучшими исходами БА в течение 1 года наблюдения, меньшей вероятностью модификации базисной терапии из-за ее неэффективности в течение этого года по сравнению с немелкодисперсными ИГКС (флутиказона пропионат и беклометазона дипропионат). В исследование включались курящие и некурящие, пациенты с хорошей и плохой техникой ингаляции, стабильной и нестабильной БА, а также с хорошей и плохой приверженностью к терапии. Медиана (межквартильный диапазон) предписанных доз циклесонида и неэкстрамелкодисперсных ИГКС составила 160 (160–160) мкг/сут. и 500 (250–500) мкг/сут. соответственно (р<0,001). В течение 1 года наблюдения у пациентов, получавших циклесонид, отмечались более низкая частота тяжелых обострений (скорректированный коэффициент частоты – 0,69 [95% ДИ: 0,53–0,89]) и более высокие показатели контроля БА (скорректированный коэффициент частоты – 2,08 [95% ДИ: 1,68–2,57]), чем у тех, кто принимал ИГКС с более крупными частицами. Вероятность смены терапии на фоне приема циклесонида оказалась ниже и составила 0,70 (0,59–0,83) [78].
В другой клинической ситуации при лечении пациентов с нетяжелым обострением БА ЭМД циклесонидом в высоких дозах (1280 мкг в сутки) привело к более быстрому клиническому улучшению по сравнению с использованием высоких доз ИГКС со стандартным размером частиц (1000 мкг флутиказона пропионата или 1280 мкг будесонида). Назначение циклесонида в этом исследовании позволило снизить риск эскалации противовоспалительной терапии с применением системных глюкокортикостероидов, а также назначения антибактериальной терапии [79].
В различных исследованиях лечение ЭМД ИГКС ассоциировалось с низкой частотой нежелательных эффектов, прежде всего за счет орофарингеальные проявлений, таких как кандидоз, дисфония, фарингит, характерных для ИГКС и связанных с депозицией активного лекарственного вещества в верхних дыхательных путях. Исследования взрослых и подростков выявили отсутствие достоверной разницы в частоте развития орофарингеальных нежелательных эффектов на фоне лечения ЭМД циклесонидом независимо от дозы (от 80 до 640 мкг в сутки) по сравнению с плацебо [80–82]. При сравнении с другими ИГКС циклесонид также демонстрировал лучшую переносимость. Так, в систематическом обзоре ряда исследований, включившем 6846 пациентов, R. Engelstatter et al. показали, что частота орофарингеальных нежелательных эффектов на фоне терапии циклесонидом была достоверно ниже по сравнению с другими ИГКС [82].
Совсем недавно в начале декабря 2022 г. в России зарегистрирован первый отечественный ЭМД циклесонид (Асмалиб® Эйр, компания «ПСК Фарма») [83]. По результатам исследования аэродинамического распределения частиц in vitro, а также сопоставимости состава препаратов (действующих и вспомогательных веществ), лекарственных форм и схожих по принципу действия ингаляционных устройств получены данные о фармацевтической эквивалентности воспроизведенного лекарственного препарата «Асмалиб® Эйр аэрозоль для ингаляций дозированный, 40 мкг/доза, 80 мкг/доза, 160 мкг/доза и референтного лекарственного препарата «Альвеско® в тех же дозах [84].
В открытом рандомизированном исследовании 132 пациентов в возрасте от 18 до 70 лет с частично контролируемой БА Асмалиб® Эйр в дозе 320 мкг в сутки продемонстрировал не меньшую клиническую эффективность по сравнению с Альвеско® в отношении динамики показателей функции внешнего дыхания, уровня контроля. В результате сравнительного анализа нежелательных эффектов по частоте и выраженности не было выявлено различий между лечебными группами [85].
Заключение
Несмотря на значительный прогресс в диагностике и лечении больных БА, отсутствие полного контроля – распространенная проблема независимо от тяжести заболевания. Персистирующие нарушения функции легких, одышка, кашель, свистящее дыхание и чувство стеснения в грудной клетке – основные признаки неконтролируемого состояния. МДП могут играть значительную роль в патогенезе нестабильной и тяжелой БА. ЭМД ИГКС, по-видимому, лучше проникают в МДП, что может обеспечивать более выраженный противовоспалительный эффект и оказывать положительное влияние на симптомы БА. Это подтверждается данными клинических исследований. ЭМД циклесонид улучшает течение и уровень контроля над БА у пациентов с различной исходной тяжестью заболевания, что достигается за счет оптимальных фармакокинетических и фармакодинамических свойств аэрозоля, позволяющих создавать максимальную депозицию в МДП и уменьшать вероятность развития местных и системных нежелательных эффектов.



