Введение
На сегодняшний день существует клиническое определение бронхиальной астмы (БА), достигнутое путем консенсуса специалистов в области пульмонологии, педиатрии, респираторной медицины. Бронхиальная астма (БА) является гетерогенным заболеванием, характеризующимся хроническим воспалением дыхательных путей, наличием респираторных симптомов, таких как свистящие хрипы, одышка, заложенность в груди и кашель, которые варьируются по времени и интенсивности и проявляются вместе с вариабельной обструкцией дыхательных путей [1].
В современной клинической практике гетерогенность БА напрямую связана как с факторами «влияния на болезнь», так и «особенности заболевания» (фенотипы заболевания). Это важно понимать, поскольку патогенетическая (целевая, таргетная) терапия определенного фенотипа БА обладает максимальным клиническим эффектом, в то время как устранение факторов «влияния на болезнь» является универсальной стратегией «контроля бронхиальной астмы» (см. таблицу) [2].

Определение фенотипических проявлений заболевания (персонализированная медицина) на основании отбора специфических групп пациентов (выделение субпопуляций, фенотипических кластеров) позволяет выполнять патогенетическую терапию на основании конкретных диагностических тестов. При подтверждении предполагаемого фенотипа возможны целевая (таргетная) терапия БА и персонифицированные методы профилактики [3].
Выделяют пять основных фенотипов бронхиальной астмы [2]:
- Аллергическая БА: часто распознаваемый фенотип, при котором БА начинается с детства, связана с наличием аллергических заболеваний (дерматит, ринит, пищевая аллергия). Для этого фенотипа БА характерно эозинофильное воспаление дыхательных путей. Пациенты с аллергической БА хорошо отвечают на терапию ингаляционными глюкокортикостероидами (ИГКС), являющуюся для них патогенетической.
- Неаллергическая БА: встречается у взрослых пациентов и не связана с аллергией. Профиль воспаления таких пациентов является эозинофильным, нейтрофильным, смешанным или малогранулоцитарным. В зависимости от характера воспаления возможна рефрактерность к терапии ИГКС и высокая чувствительность к антагонистам лейкотриеновых рецепторов (АЛТР) и к длительно действующим β2-агонистам (ДДБА).
- БА с поздним дебютом: в ряде случаев БА, особенно у женщин, развивается впервые во взрослом состоянии с явлений риносинуситов. Такие пациенты часто не имеют аллергии, рефрактерны к ИГКС и восприимчивы к терапии АЛТР.
- БА с фиксированной обструкцией дыхательных путей: встречается у пациентов с БА с длительным анамнезом заболевания. Вследствие ремоделирования бронхиальной стенки развивается фиксированная обструкция дыхательных путей, рефрактерная к терапии ИГКС и ДДБА.
- БА у лиц с ожирением: имеет выраженные респираторные симптомы, не связанные с эозинофильным воспалением. Такие пациенты не имеют аллергии, рефрактерны к ИГКС, ДДБА, терапии АЛТР. Контроль БА наступает при снижении массы тела на величину от 10 до 15%.
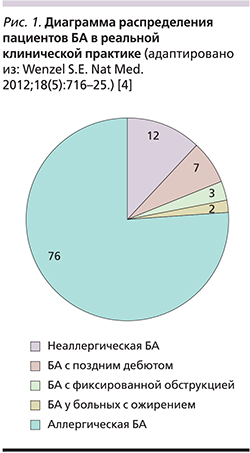 Несмотря на разнообразие фенотипов БА, наиболее часто встречаемой в реальной клинической практике считается аллергическая БА (рис. 1) [4], подходы к терапии которой изложены в международном консенсусе GINA «Global Strategy for Asthma Management and Prevention» пересмотра 2018 г. [1]. Более того, в вопросах существования перекреста воспалительных ответов, например существования клинического фенотипа «Asthma-COPD Overlap Syndrome» (синдром перекреста БА и хронической обструктивной болезни легких – ХОБЛ) у пациентов с БА, в GINA-2018 г. существует четкая клиническая позиция. Она аргументированно изложена и заключается в том, что возможно существование двух болезней у одного пациента без альтернативы перехода БА в ХОБЛ, и наоборот. Другими словами, постулируется отсутствие синдрома перекреста (отдельного фенотипа «БА–ХОБЛ»), что на практике предусматривает различные стратегии безопасной/эффективной терапии для пациентов с БА и пациентов с ХОБЛ. Например, терапия БА никогда не использует двойную бронходилатацию как «терапию первой линии», поскольку большинство пациентов имеют аллергическую БА и приоритет имеют ИГКС. Напротив, терапия ХОБЛ никогда не использует ИГКС как «терапию первой линии», поскольку пациенты имеют «воздушные ловушки», высокочувствительные к терапии пролонгированными бронхолитиками, например к комбинации длительно действующего антихолинергика (ДДАХ)+ДДБА [1].
Несмотря на разнообразие фенотипов БА, наиболее часто встречаемой в реальной клинической практике считается аллергическая БА (рис. 1) [4], подходы к терапии которой изложены в международном консенсусе GINA «Global Strategy for Asthma Management and Prevention» пересмотра 2018 г. [1]. Более того, в вопросах существования перекреста воспалительных ответов, например существования клинического фенотипа «Asthma-COPD Overlap Syndrome» (синдром перекреста БА и хронической обструктивной болезни легких – ХОБЛ) у пациентов с БА, в GINA-2018 г. существует четкая клиническая позиция. Она аргументированно изложена и заключается в том, что возможно существование двух болезней у одного пациента без альтернативы перехода БА в ХОБЛ, и наоборот. Другими словами, постулируется отсутствие синдрома перекреста (отдельного фенотипа «БА–ХОБЛ»), что на практике предусматривает различные стратегии безопасной/эффективной терапии для пациентов с БА и пациентов с ХОБЛ. Например, терапия БА никогда не использует двойную бронходилатацию как «терапию первой линии», поскольку большинство пациентов имеют аллергическую БА и приоритет имеют ИГКС. Напротив, терапия ХОБЛ никогда не использует ИГКС как «терапию первой линии», поскольку пациенты имеют «воздушные ловушки», высокочувствительные к терапии пролонгированными бронхолитиками, например к комбинации длительно действующего антихолинергика (ДДАХ)+ДДБА [1].
В соответствии с рекомендациями GINA-2018 г. терапия пациентов с БА предусматривает 5-ступенчатую терапию: препаратами, купирующими приступ – «реливеры» (от англ. reliever – ослабитель, ослабляющий), и препаратами, контролирующими болезнь, – «контроллеры» (от англ. controller – управляющий, регулирующий) (рис. 2) [1].
В этом нет ничего странного, поскольку главными целеполагающими принципами лечебной доктрины БА являются:
- предотвращение обострений бронхиальной астмы – состояний, способных драматически уменьшать функциональный резерв с формированием стойкой дыхательной недостаточности (ДН);
- формирование устойчивого контроля симптомов БА – состояния длительного отсутствия каких-либо проявлений болезни в дневное время, при физической активности, в период сна, без дополнительной необходимости приема лекарственных препаратов.
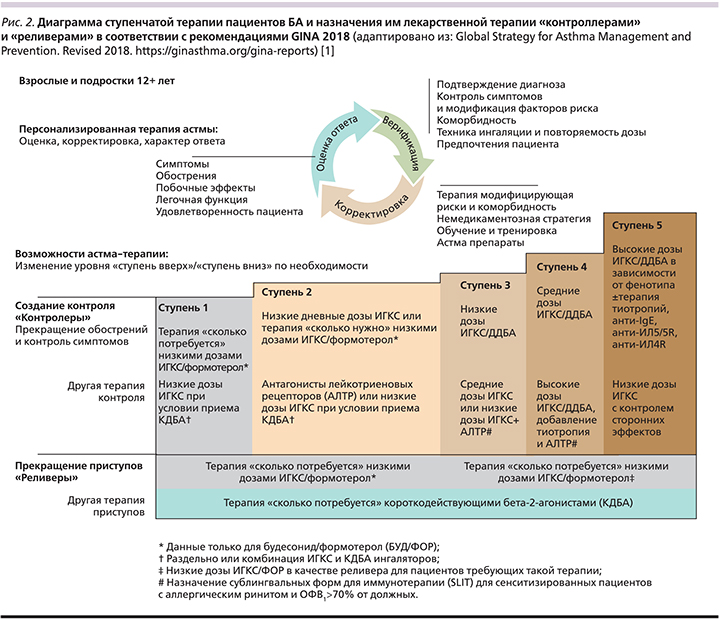
Достижение указанных целей невозможно без постоянной системы («круга наблюдения») оценки основных точек контроля: наличия диагноза/болезненности, лекарственной терапии и других/немедикаментозных способов лечения, персонализированного ответа пациента на терапию. Предполагается, что такую оценку практикующий специалист должен выполнять каждые три месяца в течение первого года наблюдения за пациентами с БА для установления тяжести заболевания, уровня базисной лекарственной терапии и других/немедикаментозных способов воздействия. Выполнимость таких рекомендаций для практических специалистов в различных странах оценивается как «реалистичная» и «выполнимая» в повседневной врачебной практике. Более того, существующие в настоящее время средства доставки лекарства и комбинированные фармакологические субстанции полностью удовлетворяют задачам ступенчатой терапии БА по GINA-2018, что должно существенно уменьшать смертность и инвалидизацию таких пациентов [5].
Одно из масштабных исследований контроля астмы, НИКА, посвященное оценке уровня контроля БА у 1000 больных из 26 амбулаторных лечебных учреждений в 12 городах Российской Федерации, установило контролируемость астмы только у 23% больных, частичный контроль и неконтролируемое течение заболевания – у 35 и 42% соответственно. При диагностике уровня контроля лечащие врачи совершали ошибки в 49% случаев. Применение специализированных тестов ACQ-5 (Asthma control questionnaire) и ACT (Asthma Control Test) давало более высокое и примерно сопоставимое качество оценки контроля (64 и 60% адекватных оценок), но при этом у ACT отмечалась систематическая погрешность в сторону завышения уровня контроля БА по сравнению с критериями GINA (рис. 3) [6].
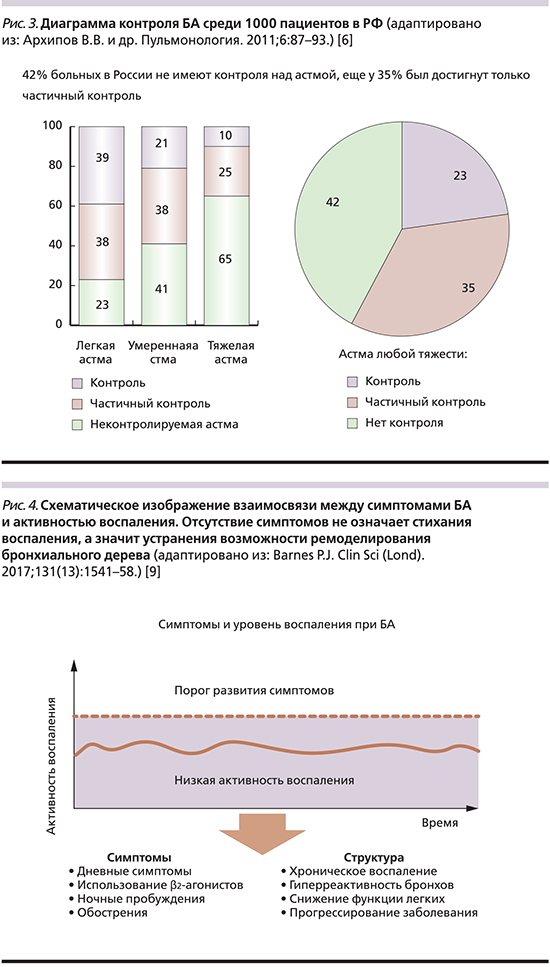
На практике эти скупые цифры говорят о том, что трое из четверых пациентов с БА не контролируют свою болезнь, несмотря на все имеющиеся предпосылки! Более того, плохой контроль БА приводит к необоснованным медицинским затратам (прямым и непрямым) на лекарственное обеспечение, стационарную и амбулаторную помощь, что делает концепцию ступенчатой терапии GINA невыполнимой в реальной клинической практике [7].
1. Стратегия разумной терапии БА
Принимая во внимание данные клинического исследования НИКА и реальную клиническую практику в Российской Федерации, мы попытались оценить разумность терапии пациентов с БА, основываясь на главных постулатах международной концепции GINA-2018. Под «разумностью» мы понимали характеристику знания с точки зрения его соответствия некоторым принципам мышления [8]. Другими словами, мы анализировали подходы к терапии БА с позиции осмысленного (размышляющего) поведения врача, основанного на знаниях в соответствии с критериями «добросовестной клинической практики» (GCP) и «медицины, основанной на доказательствах» (EBM). Более того, в своих рассуждениях мы постарались руководствоваться тремя основными принципами, выручающими любого современного специалиста в трудной и запутанной ситуации: 1) эрудиция (знание); 2) навык (действие); 3) компетентность (применение).
1.1. Предпосылки к универсальности терапии большинства пациентов с БА
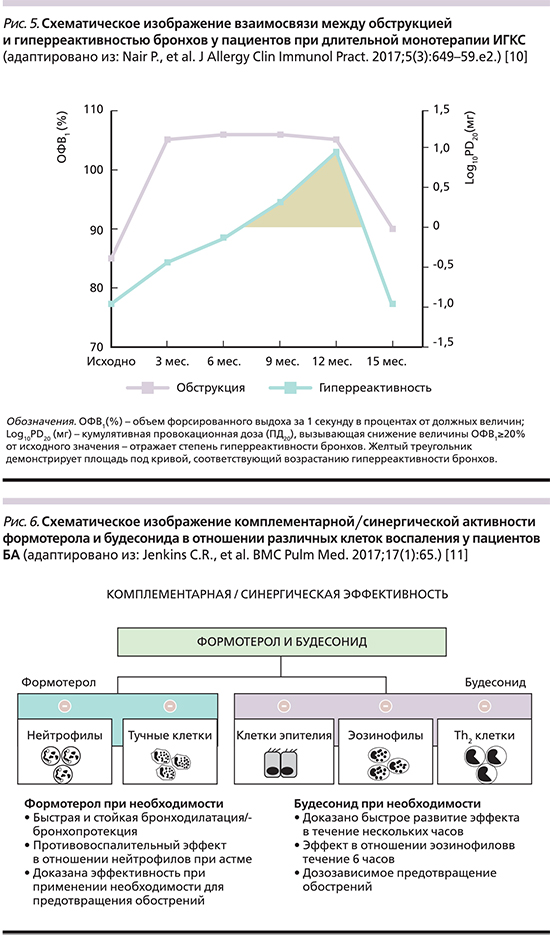
Как уже говорилось выше, большинство пациентов с БА имеют аллергический фенотип заболевания. Это означает, что мы должны всерьез рассматривать длительную терапию ИГКС как основополагающую стратегию лечения таких пациентов. Необходимо учитывать и тот факт, что существует достоверная разница между порогом симптомов заболевания и уровнем воспалительных изменений. Другими словами, отсутствие симптомов заболевания не означает прекращения особого (чаще эозинофильного) воспаления и последующего ремоделирования (утраты структуры) бронхиального дерева (рис. 4) [9].
Клиническое значение данного феномена объясняет необходимость длительного сохранения поддерживающей терапии БА (например, с помощью ИГКС), несмотря на отсутствие симптомов болезни. Это «убивает» концепцию ступенчатости терапии астмы (ступень вверх/вниз), поскольку на практике большинство пациентов с БА самостоятельно отменят любую регулярную терапию в отсутствие симптомов. Даже больше! Существующая «стероидофобия» среди большинства пациентов с БА сделает стратегию монотерапии астмы с помощью ИГКС практически невыполнимой. Важно учитывать и факт существования нарастающей «гиперреактивности бронхов» – усиление вариабельности просвета бронхов на факторы, к которым остальные лица устойчивы – при длительной ИГКС-терапии. Так, в исследовании P. Nair et al. (2017) убедительно показано, что у пациентов с БА при длительной монотерапии ИГКС происходит существенное нарастание гиперреактивности бронхов уже с 6-го месяца лечения, несмотря на устойчивое отсутствие обструкции (рис. 5) [10].
Таким образом, разумная терапия пациентов с БА должна включать длительное применение комбинации ИГКС/ДДБА для создания устойчивого подавления воспаления и гиперреактивности бронхов. Другим важным аргументом в пользу длительного выполнения комбинированной терапии ИГКС/ДДБА следует считать синергизм действия лекарственных субстанций по устранению воспалительной реакции у пациентов с БА. Такое взаимодействие позволяет существенно уменьшать дозу каждого из компонентов без потери эффективности терапии. Закономерно, что уменьшение «стероидной нагрузки» существенно снижает риски побочных эффектов и осложнений, особенно в случае тяжелого течения БА. Наиболее разумна комбинация ИГКС/ДДБА, обладающая максимальным терапевтическим эффектом как на воспаление типа «Th1» (воспалительные клетки, производные от Т-хелперов 1-го типа, например нейтрофилы и макрофаги), так и на воспаление типа «Th2» (воспалительные клетки, производные от Т-хелперов 2-го типа, например эозинофилы и тучные клетки). Оптимальным признается сочетание будесонида (БУД) и формотерола (ФОР) (рис. 6). Наличие высокой комплементарной/синергической активности БУД/ФОР в отношении основных клеток воспаления при различных фенотипах пациентов с БА делает такую терапию практически универсальной. С другой стороны, она практически безопасна, поскольку используемые в комбинации дозы БУД/ФОР имеют «широкое терапевтическое окно». Например, устоявшаяся дозировка 160/4,5 мкг имеет «окно возможностей» в 12 ингаляционных доз, что на практике никогда не используется для регулярной терапии пациентов с БА [11].
1.2. Новые алгоритмы и их универсальность в терапии пациентов БА
Следует признать, что в рекомендациях GINA-2018 отражены современные подходы к терапии пациентов с БА. Они, к сожалению, остаются мало понятными практикующему специалисту (рис. 2). В чем же проблема? Мы считаем, что это связано с плохим пониманием врачами практических возможностей современной терапии БА. Остановимся подробнее на этом.
Во-первых, начиная с первой ступени GINA новая стратегия терапии БА предусматривает дозирование в режиме «quantum satis» (по потребности). При этом в качестве действующих субстанций разумно выбрана комбинация БУД/ФОР как наиболее изученная, эффективная, безопасная, с широким «терапевтическим окном действия». Более того, на ступенях терапии 1–2 по GINA, где ранее предусматривалась только терапия низкими дозами ИГКС, на сегодняшний день в качестве контроллера и реливера используется одна и та же комбинация! Фактически позиционируется возможность терапии комбинацией БУД/ФОР в низкой дозе «по потребности» для большинства пациентов с БА! Задумайтесь! Фактически «единый ингалятор» выполняет функции лечения и контроля БА в случае дозирования «по требованию» у пациентов, обученных правильной технике ингаляций и знающих «терапевтическое окно» возможностей. Именно поэтому в случаях терапии ««quantum satis» важнейшим является обучение пациента правилам использования ингалятора и правильный выбор средства доставки лекарственной дозы. На сегодняшний день существует более 145 видов дозированных ингаляторов порошковых и аэрозольных субстанций. Многие из них рассчитаны на ингаляцию «чистых» порошковых субстанций («чистые» от отсутствия в них «стабилизаторов» и растворителей). Нужно помнить о том, что сила вдоха пациента (обычно более 30 л/мин) является определяющей для выбора средства доставки лекарства посредством «сухой пудры». Такую и бóльшую скорость вдоха обычно развивают пациенты с БА с объемом форсированного выдоха за 1 секунду (ОФВ1) более 50% от должных величин, поэтому в отношении них возможно рассматривать турбухалер в качестве универсального ингалятора (рис. 7) [12].

Простота использования и хорошая воспроизводимость дозы при выполнении каждой ингаляции пациентам с БА, ранее обученных технике «правильного вдоха» через турбухалер, позволяют в повседневной врачебной практике использовать режим единого ингалятора с дозированием «quantum satis» с высокой разумностью и эффективностью.
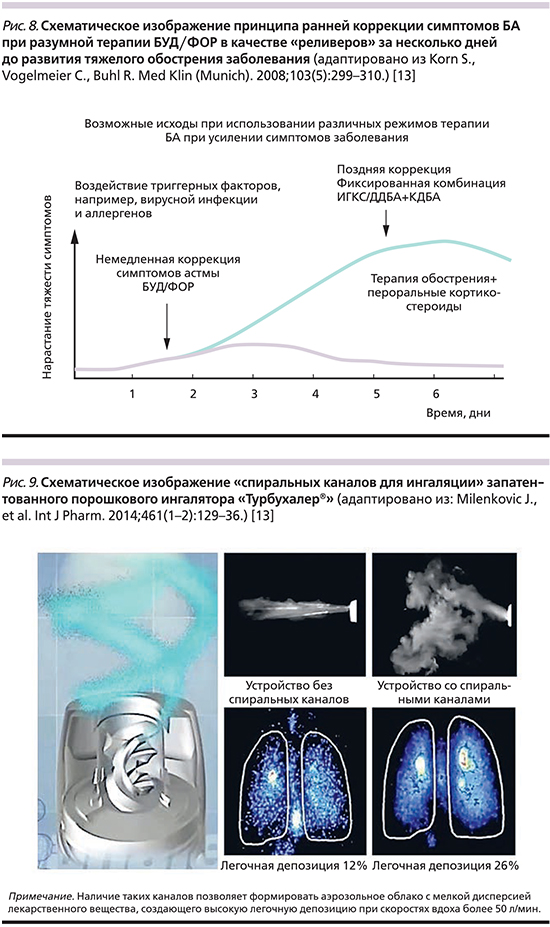
Во-вторых, для ступеней терапии БА (от третьей к пятой) предусмотрена таковая комбинацией БУД/ФОР в низких (80/4,5 мкг), средних (160/4,5 мкг) и высоких (320/9 мкг) дозах. При этом необходимо помнить, что высокие дозы ИГКС/ДДБА не позволяют свободно варьировать уровнем терапии и проводить быструю замену одного лекарственного средства на другое в случае развития сторонних реакций. Более того, необходимость дополнительного назначения анти-IgE (иммуноглобулин Е), анти-ИЛ-5/5R, анти-ИЛ-4R, системных стероидных препаратов настолько сужает «окно возможностей» ИГКС, что их назначение даже в низких дозах потребует обоснования. Однако, несмотря на ограничения в терапии контроллерами, использование фиксированной комбинации БУД/ФОР в качестве реливера не только возможно, но и необходимо! Это разумно следует из возможностей комбинации БУД/ФОР препятствовать обострению болезни. Было установлено, что раннее применение пациентами с БА комбинации БУД/ФОР в качестве реливера (обычно за 3 дня до обострения болезни) сохраняет функциональный резерв и не позволяет развиваться дыхательной недостаточности (ДН), плохо поддающейся «поздней коррекции» с помощью ИГКС/ДДБА+КДБА и/или пероральными стероидами после своего развития (рис. 8) [13].
Для третьей и четвертой ступеней коррекции БА сохраняются правила терапии «сколько потребуется», но только для препаратов, прекращающих приступы астмы, – реливеров. В этом качестве разумнее выглядит комбинация БУД/ФОР в низких дозах. Имея широкое терапевтическое окно возможностей, на практике она является единственно возможной разумной терапией таких пациентов с БА. Она единственная имеет высокий профиль доказанной безопасности! Более того, для контроля БА (базисная терапия) возможно использовать комбинацию ИГКС/ДДБА в низких и средних (160/4,5 мкг) дозах. Приоритет имеют фиксированные комбинации БУД/ФОР, доставляемые турбухалером. Обладая конструктивной особенностью, предусматривающей низкую скорость вдоха для эффективной ингаляции лекарства, запатентованный порошковый ингалятор Турбухалер® имеет еще один секрет. Он скрыт в устройстве «спиральных каналов для ингаляции», позволяющих турбухалеру создавать своеобразное «аэрозольное облако» (рис. 9) [14].
Такая конструкция запатентованного порошкового ингалятора Турбухалер® при практическом использовании пациентами с БА позволяет осуществлять правильный вдох на низких скоростях (обычно более 30 л/мин) и создавать высокую легочную депозицию лекарственной субстанции (в 2,2 раза более высокую, чем у других средств доставки, не имеющих спиральных каналов). Это не только свидетельствует о практической ценности Турбухалера®, но и говорит о возможности выполнения стратегической задачи терапии БА в режиме единого ингалятора именно таким средством доставки.
1.3. Клинические доказательства эффективности комбинации БУД/ФОР
Клинические доказательства эффективности предлагаемой стратегии применения БУД/ФОР для пациентов с БА в качестве базисной терапии (контроллеры) и предпочтительной терапии для купирования симптомов (реливеры) на 1–3-й ступенях лечения получены в масштабном 52-недельном рандомизированном клиническом исследовании (РКИ) «SYGMA-1» [15]. На опыте 3836 пациентов БА убедительно показано, что средний процент недель хорошо контролируемой астмы БУД/ФОР в качестве реливера превосходил таковой у КДБА (34,4% против 31,1% недель; ОШ 1,14; 95% ДИ –1,00–1,30; p=0,046). Более того, ежегодная частота тяжелых обострений БА составила для группы КДБА 0,20; для группы БУД 0,09; для группы БУД/ФОР 0,07 [15].
Доказательства эффективности терапии пациентов с БА в режиме дозирования «quantum satis» (поддерживающая терапия «по потребности») получено в 52-недельном РКИ «SYGMA-2» [16]. Среди 4176 пациентов с БА терапия БУД/ФОР «по потребности» не уступала регулярной терапии БУД для снижения рисков тяжелых обострений БА. Годовая частота тяжелых обострений для группы БУД/ФОР составила 0,11 (95% ДИ – 0,10–0,13) и для группы БУД 0,12 (95% ДИ – 0,10–0,14). Среднесуточная доза ИГКС была достоверно ниже для группы БУД/ФОР (66 мкг), чем для группы БУД (267 мкг). Время до первого обострения было одинаковым в обеих группах (ОШ 0,96; 95% ДИ – 0,78–1,17) [16].
Практическая ценность результатов исследования заключается в достоверной аргументации применения БУД/ФОР в режиме поддерживающей терапии пациентов с БА «по потребности» как наиболее эффективной в поддержании контроля, устранении тяжелых обострений и в снижении стероидной нагрузки (безопасность).
2. Рекомендации экспертов «рро» по терапии пациентов с БА
Мы посчитали необходимым в качестве аргумента в пользу использования стратегии терапии пациентов с БА в режиме «единого ингалятора» с дозированием лекарственной субстанции «quantum satis» привести полные выдержки из рекомендации экспертов Российского респираторного общества, опубликованные на сайте организации «www.spulmo.ru» в 2017 г.
Данный документ является согласительным мнением 142 ведущих экспертов в области пульмонологии из 83 субъектов Российской Федерации [15].
2.1. О выборе ингаляционного устройства для пациента БА
Согласно рекомендациям Европейского респираторного общества (ERS) и Международного общества по использованию аэрозолей в медицине (ISAM), врач должен детально знать технику ингаляции для каждого вида ингаляционного устройства, чтобы правильно подобрать ингалятор, наиболее подходящий для лечения каждого конкретного пациента дома и в стационаре. Выбор ингалятора для конкретного лекарственного препарата определяется существующими устройствами, применяемыми для доставки данного препарата, а также способностью и желанием пациента использовать его правильно.
2.2. О замене/переключении пациента БА с одного ингалятора на другой
Решение о переключении пациента с одного ингаляционного препарата на другой, даже если планируется использование аналогичного действующего вещества, но с использованием другого средства доставки, должен принимать врач, исходя из особенностей течения заболевания пациента, а также согласовав эту смену с пациентом и проведя необходимое обучение технике ингаляции.
2.3. Об особых режимах дозирования лекарственных субстанций у пациентов с БА
Некоторые режимы терапии требуют совершенно определенной системы доставки. В частности, режим терапии единым ингалятором предусматривает строгое использование одного ингалятора в качестве базисной терапии и средства скорой помощи. Все препараты, применение которых предусматривает режим по потребности, заключены в мультидозовые средства доставки, порошковые или аэрозольные, что делает их применение быстрым и удобным в случае наступления такой необходимости.
Заключение
В реальной клинической практике терапия пациента с БА не должна встречать серьезных трудностей исполнения, если практикующий специалист владеет современными возможностями комбинированной фармакотерапии и немедикаментозными методами коррекции, способен успешно планировать терапевтическую стратегию. Это нашло отражение в новом «карманном руководстве» GINА-2019 [18], предлагающем практикующему специалисту использование БУД/ФОР как противовоспалительный бронхолитик, применяемый в режиме дозирования поддерживающая терапия «по потребности» для всех ступеней коррекции бронхиальной астмы, а для ступеней 3–5 и в качестве контролирующей терапии. На практике это означает расширение режима использования БУД/ФОР для всех ступеней БА, тогда как ранее он рассматривался только для терапии ступеней 3–5.
Современной рациональной терапевтической стратегией лечения пациентов с БА следует признать разумное дозирование фиксированных комбинаций БУД/ФОР (160/4,5 мкг) с доставкой через турбухалер. Это открывает три возможных варианта дозирования: 1) Симбикорт® Турбухалер® с противовоспалительным действием для купирования приступов/симптомов для пациентов легкой степени тяжести БА; 2) Симбикорт® Турбухалер® в качестве поддерживающей терапии и «по потребности» для пациентов среднетяжелой и тяжелой степени тяжести БА; 3) Симбикорт® Турбухалер® в качестве базисной терапии с фиксированной дозой для пациентов среднетяжелой и тяжелой степени тяжести БА [19].
Формирование стратегии эффективной и безопасной терапии БА комбинациями БУД/ФОР позволит достоверно снижать инвалидизацию и фатальные осложнения в обсуждаемой группе пациентов.



