Аллергия – глобальная медико-социальная проблема. Эпидемиологические исследования аллергических болезней свидетельствуют об их широкой распространенности в различных регионах земного шара: в среднем от 10 до 30 % [1]. В последние годы отмечается тенденция к увеличению числа больных, страдающих аллергическими болезнями, включая бронхиальную астму (БА) [1–3], что обусловлено многими причинами, в т.ч. изменившимся микроокружением, влиянием экологически неблагоприятных факторов внешней среды, нарушением иммунного ответа на внешние и внутренние антигены. На протяжении многих лет БА остается одной из самых широко распространенных аллергопатологий среди детей как младшего, так и старшего возраста.
Определения астмы до настоящего времени имели преимущественно описательный характер с перечислением специфических типов клеток (тучные клетки, эозинофилы и т.д.), времени проявления симптомов (особенно ночью или рано утром), обратимости (часто) или триггеров (вирусная инфекция, физическая нагрузка и воздействие аллергена). Однако роль и относительный вклад каждого из указанных дополнительных элементов могут быть оспорены: они не являются абсолютными исключительными признаками астмы.
Наиболее актуальна на сегодняшний день следующая формулировка: хроническое воспалительное заболевание, связанное с преходящей и изменяющейся обструкцией дыхательных путей и гиперреактивностью бронхов, проявляющееся повторяющимися эпизодами свистящего дыхания, кашля, одышки и чувства стеснения в груди [4, 5].
В США бронхиальная астма служит наиболее частой причиной госпитализации детей до 18 лет. По данным National Center for Health Statistics, на 2010 г. в США насчитывалось примерно 7 млн (9,4 %) детей в возрасте от 0 до 18 лет, страдавших БА. Из них около 4,8 млн детей отмечали приступы затруднения дыхания в течение года, около 1 млн обращались за экстренной медицинской помощью при ухудшении состояния и более 200 тыс. были госпитализированы [2].
Сравнительно низкий уровень смертности от БА не является показателем полного благополучия в лечении данного заболевания. Отсутствие контроля болезни, в т.ч. в силу не всегда адекватного лечения, приводит к персистирующим воспалительным изменениям в бронхах, клинически проявляющимся бронхиальной обструкцией, и обусловливает более частое использование бронхолитиков.
Контроль – купирование проявлений болезни на фоне базисной противовоспалительной терапии. Достижение контроля на сегодняшний день – основная цель лечения астмы.
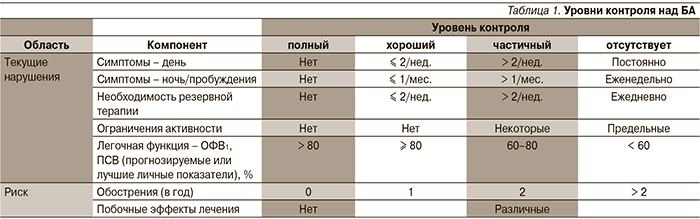
Уровень контроля – наиболее предпочтительный и общепринятый динамический критерий классификации астмы (табл. 1). Компоненты контроля астмы включают текущие нарушения (симптомы, потребность в дополнительной терапии и препаратах скорой помощи, ограничения активности, легочную функцию у детей старше 5 лет) и будущий риск (обострения, побочные эффекты лечения). «Полный» контроль описывается как состояние без проявления активности болезни на фоне назначенной базисной терапии [4, 5].
Лекарственные средства, применяемые для долгосрочного контроля над болезнью (средства базисной – поддерживающей, противовоспалительной – терапии) включают ингаляционные глюкокортикостероиды (ИГКС), антилейкотриеновые препараты, длительно действующие агонисты β2-адренорецепторов (преимущественно в комбинации с ИГКС) и антитела к IgE. Последний класс препаратов рекомендован к применению с третьей ступени терапии и показан детям с аллергической персистирующей астмой, плохо контролируемой другими препаратами [6]. На сегодняшний день использование кромонов в качестве средств базисной терапии ограничено отсутствием доказательств эффективности, а теофиллинов – высоким риском развития тяжелых нежелательных явлений. Регулярное применение средств базисной терапии облегчает симптомы и снижает количество обострений, улучшает качество жизни и легочную функцию.
Несмотря на значимое продвижение в понимании различных аспектов детской астмы и прилагаемые усилия по созданию руководств по ее лечению, масса пациентов по-прежнему не могут контролировать свою астму, а частота обострений остается высокой. Ухудшение состояния обычно возникает вследствие неадекватности базисной терапии или воздействия триггеров (респираторной инфекции, контакта с аллергенами и резкими запахами, чрезмерной физической и эмоциональной нагрузки, изменений погоды и т.д.) [5].
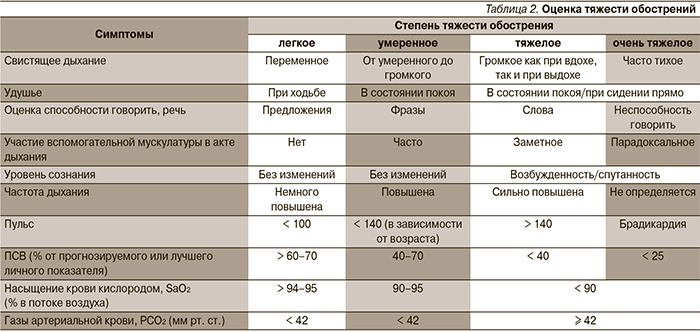
Обострения могут различаться по остроте – от легких до фатальных; как правило, их разделяют на три или четыре категории – от легких до угрожающих жизни. Тяжесть оценивается на основании клинической картины или объективных показателей (табл. 2).
Однако такую классификацию сложно применять к младенцам и детям дошкольного возраста в отсутствие оценки легочной функции [4, 5].
Лечение обострений может проводиться в различных условиях в зависимости от тяжести состояния и доступности медицинских услуг: дома, амбулаторно, бригадой скорой помощи, в отделении стационара или интенсивной терапии.
Тяжесть обострения, как правило, связана с недооценкой состояния, неправильными действиями при потере контроля болезни и неадекватным лечением обострения. Среди детей, которым оказана экстренная медицинская помощь, примерно 10–13 % в течение 2 последующих недель отмечают рецидивы болезни [7, 8]. Процент повторных госпитализаций детей с БА составляет 23 % в течение 3 месяцев, 33 % – в течение 6 месяцев, 43 % – в течение года и 51 % – в течение 2 лет после первого эпизода терапии в стационаре вследствие обострения БА. Эти статистические данные свидетельствуют о корреляции риска возможной повторной госпитализации по поводу БА и числа предыдущих госпитализаций по той же причине [9–11]. Обращения за экстренной медицинской помощью и повторяющиеся госпитализации служат важнейшей проблемой и определяющей частью экономической составляющей данной патологии [12].
Бронходилатация – первая цель терапии обострений. Мероприятия следует начинать еще в домашних условиях (часть плана действий при астме); в отделении скорой помощи – сразу после оценки степени тяжести. Рекомендуется сальбутамол от 2 до 6 ингаляций (200–600 мкг) каждые 20 минут в течение первого часа с помощью дозированного ингалятора со спейсером (возможно использование небулайзера). Оценку состояния проводят в течение первого часа; если отклик на терапию неудовлетворительный, пациента следует госпитализировать (если он находится дома) [4, 5].
Дополнительный кислород необходим для коррекции гипоксемии, параллельно проводят мониторинг насыщения крови кислородом (SaO2).
Снизить тяжесть течения болезни и уменьшить риск развития тяжелого обострения может только своевременное применение противовоспалительных препаратов. Ингаляционные глюкокортикостероиды общепризнанно являются средством первой линии в терапии БА у детей всех возрастов [4, 5]. Под их воздействием отмечается обратное развитие воспаления в слизистой оболочке бронхов, сопровождающееся снижением гиперреактивности, уменьшением частоты приступов БА. Результаты многочисленных исследований свидетельствуют о том, что использование ИГКС позволяет снижать риск возникновения неотложных состояний и госпитализаций [4, 5, 8, 13–16].
При назначении ИГКС детям используются различные способы доставки лекарственного средства: порошковые ингаляторы – аэролайзеры, дозированные аэрозольные ингаляторы, небулайзеры. Выбор конкретного средства зависит как от возможности пациента эффективно и правильно использовать назначенный препарат, так и от самого лекарственного вещества. Серьезную проблему нередко представляет лечение обострений БА у детей раннего возраста, которым трудно освоить технику использования дозирующего ингалятора, требующую координации дыхания и ингаляции. Результаты исследования, проведенного на детях в возрасте от 3 месяцев до 18 лет и их родителях, в котором проверялась техника использования ИГКС с различными способами доставки лекарственного вещества (небулайзер, дозированный аэрозоль, порошковый ингалятор), показали, что небулайзеры корректно применяются наиболее часто по сравнению с другими методами [17].
Небулайзер – это ингаляционное устройство, предназначенное для распыления аэрозоля с особо мелкодисперсными частицами. Существует несколько типов небулайзеров: ультразвуковые, компрессорные и электронно-сетчатые (меш). Главным недостатком ультразвуковых небулайзеров является существенно ограниченный спектр применяемых препаратов (нельзя использовать антибиотики и гормональные препараты, масляные растворы и суспензии), молекулярная структура которых может разрушаться при ультразвуковом воздействии.
Аэрозольная смесь в небулайзерах компрессорного типа создается при помощи струи воздуха, формируемой компрессором. Такие ингаляторы надежны, позволяют использовать широкий спектр лекарственных препаратов (в т.ч. гормональных и антибактериальных). Однако необходимо помнить, что при ингаляции компрессорным небулайзером важно удерживать небулайзерную камеру в вертикальном положении.
Аэрозольная смесь в небулайзерах меш-типа формируется за счет просеивания жидкого лекарственного средства через вибрирующую металлическую сетку-мембрану с микроскопическими отверстиями. Их преимуществом являются сверхкомпактные размеры, широкий спектр применяемых лекарственных средств, бесшумность, минимальный остаточный объем лекарственного препарата, а также возможность проведения ингаляции под любым углом наклона небулайзерной камеры.
Использование небулайзера в качестве средства доставки препарата не требует координации ингаляции с дыханием и позволяет создавать высокие концентрации лекарственного вещества в легких. Именно это средство доставки можно применять детям с первых месяцев жизни. Для введения бронхолитиков небулайзеры используют при приступе БА любой тяжести. При этом кривая дозы достигает пика быстрее, чем при использовании дозирующего ингалятора, что обеспечивает более выраженный бронходилатирующий эффект. К преимуществам небулайзерной терапии помимо отсутствия необходимости в координации дыхания с поступлением аэрозоля можно отнести возможность использования высоких доз лекарственного вещества, непрерывную его подачу с помощью компрессора, отсутствие фреона, который может усиливать бронхиальную реактивность, быстрое поступление лекарственного вещества в бронхиальное дерево, портативность устройства.
Общеизвестно, что среди детей в возрасте младше 4 лет отмечается наибольшее количество госпитализаций и особенно высок процент случаев обращений за экстренной медицинской помощью. Одним из ИГКС, одобренных к применению детьми данной категории, является будесонид в суспензии для ингаляций. Введение суспензии будесонида в ингаляциях через небулайзер детям после госпитализации или обращения за экстренной помощью в связи с обострением БА снижает риск возникновения последующего ухудшения болезни, особенно у детей 4 лет и младше [18]. Об этом свидетельствует исследование, проведенное в Соединенных Штатах Америки, – длительный ретроспективный анализ базы данных (PharMetrics Patient-Centric Database, PharMetrics, Inc., Watertown, MA, USA). В исследовании приняли участие 1076 детей в возрасте до 8 лет, у которых были зафиксированы случай обращения за экстренной медицинской помощью или госпитализация. В ходе исследования изучали риск возникновения рецидива болезни – подсчитывали число обращений за экстренной медицинской помощью и госпитализаций в течение 31–80 дней после зарегистрированного случая обострения. Все дети получали различную противоастматическую терапию. Оценка вероятности развития повторного обострения у детей составила 32 % по сравнению с 68 % рисков ухудшения состояния у детей, не получавших небулированную форму будесонида. Среди пациентов в возрасте младше 4 лет только у 12 % было отмечено развитие последующего обострения в течение периода наблюдения по сравнению с 18 % в группе детей, не использовавших небулайзер. Аналогичная тенденция выявлена в возрастной группе 5–8 лет: только 9 % детей, получавших суспензию будесонида, отметили ухудшение состояния в исследовании по сравнению с детьми того же возраста, не получавшими ИГКС через небулайзер (12 %). Риск повторных обострений и связанных с ним обращений за экстренной медицинской помощью, а также госпитализаций снизился на 52 % у детей в возрасте 5–8 лет (отношение рисков [ОР] = 0,48; 95 % доверительный интервал [ДИ] – 0,16–1,46) и на 62 % среди детей младше 4 лет (ОР = 0,38; 95 % ДИ – 0,21–0,70), использовавших небулированную форму будесонида, по сравнению с теми, кто получал ИГКС без применения небулайзера. Применение кромонов, пероральных ГКС и агонистов β2-адренорецепторов было связано с достоверно более высоким риском возникновения повторных обострений. В исследовании было выявлено, что только очень небольшому числу детей была назначена адекватная базисная противоастматическая терапия в течение 30 дней после эпизода обострения болезни и оказания экстренной медицинской помощи.
Проведенный ретроспективный анализ [19] показал, что лечение с использованием всех доз небулированного будесонида значительно улучшило показатель количества дней без приема препаратов скорой помощи (p < 0,008) и количество дней с отсутствием симптомов по сравнению с плацебо (p < 0,028). Будесонид в суспензии в дозе 0,5 мг 2 раза в сутки значительно улучшал показатель количества дней с достигнутым контролем астмы (p = 0,015). Также была отмечена тенденция к значимому различию в показателе количества дней с отсутствием симптомов между небулированным будесонидом 1,0 мг однократно в сутки и плацебо (p = 0,054). Будесонид в суспензии для ингаляций эффективен в дозах 0,25–1,00 мг для младенцев и детей младшего возраста с БА среднетяжелой степени. Для таких пациентов однократное суточное дозирование остается терапией выбора. Более того, улучшение функции легких и уменьшение симптомов БА после использования небулированного ИГКС 2 раза в сутки были одинаковыми для детей в возрасте 4 лет и старше и детей младшего возраста [20].
Международные рекомендации ведения астмы (GINA, ICON) рекомендуют небулайзерную стероидную терапию в качестве терапии выбора для детей любого возраста с персистирующей БА и в качестве одной из предпочтительных терапий выбора для всех младенцев и большинства детей с БА тяжелой степени.
Исследование HEICA (Хельсинкское исследование раннего вмешательства при лечении астмы у детей) [21] показало, что непрерывная поддерживающая терапия ИГКС помогает достигать наилучшего контроля БА у детей (в возрасте 5–10 лет) с вновь диагностированной персистирующей астмой легкой степени в отличие от прерывистого режима терапии или регулярного использования натрия кромогликата. Это особенно показательно в отношении частоты обострений астмы.
Исследование CAMP (Childhood Asthma Management Program – Программа Ведения Астмы у Детей) [22, 23] является наиболее всесторонним исследованием длительного применения противовоспалительной терапии детей с БА легкой и среднетяжелой степеней. Исходно это исследование было направлено на изучение влияния длительного использования ИГКС и недокромила натрия детьми на улучшение показателей роста легких по сравнению с симптоматической терапией. Первичным критерием исхода лечения было изменение объема форсированного выдоха за 1-ю секунду (ОФВ1) после лечения бронходилататором; симптомы БА и гиперреактивность дыхательных путей были вторичными критериями исхода лечения. В этом исследовании 1041 ребенок (в возрасте 5–12 лет) получал будесонид с помощью ингалятора (турбухалера) в дозе 200 мкг 2 раза в сутки или недокромил натрия в дозе 8 мг 2 раза в сутки, или плацебо в течение 4–6 лет. Средняя продолжительность БА у этих детей была приблизительно 5 лет; примерно 47 % пациентов каждой группы имели астму легкой степени и 53 % – астму среднетяжелой степени. Лечение будесонидом показало незначительное повышение показателя ОФВ1 после приема бронходилататора по сравнению с плацебо (103,2–103,8 % ОФВ1 от должного значения), но эффект не был статистически значимым. Это можно было отнести за счет необратимого снижения функции легких к моменту включения в исследование, поскольку дети болели БА на протяжении в среднем 5 лет до получения противовоспалительного лечения. Будесонид, однако, ассоциировался со значительными улучшениями состояния, уменьшением потребности в препаратах скорой помощи и увеличением числа дней без симптомов астмы по сравнению с плацебо. Кроме того, при сравнении с группой плацебо пациентам, получавшим ИГКС, требовалось значительно меньше госпитализаций (2,5 и 4,4 соответственно; p = 0,04), неотложной помощи (12 и 22 соответственно; p < 0,001) или курсов пероральных стероидов (70 и 122 соответственно; p < 0,001). Кроме того, у этих пациентов насчитывалось меньше дней, когда требовался дополнительный противоастматический препарат (6,6 и 18,7 % соответственно; p < 0,001). Лечение ИГКС ассоциировалось со значительным (p < 0,001) уменьшением реактивности дыхательных путей на метахолин по сравнению с плацебо, тогда как недокромил не показал значимого эффекта.
На сегодняшний день в Российской Федерации зарегистрировано два препарата будесонида в форме суспензии для проведения ингаляционной терапии с помощью небулайзера. Сравнение фармацевтической эквивалентности данных препаратов Буденит Стери-Неб (0,5 мг/2 мл и 1 мг/2 мл) (ТEVA, Израиль) и Пульмикорт (0,5 мг/2 мл и 1 мг/2 мл) (AstraZeneca, Великобритания) показало, что данные лекарственные средства значимо не различаются по компонентному составу, размеру частиц суспензии, распределению частиц генерируемого аэрозоля по размерам и количеству будесонида во вдыхаемой смеси. Химико-фармакологический анализ подтвердил эквивалентность суспензии будесонида двух производителей по основным показателям, влияющим на терапевтический эффект [24].
Регулярное применение базисной терапии достоверно уменьшает риск обращений за экстренной медицинской помощью в связи с обострением БА и частоту повторных госпитализаций, снижает гиперреактивность бронхов, помогает своевременно достигать и длительно поддерживать контроль БА.
Однако наибольший успех достижим лишь при комплексном подходе к лечению. Его составляет ряд компонентов: обучение пациентов и их родителей, выявление и ограничение воздействия триггеров, регулярный мониторинг и фармакотерапия – применение соответствующих препаратов по индивидуально составленному плану. Каждый элемент играет важную роль в достижении успеха. Комплаентность, подкрепленная первичным обучением специалистом и дальнейшими занятиями в астма-школе, обусловливает высокую приверженность назначенным рекомендациям. Самоконтроль – мониторинг в домашних условиях согласно персональному плану лечения необходим для раннего выявления обострений болезни своевременной коррекции терапии. Перспективным направлением является использование обучающих компьютерных программ и интернет-ресурсов, особенно для детей старшего возраста и подростков [25].



