Введение
В конце ХХ – начале ХХI вв. в фармацевтической отрасли отмечается значительный прогресс, что проявилось в появлении на рынке массы доступных и эффективных лекарственных средств (ЛС) Так, по данным E. Kantor et al. [1], более половины жителей Земли принимают хотя бы один рецептурный препарат, а пять – 15% и более [1, 2]. У лиц пожилого и старческого возраста (60–79 лет) эти цифры еще больше: 83,6 и 34,5% соответственно [2, 3]. Активное применение ЛС привело к повышению риска развития осложнений фармакотерапии т.н. лекарственно-индуцированных заболеваний (англ.: drug-induced diseases), т.е. нежелательных реакций (НЛР), которые увеличивают для пациента риск летального исхода и/или заболеваемость, что может приводить к развитию клинических состояний, требующих медицинской помощи или госпитализации [4]. При этом отмечается, что величина этого риска у разных пациентов отличается в зависимости от наличия у них модифицируемых и немодифицируемых факторов риска, одним из которых является курение табака [4]. Курение табака – модифицируемый фактор риска развития лекарственно-индуцированных заболеваний, поскольку курение может оказывать влияние на фармакокинетические и фармакодинамические параметры ЛС [4].
Согласно докладу Всемирной организации здравоохранения (ВОЗ) о глобальной табачной эпидемии 2015 г., Европейский регион считается лидером по числу взрослых курильщиков (28%), в т.ч. среди женщин (19%) [5].
В Российской Федерации с 1994 по 2016 г. число лиц, потреблявших табак, сократилось с 31 до 28%, однако увеличилась доля курящих женщин с 9 до 14% [6]. По прогнозам ВОЗ, в 2025 г. число лиц, употребляющих табак, составит 31% среди мужчин и 16% среди женщин [7].
Во время курения человек вдыхает табачный дым – сложную смесь компонентов переменного состава, состоящую на 95% из газообразных веществ (азот, двуокись углерода, оксид углерода, аммоний, цианистый водород и др.) и на 5% из твердых или жидких частиц (в т.ч. никотин, норникотин, анатабин, анабазин и др.), которых в общей сложности насчитывается более 3500 [8, 9]. Выделяют также т.н. смолы, т.е. твердые частицы в составе табачного дыма, за исключением алкалоидов, представляющих собой полициклические ароматические углеводороды (ПАУ), ароматические амины и др. вещества [8, 9]. Количественный и качественный состав табачного дыма не постоянен и зависит от сорта/сортов табака, места его произрастания, способа культивации, обработки на заводе, условий хранения, а также химических реакций, происходящих в процессе горения [8–10]. Во время курения внутри горящей сигареты табак подвергается неравномерному воздействию температур от окружающей среды до 950оС в присутствии кислорода меняющейся концентрации [8, 9]. Вследствие пиролиза аминокислот, жирных кислот, углеводов, парафинов и др. химических реакций различными путями формируются тысячи химических веществ [8, 9, 11]:
- при t~400–600оС образуются нормальные алканы и алкены;
- t>500оС – бензол и алкилбензолы;
- t>700оС – нафталин и его производные;
- t>800оС – полициклические ароматические углеводороды (ПАУ).
Компоненты табачного дыма влияют на безопасность ЛС как на фармакокинетическом уровне, оказывая влияние на всасывание ЛС, их связь с белками, метаболизм и элиминацию, так и на фармакодинамическом уровне за счет изменения реактивности органов-мишеней у курящих пациентов, с одной стороны, и воздействия компонентов табачного дыма на физиологические процессы организма, с другой [12]. За счет этого компоненты табачного дыма, прежде всего никотин и ПАУ (син.: полиароматические углеводороды или полициклические ароматические углеводороды), могут приводить к повышению риска развития НЛР, лекарственно-индуцированных симптомов/синдромов и заболеваний [4].
Основным алкалоидом табака является никотин. В одной сигарете содержится ~10–14 мг никотина, при этом доза, попадающая в организм во время курения, составляет, по разным данным, от 1 до 3 мг, летальная доза никотина – около 60 мг [8, 13, 14]. Никотин обладает высокой липофильностью, хорошо всасывается через кожу и слизистые оболочки, а также проникает через гематоэнцефалический барьер. Вещество активно метаболизируется в печени и способно изменять активность некоторых изоферментов семейства цитохрома Р-450 (табл. 1) [11, 13, 1–19].
Никотин обладает выраженной фармакологической активностью за счет стимуляции N-холинорецепторов симпатических и парасимпатических ганглиев, хромафинных клеток мозгового вещества надпочечников и каротидных клубочков. Он стимулирует секрецию адреналина и норадреналина (активация симпатической нервной системы), деятельность дыхательного центра (в больших дозах угнетает вплоть до развития паралича дыхательного центра) и сосудодвигательного центра. Данное вещество увеличивает частоту сердечных сокращений (ЧСС), вызывает вазоспазм, повышает артериальное давление (АД), способствует развитию субъективных приятных ощущений за счет усиления секреции дофамина и других биогенных аминов. Стимуляция парасимпатических ганглиев никотином способствует повышению тонуса и моторики желудочно-кишечного тракта, усилению секреции экзокринных желез. В больших дозах никотин, наоборот, оказывает угнетающее действие на данные органы и системы, а также может вызывать брадикардию [13].
ПАУ, входящие в состав табачного дыма, в силу большого количества и гетерогенности достаточно трудно описать кратко, однако известно, что они являются мощным канцерогеном [20], а также способны изменять активность некоторых изоферментов цитохрома Р-450 (табл. 1), значительно увеличивая риски развития осложнений [11, 15–19].
Масса газообразных веществ и следовые количества тяжелых металлов также могут изменять эффективность ЛС, повышать риски развития НЛР и оказывать негативное влияние на здоровье пациентов (табл. 1) [11, 15–19].

Таким образом, компоненты табачного дыма способны вступать как в фармакодинамические, так и в фармакокинетические взаимодействия с другими ЛС и тем самым изменять их профиль безопасности в сторону увеличения рисков развития лекарственно-индуцированных заболеваний.
Фармакокинетические взаимодействия компонентов табачного дыма, повышающие риски развития НЛР и лекарственно-индуцированных заболеваний
Химические вещества, входящие в состав табачного дыма, могут изменять профиль эффективности и безопасности других ЛС за счет изменения количества активного вещества, попавшего в системный кровоток (этап абсорбции), распределения их в организме и связи с белками плазмы крови (этап распределения), метаболизма (например, изменения активности изоферментов цитохрома Р-450 или глюкуронизации) и экскреции (табл. 2) [11, 21].
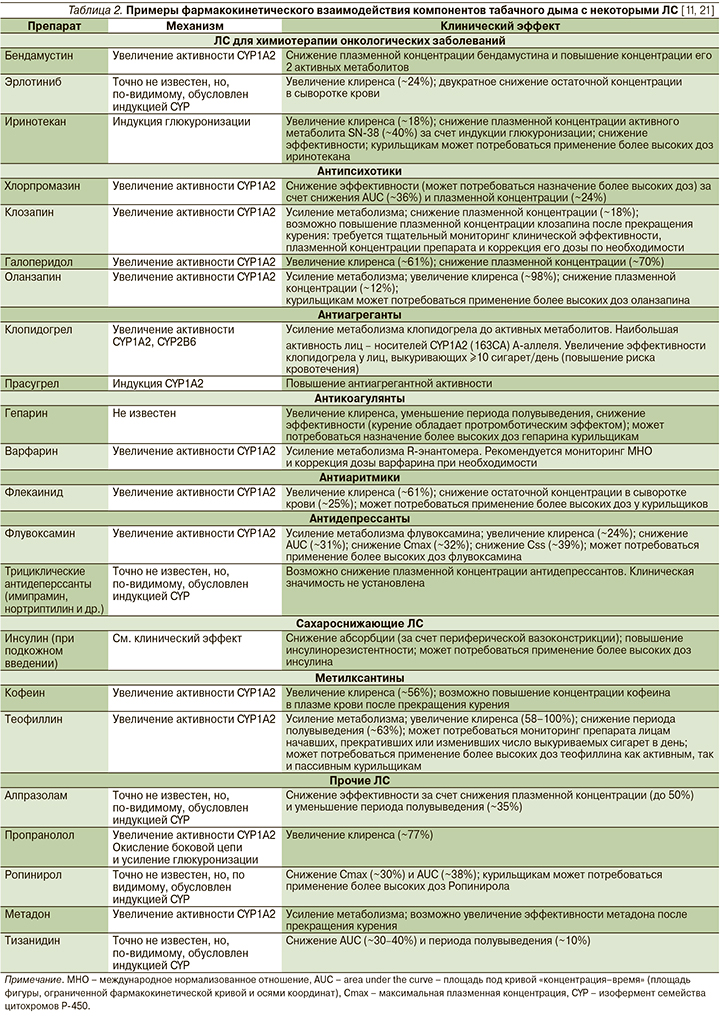
Известно, что курение может снижать абсорбцию инсулина в случае его подкожного введения за счет периферической вазоконстрикции, что может повышать риски, связанные с недостаточной эффективностью сахароснижающей терапии и потребовать применения более высоких доз инсулина, что повышает риск развития гипогликемий [11, 21]. В работе M. Takano et al. [22] показано, что курение может напрямую подавлять активность Р-гликопротеина (P-gp) в клетках альвеолярного эпителия линии A549/P-gp, а значит, потенциально изменять абсорбцию ксенобиотиков-субстратов P-gp [22].
Как никотин, так и ПАУ являются индуктором многих изоферментов цитохрома Р-450. Например, индукция CYP1A2 будет изменять концентрацию, а значит, влиять на профиль безопасности таких ЛС, как амитриптилин, кофеин, клозапин, дулоксетин, флувоксамин, галоперидол, имипрамин, оланзапин, онаднсетрон, парацетамол, пропранолол, теофиллин, варфарин, клопидогрел и др., в метаболизме которых участвует данный фермент [11, 21, 22]. Изменение активности CYP2B6 под воздействием компонентов табачного дыма может увеличивать риски развития осложнений у пациентов, принимающих бупропион, клопидогрел, циклофосфамид, эфавиренц, ифосфамид, метадон, невирапин [11, 21, 22]. Таким образом, регулярное курение табака изменяет (активирует) метаболизм различных ЛС, что может потребовать применения курильщиками более высоких доз некоторых ЛС. Считается, что максимально активно протекают процессы метаболизма у лиц, выкуривающих от 7 до 10 сигарет в день [12, 23].
Ряд достаточно часто назначаемых ЛС, включая ацетаминофен (парацетамол), диазепам, дулоксетин, оланзапин, ондансетрон, клозапин, метадон, являются субстратом CYP1А1. Компоненты табачного дыма, которые являются индуктором цитохрома CYP1А2 и дифосфатуридин-глюкуронозила, ускоряют метаболизм многих ЛС: варфарина, верапамила, пропафенона, флекаинида, мексилетина, пропранолола, нитратов, инсулина, кофеина, арбидола, афобазола, эстрогенов. Это приводит к снижению концентраций ЛС в крови и снижению их эффективности [12, 23]. В связи с этим для получения сходного клинического эффекта курильщикам требуются более высокие дозы этих препаратов по сравнению с некурящими пациентами, что в свою очередь увеличивает риск развития дозозависимых побочных эффектов ЛС.
Кроме того, у курящих пациентов риск развития НЛР особенно велик в момент резкого прекращения курения [12, 24]. Индукционный эффект полностью изменяется через 10 дней после прекращения курения [12]. Поэтому при отказе пациента от курения может потребоваться снижение дозы ЛС, взаимодействующего с компонентами табачного дыма [21, 24]. Это необходимо учитывать, например, при поступлении пациента в стационар или при развитии острого заболевания, в связи с чем он прекращает курить самостоятельно (например, острые респираторные вирусные инфекции). В этом случае также следует рассматривать возможность и необходимость снижения дозы подобных ЛС.
В мета-анализе (15 проспективных когортных исследований), проведенном J. Xia et al. [25], в который вошли 65 064 пациента с хронической болезнью почек (ХБП), показано, что по сравнению с лицами, никогда не курившими, суммарный относительный риск (СОР) возникновения ХБП составил 1,27 (95% доверительный интервал [ДИ]: 1,19–1,35), для лиц, имевших эпизоды курения в анамнезе, – 1,34 (95% ДИ: 1,23–1,47), для людей, курящих в настоящий момент, – 1,15 (95% ДИ: 1,08–1,23). СОР развития терминальной стадии почечной недостаточности составил 1,51 (95% ДИ: 1,24–1,84) для лиц, имевших эпизоды курения в анамнезе, 1,44 (95% ДИ: 1,00–2,09) для бывших курильщиков и 1,91 (95% ДИ: 1,39–2,64) для лиц, курящих в настоящий момент, по сравнению с лицами, никогда не курившими [25]. Следовательно, курение, являясь фактором риск развития ХБП (в т.ч. ее терминальной стадии), негативно сказывается на фильтрационной функции почек, таким образом, также может изменять профиль безопасности и обусловливать необходимость коррекции дозы ЛС с преимущественно почечным путем выведения.
Фармакодинамические взаимодействия компонентов табачного дыма, повышающие риски развития НЛР и лекарственно-индуцированных заболеваний
Компоненты табачного дыма могут также изменять профиль безопасности ЛС на фармакодинамическом уровне за счет агонистических и антагонистических взаимодействий с другими ЛС и тем самым способствовать возникновению НЛР (табл. 3).
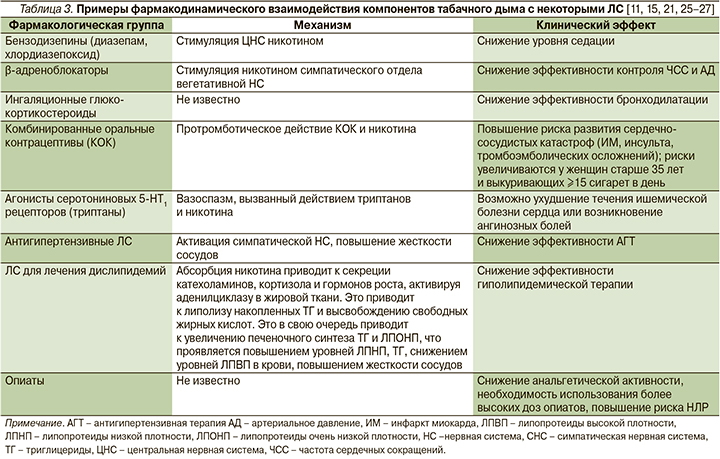
Так, например, как уже отмечено в данной статье, никотин за счет влияния на N-холинорецепторы усиливает секрецию в кровеносное русло катехоламинов, активирует симпатическую нервную систему (СНС) и тем самым способствует повышению тонуса сосудов, увеличению АД и ЧСС, что может снижать эффективность АГТ. Например, показано, что никотин снижает эффективность β-адреноблокаторов, это приводит к тому, что курящим пациентам в 2 раза чаще требуются более высокие дозы данных ЛС [28, 29].
Активация СНС и обусловленное этим повышение уровня глюкозы в крови могут способствовать ослаблению эффекта различных сахароснижающих ЛС [28, 29]. Курение может вызывать высвобождение активных субстанций, приводящих к инсулинорезистентности. Считается, что потребность в инсулине курильщиков, страдающих сахарным диабетом, выше на 15–20%, а при длительном анамнезе и высокой интенсивности курения этот показатель доходит до 30% [23].
Выделение дофамина и других биогенных аминов, оказывающих стимулирующее влияние на ЦНС, снижает фармакологический эффект седативных ЛС, таких как, например, бензодиазепины [11]. Никотин способствует секреции различных нейромедиаторов, в т.ч. ацетилхолина, дофамина, серотонина, глутамата, за счет взаимодействия с пресинаптическими N-холинорецепторами нейронов ЦНС [30]. Поскольку у курящих пациентов, которые принимают бензодизепины, наблюдается снижение эффективности седации в случае прекращения курения, то при продолжении приема бензодизепинов развивается чрезмерное угнетение функции ЦНС [31, 32].
Курение табака ассоциировано с гипералгезией за счет десенситизации N-холинорецепторов [32, 33].
У курильщиков отмечается меньшая эффективность анальгетиков, включая опиоиды, что требует назначения больших доз морфина, меперидина или пропоксифена [34, 35]. Поэтому курящим пациентам, которым требуется назначение опиатов, следует рекомендовать прекратить курение [36].
Воздействие никотина и других компонентов табачного дыма приводит к развитию воспалительной реакции дыхательных путей и снижает эффективность ингаляционных глюкокортикостероидов у пациентов с бронхиальной астмой, поэтому им также следует настоятельно рекомендовать прекратить курение [32, 37–40].
Большое клиническое значение имеет взаимодействие компонентов табачного дыма с оральными контрацептивами: риск развития НЛР со стороны сердечно-сосудистой системы у курящих женщин, принимающих оральные контрацептивы, значительно выше, особенно у женщин более старшего возраста [4]. Так, у некурящих женщин, которые используют низкодозированные оральные контрацептивы (20–50 мг эстрогена), абсолютный риск смерти от сердечно-сосудистых составляет 0,65 на 100 тыс. в возрасте 15–34 лет и 6,21 на 100 тыс. в возрасте 35–44 лет [41–44]. Этот риск значительно возрастает у курящих женщин: 3,3 на 100 тыс. женщины в возрасте 15–34 лет и 29,4 на 100 тыс. женщин в возрасте 35–44 лет [41–44]. В исследовании случай–контроль установлено, что у курящих женщин (≥25 сигарет в день) моложе 45 лет, принимающих оральные контрацептивы, значительно выше риск развития первого нефатального ИМ (соотношение шансов – 2,5, 95% ДИ: 0,9–7,5) [45]. Поэтому прием оральных контрацептивов противопоказан курящим женщинам в возрасте старше 35 лет [45, 46]. Таким женщинам следует рекомендовать прекращение курения, а в случае отказа или неудачных попыток – альтернативные методы контрацепции. Необходимо добавить, что эффективность оральных контрацептивов для курящих женщин не снижается [21, 47–49].
Для облегчения отказа от курения применяются немедикаментозыне (консультирование, психотерапия, социальная поддержка) и медикоментозные методы, например, назначение варениклина (Чампикс®, Пфайзер Инк, США) –препарата, который не содержит никотин (вещество, формирующее зависимость у курящих пациентов) [50–52]. Варениклин входит в международные клинические рекомендации как препарат 1-ой линии для лечения табачной зависимости в т.ч. у пациентов с ХОБЛ и сердечно-сосудистыми заболеваниями (ССЗ) [50–52]. Варениклин обладает двойным механизмом действия: частичный агонист и полный антагонист никотиновых рецепторов, благодаря чему пациент не испытывает удовольствия от курения, но при этом не чувствует неприятных проявлений синдрома отмены из-за низких уровней допамина. Таким образом, варениклин способствует постепенному отказу от курения (продолжать курить можно вплоть до 35 дня приема препарата), а сам процесс отказа от курения становится более легким и не сопровождается неприятными, подчас болезненными проявлениями у пациента [53–54]. Эффективность медицинского применения варениклина подтверждена огромным мировым опытом применения (9 из 10 пациентов бросают курить при соблюдении полного 12-недельного курса лечения), результатами 240 клинических исследований, 1 095 публикаций, более 20 млн пациентов, зарегистрирован в 80 странах [54–55]. Важно отметить удобство и безопасность клинического применения варениклина. Препарат не имеет прямых лекарственных взаимодействий с другими ЛС, а также не имеет ограничений к применению и противопоказаний при хронических болезнях органов дыхания, ССЗ, сахарном диабете I и II типов [53, 56].
Заключение
Таким образом, курение табака за счет содержащихся в табачном дыме никотина, ПАУ и других компонентов путем фармакодинамических и фармакокинетических взаимодействий способно повышать риски развития НЛР, в т.ч. серьезных. Поэтому, когда пациенту, который не считает необходимым перестать курить, назначают фармакотерапию. Целесообразно по возможности выбирать ЛС, на фармакокинетику и фармакодинамику которых курение табака оказывает минимальное влияние. Следовательно, они сохраняют высокую эффективность у этой более угрожаемой по сердечно-сосудистой смертности категории пациентов и не увеличивают риска развития лекарственно-индуцированных заболеваний. Также следует рекомендовать пациенту прекращение курения, для облегчения которого возможно использовать варениклин (Чампикс®, Пфайзер Инк, США).
Вклад авторов. Д.А. Сычев, О.Д. Остроумова – написание текста статьи, критический пересмотр содержания статьи, утверждение окончательного варианта статьи для публикации. А.П. Переверзев, А.И. Кочетков, Т.М. Остроумова, М.В. Клепикова – сбор, анализ и систематизация данных научной литературы, написание текста статьи, оформление статьи, ответственность за все аспекты работы, связанные с достоверностью данных. Э.Ю. Эбзеева – сбор, анализ и систематизация данных научной литературы, написание текста статьи, оформление статьи, ответственность за все аспекты работы, связанные с достоверностью данных.



