Введение
Лекарственно-индуцированные заболевания (ЛИЗ) представляют собой вариант нежелательной реакции (НР), способной повышать смертность и/или заболеваемость, и/или служит причиной возникновения симптомов, вынуждающих пациента обращаться за медицинской помощью или приводящих к госпитализации [1, 2]. Для ЛИЗ характерны высокая распространенность, повышенный риск госпитализаций, в т.ч. в отделения интенсивной терапии, и смертности, они обусловливают увеличение затрат на лечение (прежде всего стоимость госпитализации) [1, 2]. Смертность госпитализированных пациентов с ЛИЗ может достигать 5%, что в несколько раз превышает показатель госпитальной смертности от других причин [2]. Лекарственно-индуцированные симптомы, синдромы и заболевания очень разнообразны, они развиваются на фоне приема практически всех групп лекарственных средств (ЛС) с большей или меньшей вероятностью, поэтому встречаются в практике врачей всех специальностей.
Некоторые пациенты в большей степени предрасположены к развитию ЛИЗ в связи с наличием у них ряда факторов риска (ФР). Факторы риска ЛИЗ делят на общие (ФР развития любых ЛИЗ и/или развития ЛИЗ на фоне применения любых ЛС), ФР ЛИЗ, специфичные для конкретного лекарственного препарата или класса ЛС, а также специфические ФР, которые повышают риск развития какого-то конкретного ЛИЗ (табл. 1) [1–6].
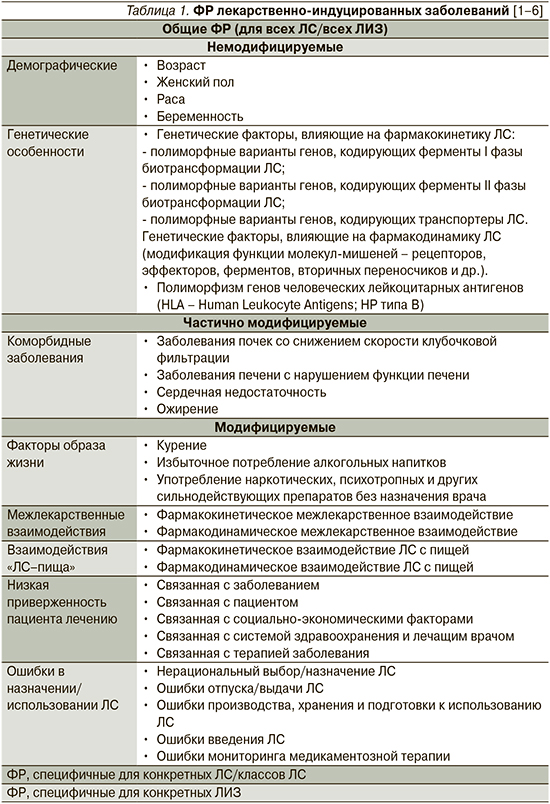
Общие ФР развития ЛИЗ классифицируют на немодифицируемые, частично модифицируемые и модифицируемые (табл. 1) [1, 3]. К немодифицируемым ФР относят возраст пациента, пол, расу, беременность, генетические особенности [1, 3]. Эти ФР должны быть обязательно приняты во внимание перед назначением ЛС. Дополнительно должны быть выявлены и по возможности скорректированы или минимизированы все модицифируемые ФР ЛИЗ, к которым относятся курение, злоупотребление алкоголем, наркотическими средствами, межлекарственные взаимодействия, взаимодействия «ЛС–пища», низкая приверженность пациента приему ЛС, ошибки назначения ЛС [1, 3]. Те коморбидные заболевания, которые повышают вероятность развития ЛИЗ, можно отнести к частично модифицируемым ФР.
Далее в данной статье будут рассмотрены немодифицируемые ФР, наличие которых повышает вероятность развития ЛИЗ.
Пожилой и старческий возраст
Пожилой и старческий возраст считается одним из главных ФР развития ЛИЗ [1, 3]. НР у пожилых людей часто служит причиной госпитализации, чаще встречаются во время госпитализации и чаще являются причиной заболеваемости и смерти [1, 3]. Так, по данным обсервационного исследования в Германии [7], заболеваемость ЛИЗ возрастала с увеличением возраста с 3,8 на 10 тыс. пролеченных пациентов не старше 30 лет до 20 на 10 тыс. пациентов в возрасте 70 лет и старше. В другом обсервационном исследовании, также проведенном в Германии [8], при сравнении возрастных групп <65 лет и ≥65 лет обнаружено, что в когорте пожилых людей частота госпитализаций по поводу НР была статистически значимо выше (р<0,001). В шведском исследовании [9] наибольшее число зарегистрированных НР со смертельным исходом зарегистрировано у пожилых людей в возрасте 71–80 лет D.S. Budnitz et al. [10] подсчитали, что в США в 2004 и 2005 гг. среди всех обращений в отделение неотложной помощи более 700 тыс. пациентов обращались по поводу НР, из них 3487 были госпитализированы, причем на пожилых пациентов (≥65 лет) приходилось 25,3% обращений в отделения неотложной помощи, связанных с НР, и 48,9% случаев, требующих госпитализации. Авторы посчитали, что пациенты в возрасте 65 лет и старше имели в 2 раза больший риск развития НР, чем пациенты более молодого возраста (относительный риск [ОР]=2,4, 95% доверительный интервал [ДИ] – 1,8–3,0) и в 7 раз чаще риск госпитализаций в связи с развитием НР (ОР=6,8, 95% ДИ: 4,3–9,2) [10]. В другой работе тех же авторов [11], в которой особое внимание уделялось госпитализациям в связи с развитием НР у пациентов в возрасте ≥65 лет, отмечено, что почти половина госпитализаций приходилась на пациентов в возрасте 80 лет и старше (48,1%; 95% ДИ: 44,6–51,6), причем 2/3 из них были вызваны непреднамеренной передозировкой ЛС (65,7%; 95% ДИ: 60,1–71,3).
В ряде исследований авторы изучали возникновение НР у пожилых людей, находившихся в домах длительного ухода (домах престарелых). Так, в проспективном когортном исследовании пациентов, находившихся в домах длительного ухода в США, показало, что в течение 12 месяцев по крайней мере у 14% пациентов наблюдались НР [11]. В исследовании, посвященном госпитализации жителей домов престарелых, связанных с НР, у 15,7% из 332 жителей домов престарелых была по крайней мере одна госпитализация и было обнаружено, что это событие напрямую связано с количеством лекарств, принимаемых в сутки [12].
J. Stevenson et al. [13] высказали убеждение, согласно которому для профилактики и коррекции НР у пожилых людей необходим комплексный подход, а возникновение у них НР у следует рассматривать как гериатрический синдром (многофакторное возраст-ассоциированное клиническое состояние, ухудшающее качество жизни, повышающее риск неблагоприятных исходов: смерти, зависимости от посторонней помощи, повторных госпитализаций, потребности в долгосрочном уходе, и функциональных нарушений).
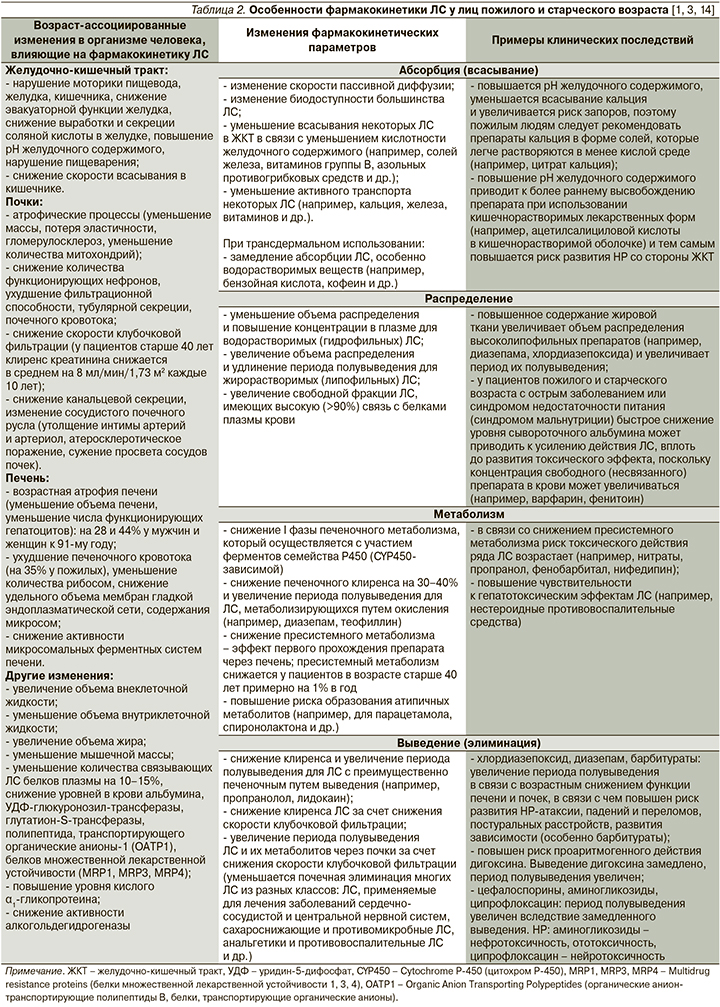
У пожилых людей происходят определенные изменения структуры и функции органов и систем, вызванные естественными процессами старения организма, которые могут потенциально влиять на фармакокинетику и фармакодинамику ЛС, повышая риск развития НР и ЛИЗ. Возраст-ассоциированные изменения фармакокинетических параметров могут возникать на этапах абсорбции (всасывания), распределения, метаболизма и выведения (элиминации) ЛС (табл. 2) [1, 3].
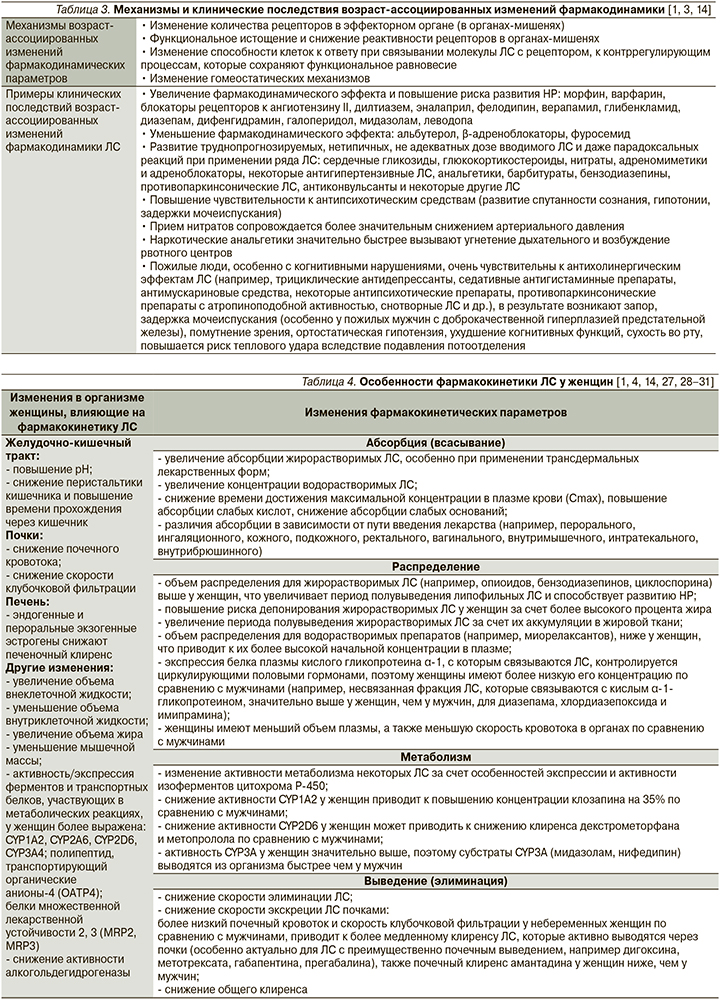
Возраст-ассоциированные изменения фармакодинамических параметров могут приводить как к увеличению эффекта ЛС и, следовательно, к повышению риска развития НР при использовании его в стандартных дозах, так и к уменьшению эффекта ЛС, что диктует необходимость использования более высоких доз, увеличения кратности приема ЛС, добавления других ЛС для достижения необходимого терапевтического эффекта, что в конечном итоге обусловливает увеличение риска развития межлекарственных взаимодействий и таким образом НР и ЛИЗ (табл. 3) [1, 3, 14].
Для профилактики развития НР и ЛИЗ у лиц пожилого и старческого возраста рекомендуется:
- применять специально разработанные валидированные критерии, например STOPP/START-критерии [15], критерии Бирса [16], критерии FORTA (Fit fOR The Aged) [17], индекс рациональности ЛС [18];
- регулярно мониторировать развитие как эффектов назначенного ЛС, так и НР;
- регулярно (в амбулаторных условиях не реже чем 1 раз в полгода) пересматривать лист назначений на наличие ЛС, применение которых пожилыми пациентами нежелательно (связано с повышенным риском развития НР и/или отсутствует достаточное количество доказательств их эффективности) в соответствии со специально разработанными валидированными критериями;
- при назначении ЛС, выборе режима дозирования и пути введения ЛС необходимо учитывать связанные с возрастом изменения фармакокинетики и фармакодинамики ЛС;
- необходимо корректировать дозу и кратность применения некоторых ЛС, используя принцип применения малых доз на начальном этапе лечения с последующей медленной титрацией (подбором) терапевтической дозы (“start low and go slow”) [1, 3];
- поддерживающие дозы ЛС со сниженным печеночным клиренсом должны быть уменьшены пропорционально степени снижения метаболизма (ввиду высокой вариабельностью данного параметра, коррекция дозы должна быть индивидуализирована [19-21];
- для определения суточной доза и/или частоты приема ЛС, которые в значительной степени выводятся почками, используется клиренс креатинина, при снижении функции почек суточная доза и/или частота приема ЛС должны быть уменьшены [1, 3, 20, 21].
Женский пол
Одним из значимых факторов, увеличивающих риск развития НР при применении ЛС, является пол пациента: по некоторым данным, риск развития НР у женщин в 1,5–1,7 раза выше, чем у мужчин [4]. Причины более частого развития НР у женщин окончательно не установлены. На степень риска развития ЛИЗ оказывают влияние такие факторы, как половые различия в структуре и частоте назначения ЛС, некоторые анатомические и физиологические различия мужского и женского организма, различия уровней половых гормонов [1, 4]. У женщин деятельность органов и систем и, следовательно, абсорбция, распределение, метаболизм и выведение ЛС несколько отличаются от таковых у мужчин [1, 4, 22–26]. Фармакокинетические параметры могут в значительной степени изменяться в зависимости от анатомо-физиологических особенностей женского организма, а также уровня половых гормонов в течение жизни, в различные фазы менструального цикла и во время беременности (табл. 4), тем самым повышая риск развития НР и ЛИЗ [1, 4, 14, 27, 28–31].
Кроме того, описано несколько механизмов влияния половых гормонов на риск развития НР за счет влияния их уровня на фармакокинетику и фармакодинамику ЛС (табл. 5) [1, 4, 28, 29, 32].

Изменения фармакодинамических параметров у женщин могут приводить как к увеличению действия ЛС на организм и тем самым к увеличению риска развития дозозависимых НР при использовании ЛС в стандартных дозах, так и к уменьшению эффекта ЛС, что диктует необходимость использования более высоких доз, увеличения кратности приема ЛС, назначения дополнительных препаратов для достижения терапевтического эффекта и, следовательно, увеливает риск развития межлекарственных взаимодействий и НР (табл. 6) [1, 4, 28, 32].

Для профилактики развития НР и ЛИЗ у лиц женского пола рекомендуется [4]:
- до начала терапии любыми ЛС определять статус приема женщинами препаратов половых гормонов с целью заместительной гормональной терапии или контрацепции;
- использовать более низкие по сравнению с мужчинами дозы липофильных ЛС и ЛС, эффективность которых у женщин выше, чем у мужчин;
- подбор и коррекцию дозы ЛС, элиминируемых преимущественно через почки, осуществлять в зависимости от скорости клубочковой фильтрации;
- регулярно контролировать жизненно важные показатели (например, длительность интервала QTс) в случае использования ЛС, которые потенциально могут оказывать на них негативное влияние.
Раса
Раса и/или регион происхождения пациента позволяют с известной долей вероятности судить о его генотипе [1]. В соответствующих исследованиях были идентифицированы генетические факторы, которые предрасполагают к развитию ЛИЗ и имеют большую распространенность у лиц определенной расы (табл. 7) [33–45].

Например, лица народности Хань (в русском языке часто их называют лица китайской расы, китайцы) имеют повышенную частоту носительства аллеля HLA-B*-1502 (полиморфизмы rs3909184G>C и rs2844682G>A), что является сильным независимым предиктором развития тяжелых кожных НР, включая синдромы Стивенса–Джонсона и Лайелла, ассоциированных с приемом противоэпилептического препарата карбамазепина [34–36]. Так, W.-H. Chung et al. [37] у людей народности Хань описали связь между HLA-B*1502 и возникновением синдрома Стивенса–Джонсона на фоне лечения карбамазепином. У каждого пациента в этом исследовании, у которого развился синдром Стивенса–Джонсона на фоне приема карбамазепина, обнаружен аллель B*1502 гена HLA, по сравнению менее чем с 5% пациентов, которые хорошо перенесли прием карбамазепина и у которых не наблюдалось развития синдрома Стивенса–Джонсона. В более позднем небольшом исследовании, проведенном С. Lonjou et al. [38] в Европе, где частота аллелей HLA-B*1502 значительно ниже, было выявлено, что только меньшая часть пациентов с синдромом Стивенса–Джонсона, развившегося на фоне приема карбамазепина, несут этот конкретный гаплотип, и, что достаточно интересно, эти 4 пациента были азиатского происхождения. Полученные в этом исследовании результаты могут означать, что жители Восточной Азии с отрицательным результатом теста на HLA-B*1502 почти не имеют риска развития синдрома Стивенса–Джонсона на фоне приема карбамазепина, в то время как то же самое не относится к лицам европеоидной расы, у которых, по-видимому, необходимо искать другие генетические маркеры, ассоциированные с более высоким риском развития синдрома Стивенса–Джонсона, неизвестных в настоящее время [39, 40].
Похожая ситуация связана с развитием реакции гиперчувствительности на фоне приема препарата абакавир (применяется при лечении ВИЧ), для которой аллель HLA-B*5701 ассоциирован с повышенным риском развития данной НР. Этот генетический маркер обладает более высокими специфичностью и чувствительностью у лиц еврапеоидной расы по сравнению с лицами негроидной расы [41, 42].
Таким образом, основываясь на расе/национальности пациента, можно предполагать с определенной долей вероятности наличие подобного генетического полиморфизма.
С другой стороны, известно несколько примеров более частого развития серьезных НР у лиц определенной расы, однако в этих случаях генетические маркеры, которые бы объясняли подобную взаимосвязь, не установлены. Так, S.E. McDowell et al. [43] провели систематический обзор и мета-анализ для выявления расовых различий в развитии НР на фоне приема ЛС для лечения заболеваний сердечно-сосудистой системы. В результате они обнаружили, что у пациентов негроидной расы риск развития НР в виде ангионевротического отека на фоне приема ингибиторов ангиотензинпревращающего фермента (иАПФ) в 3 раза, а риск внутричерепного кровотечения при тромболитической терапии в 2 раза выше по сравнению с пациентами других рас. Несмотря на то что данный факт широко известен, до сих пор остаются неясными ни механизмы развития, ни генетическая основа данных НР [35, 44, 45].
Поскольку различия и сходство людей одной расы на основе их географического региона проживания и/или по внешним признакам не всегда совпадают с генетическими различиями и сходством, вероятнее всего, для выявления причины развития той или иной НР идентификации одной только расы будет недостаточно. Возможно, наибольшее влияние в этом направлении окажут будущие исследования в отношении фармакогенетики ЛИЗ [33].
Беременность
Беременность является важнейшим ФР развития НР у плода, особенно отсроченных НР (тип D) – последствия приема ЛС, которые появляются через несколько месяцев или лет (в т.ч. тератогенность), согласно классификации Всемирной организации здравоохранения [1, 46]. Применение тератогенных ЛС во время I триместра беременности может оказывать драматически неблагоприятное воздействие на развитие органов и систем плода, а применение определенных ЛС во II и III семестрах беременности – на рост, функционирование органов и систем, метаболические процессы, обусловливать когнитивные и поведенческие расстройства у ребенка [47].
С точки зрения потенциальной опасности воздействия ЛС на эмбрион и/или плод выделяют 5 периодов [48, 48]: предшествующий зачатию, с момента зачатия по 11-й день, с 11-го дня до 3-й недели (органогенез), с 4-й по 9-ю неделю, с 9-й недели до родов. С точки зрения формирования врожденных аномалий наиболее опасен третий период (органогенез), именно поэтому прием ЛС особенно нежелателен во время I триместра беременности [47]. Считается, что период, когда ЛС могут вызывать тератогенный эффект, – это период с 31-й по 81-й день после последней менструации [48, 50, 51].
Из множества классификаций категорий риска тератогенности ЛС при беременности наиболее широко используется классификация FDA (Food and Drug Administration) [48, 52]:
Категория А (отсутствие риска): ЛС из этой группы безвредны для плода на протяжении всей беременности.
Категория В («best» – «лучшие») – нет доказательств риска: в экспериментальных исследованиях на животных не было выявлено тератогенного действия либо наблюдаемые у животных осложнения не обнаружены у детей, матери которых принимали ЛС, входящие в эту группу.
Категория C («caution» – «осторожность») – риск не исключен: в экспериментальных исследованиях на животных выявлено тератогенное или эмбриотоксическое действие препарата, контролируемых исследований не проводилось, либо действие препарата не изучено.
Категория D («dangerous» – «опасные») – риск доказан: применение препарата сопряжено с определенным риском для плода, однако польза их применения превосходит возможные НР.
Категория X (провотивопоказаны при беременности): доказано тератогенное действие препаратов этой группы.
На фоне беременности в организме женщины происходит ряд изменений (задержка опорожнения желудка и повышение рН желудочного содержимого, увеличение сердечного выброса, увеличение печеночного кровотока, увеличение общего количества воды в организме, внеклеточной жидкости, жира, увеличение почечного кровотока и скорости клубочковой фильтрации, снижение свободной фракции материнского альбумина, изменение активности CYP450 и др.), которые оказывают влияние на фармакокинетику ЛС [53]. Так, беременность ассоциирована со снижением степени и скорости абсорбции ЛС, повышением объема распределения ряда медикаментов, в частности липофильных, повышением клиренса лекарственных препаратов с почечным путем выведения, повышением активности ферментов, метаболизирующих ЛС, цитохромов печени Р-450, в частности цитохрома CYР3A4 [53, 54]. Хотя эти изменения фармакокинетики в значительной степени оказывают влияние на организм женщины, они проявляются в основном снижением ответа на прием ЛС, т.е. снижением их терапевтической эффективности, а не повышением риска развития НР.
На фармакокинетику ЛС у беременных женщин и, следовательно, эффективность фармакотерапии, влияет изменение уровней эндогенных половых гормонов. Именно под действием эстрогенов происходит увеличение объема циркулирующей крови и внеклеточной жидкости, которые оказывают влияние на распределение и клиренс ЛС, но в первую очередь изменяется активность ферментов [29]. Например, активность изофермента CYP1A2 снижается во время беременности, что приводит к изменению метаболизма, например кофеина и теофиллина [55]. Кроме того, во время беременности может наблюдаться подавление активности изофермента CYP2C19 эндогенными половыми стероидами [55]. Напротив, активность других ферментов (CYP2C9, CYP3A4 и UGT1A4) повышается, прежде всего во II и III триместрах. Наконец, активность ряда ферментов, таких, как например, CYP2D6, меняется на протяжении всей беременности, причем по-разному в различных триместрах [56]. Все эти изменения также обусловливают изменение фармакокинетики ЛС, которые в свою очередь могут приводить к снижению эффективности фармакотерапии. Однако в литературе отсутствуют исследования, в которых было бы проведено сравнение эффективности медикаментозной терапии до, во время и после беременности, поэтому клиническая значимость вышеперечисленных изменений фармакокинетики ЛС у беременных женщин в настоящее время неизвестна и требует изучения.
Исходя из вышеизложенного, беременность является ФР развития ЛИЗ у плода, но беременность в определенном смысле нельзя назвать ФР развития НР и ЛИЗ у матери [54].
Генетические особенности
В результате развития научно-технического прогресса значительно улучшилось понимание генома человека. Так, фармакогенетические исследования выявили генетические особенности, которые влияют на метаболизм ЛС и, следовательно, на терапевтическую эффективность и безопасность ЛС. Фармакогеномные исследования, в т.ч. полногеномное секвенирование и поиск гена-кандидата, выявили варианты генов, которые увеличивают риск развития ЛИЗ или НР [57]. Идентификация этих генетических вариантов повысила способность клиницистов прогнозировать развитие тех НР, которые ранее были классифицированы как идиосинкратические НР ЛС [58]. Вариабельность фармакологического ответа на прием ЛС в результате фармакогенетических факторов может быть результатом однонуклеотидных полиморфизмов, делеций, вставок, дупликаций или любых других изменений в последовательностях ДНК [59]. Наиболее распространенные варианты аллельных генов, которые изменяют фармакокинетику и фармакодинамику ЛС и повышают риск развития ЛИЗ или НР, находятся в генах, которые кодируют ферменты, метаболизирующие ЛС, переносчики (транспортеры) ЛС, рецепторы-мишени ЛС или HLA [1, 19]. Полиморфизм генов, кодирующих транспортеры ЛС, может существенно влиять на фармакокинетику ЛС, изменяя фармакодинамику и в конечном итоге эффективность и безопасность ЛС [19]. Причиной изменения фармакодинамики ЛС могут быть мутации генов белков, являющихся фармакологической мишенью для ЛС (рецепторы, ферменты, ионные каналы и т.д.), а также других белков, тем или иным образом связанных с фармакодинамикой ЛС [19].
HLA является ключевой молекулой иммунного ответа. Несколько фармакогенетических исследований продемонстрировали важную роль генов HLA в развитии ряда НР, которые ранее воспринимались как идиосинкразические побочные эффекты на ЛС [57]. Среди ассоциаций между аллелями HLA и НР, наиболее распространены лекарственное поражение печени и реакции гиперчувствительности. Серьезными НР, связанными с полиморфизмом гена HLA, являются тяжелые кожные побочные реакции гиперчувствительности, которые могут классифицироваться как реакции гиперчувствительности раннего или отсроченного типов [57]. Реакция гиперчувствительности раннего типа, обусловленная антителами иммуноглобулина Е (IgE), и роль генетических полиморфизмов в этом типе реакции не ясна. Реакция гиперчувствительности отсроченного типа зависит от Т-клеток иммунной системы и варьируется от легкой кожной сыпи до очень тяжелого синдрома гиперчувствительности, причем наиболее серьезные из этих реакций поражают не только кожу, но и другие органы и ткани, приводя к развитию синдрома Стивенса–Джонсона или токсическому эпидермальному некролизу [57].
В табл. 8 представлены примеры клинических последствий в зависимости от полиморфизма генов, ответственных за изменение фармакологического ответа [19, 60–80].


Поскольку все больше фармакогенетических тестов разрабатывается и внедряется в клиническую практику, возникла необходимость расширения знаний клиницистов в этой области. В связи с этим в 2009 г. был создан Консорциум по внедрению клинической фармакогенетики CPIC (Clinical Pharmacogenetics Implementation Consortium) [80]. На сегодняшний день группа экспертов опубликовала 26 клинических рекомендаций по дозированию ЛС на основе фармакогенетических тестов [81]. Рекомендации CPIC по применению ЛС, для которых генетических вариации могут приводить к развитию ЛИЗ или НР, представлены для таких ЛС, как варфарин [60], эфавиренз [62], вориконазол [66], атазанавир [72], симвастатин [73], абакавир [74], фенитоин [75], карбамазепин [76], окскарбазепин [76], аллопуринол [77], расбуриказа [82] (не зарегистрирована в РФ), ряда ЛС из группы НПВС [61], ИПП [65], СИОЗ [67], трициклические антидепрессанты [68], опиоидов [69], 5-фторурацила [70], тиопуринов [71], аминогликозидов [78], летучих анестетиков и сукцинилхолина [79]. Данные по клопидогрелу включают информацию как о генетических вариациях, которые могут приводить к развитию НР или ЛИЗ, так и о генетических вариациях, которые могут приводить к снижению его эффективности [125, 126]. Если генотип пациента известен, то можно предсказать его фенотип и таким образом спрогнозировать повышенный риск развития НР, провести превентивные меры для предотвращения или своевременного выявления потенциально возможного ЛИЗ на фоне проводимой терапии: применить оптимальный режим дозирования ЛС, тщательно мониторировать состояние пациента и провести его обучение.
Заключение
Для эффективной профилактики развития ЛИЗ до начала приема ЛС важно оценить наличие у пациента ФР их развития. В случае выявления немодифицируемых ФР необходимо использовать все известные меры по предотвращению развития потенциально возможного ЛИЗ, провести обучение пациентов, кроме того, очень важен тщательный мониторинг состояния пациентов для своевременного выявления потенциально возможного ЛИЗ на фоне проводимой терапии.
Вклад авторов. Д.А. Сычев, О.Д. Остроумова – концепция, дизайн исследования, редактирование. А.П. Переверзев, А.И. Кочетков, Т.М. Остроумова, М.В. Клепикова, Е.Ю. Эбзеева, В.А. Дё – сбор и обработка материала. М.С. Черняева – написание текста.



