Введение
Пигментация, или дисхромия, – это изменение окраски кожи, связанное с патологией синтеза меланина и других пигментов, присущих коже или внесенных извне. Наиболее часто в клинической практике встречается гиперпигментация (ГП) – врожденная или приобретенная пигментация, обусловленная нарушением меланогенеза в коже.
В зависимости от вида пигмента различают меланиновые и гемосидериновые ГП, каротинодермии (отложение каротина), желтухи и ГП, обусловленные попаданием в кожу чужеродных красящих веществ (татуировки, аргироз) [1]. Однако именно меланиновые ГП являются самыми распространенными и оказывают значительное негативное влияние на качество жизни пациентов. К основным причинам ГП можно отнести хроническое воздействие ультрафиолетового излучения, генетические и гормональные факторы [2]. Немаловажную роль в развитии ГП также имеют воспаление и травмы кожного покрова, приводящие к возникновению т.н. поствоспалительной ГП.
Наиболее характерным пигментом, определяющим цвет кожи, является меланин. Синтез меланина происходит в специальных органеллах, называемых меланосомами, которые в свою очередь вырабатываются меланоцитами. Выделяют два основных типа меланина – эумеланин и феомеланин. Эпидермис человека содержит примерно 74% эумеланина и 26% феомеланина независимо от степени пигментации [3].
Биосинтез обоих типов меланина происходит посредством каталитического превращения L-тирозина в DOPA-хинон при участии ключевого фермента тирозиназы с дальнейшим разделением схемы превращения на два основных каскада биохимических реакций, протекающих параллельно.
В случае эумеланина происходит череда последующих взаимодействий, приводящих к образованию различных олигомеров 5,6-дигидроксидиндол-2-карбоновой кислоты (DHICA) и 5,6-дигидроксидиндола (DHI), являющихся его основными компонентами. В синтезе же феомеланина DOPA-хинон связывается с L-цистеином без дополнительного каталитического действия ферментов, в результате чего образуются его главные компоненты – бензотиазин и бензотиазол [4].
Эумеланин является темным пигментом и имеет цвет от черного до коричневого в зависимости от соотношения DHI/DHICA, в то время как феомеланин является красным или желтым пигментом и преобладает в светлых фототипах. Таким образом, соотношение содержащихся в коже человека обоих типов меланина играет наиболее важную роль в определении фототипа по Фицпатрику [5].
Этиопатогенез ГП
Воздействие ультрафиолетового (УФ) света способно повреждать ДНК клеток. При этом основной механизм негативного воздействия реализуется за счет прямого поглощения ДНК УФ-излучения, поэтому основная функция меланина заключается в защите генетического аппарата клеток от УФ-излучения.
Физиологический ответ кожи на солнечное излучение зависит от производства, распределения, типа и количества меланина, синтезированного в меланоцитах. В цитозоле кератиноцитов меланосомы, вырабатывающие меланин, выступают в качестве своеобразного щита для ДНК клетки. Стоит также отметить, что эумеланин гораздо более фотопротекторен, чем феомеланин. На самом деле после воздействия УФ-излучения феомеланин может легко стать фотосенсибилизированным агентом, стимулируя перекисное окисление липидов и другие реакции, ведущие к множеству активных форм кислорода и последующим побочным эффектам.
Одним из клинических проявлений последствий воздействия УФ-излучения на кератиноциты является формирование ГП (рис. 1). Как ранее было отмечено, УФ-излучение способно повреждать ДНК клеток, что приводит к активации белка p53, который затем связывается с пропиомеланокортином (POMC) и индуцирует выработку α-меланоцитстимулирующего гормона (α-MSH). Когда α-MSH связывается с рецептором меланокортина-1 (MC1-R) на мембране меланоцитов, он активирует аденилатциклазу, увеличивает внутриклеточный цАМФ, что стимулирует транскрипционный фактор MITF и способствует активации меланогенеза [6].
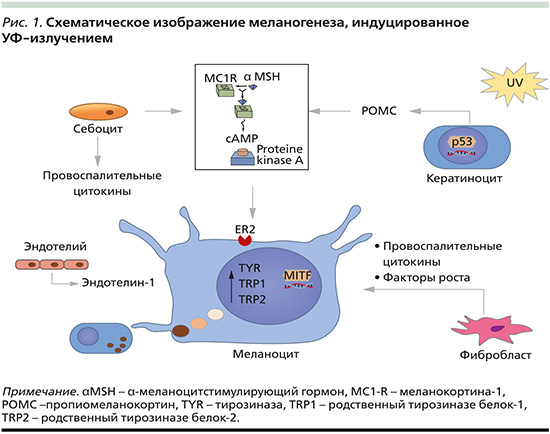
В дополнение, длительное воздействие УФ-излучения вызывает воспаление дермы и активирует фибробласты, которые выделяют различные факторы роста: стволовых клеток, кератиноцитов (KGF), гепатоцитов, которые в свою очередь также стимулируют меланоциты. Помимо прочего, возможно синергетическое действие УФ-излучения и видимого света. Фотобиологический эффект видимого света индуцируется через Опсин-3 (OPN3), в результате чего происходит фосфорилирование MITF и в конечном итоге – увеличение активности тирозиназы [7].
Генетическая предрасположенность считается одной из главных причин, влияющих на развитие ГП. Данные эпидемиологических исследований показывают, что существуют различия в появлении меланодермий у представителей разных рас, а также отмечают влияние отягощенного семейного анамнеза [2].
Склонность к расстройствам пигментации, в частности к мелазме и поствоспалительной ГП, описывается во всех расовых и этнических группах, но чаще всего встречается у лиц с более темным типом кожи (III–V типы по Фитцпатрику), живущих в районах интенсивного УФ-излучения, особенно в странах Латинской Америки, Азии и Африки. Семейные случаи меланодермии, по данным некоторых исследований, варьировались от самого низкого показателя (10,2%) в Сингапуре до самого высокого (61%) в Бразилии. Самый высокий процент семейного наследования был определен в исследовании «случай–контроль». Хотя показатели семейного наследования, собранные из разных стран и даже из одной и той же страны, показали широкий диапазон различий, на основании эпидемиологических исследований прослеживается тесная связь между отягощенным семейным анамнезом и меланодермией [1].
Кроме того, получены данные, что с возрастом может отмечаться повышение активности тирозиназы, белка TRP-1 и гена MITF. Эти исследования могут быть полезными для выяснения механизмов возрастной пигментации кожи, таких как меланодермия и солнечное лентиго [2].
Роль микроРНК в пигментации кожи выявлена в исследованиях на меланоцитах человека: микроРНК-145 регулирует синтез меланина и меланосомную транслокацию в меланоцитах под влиянием внешних стимулов. Кроме того, микроРНК-125b идентифицирована как регулятор меланогенеза в отсутствие воздействия внешних раздражителей. Потенциальная роль микроРНК в патогенезе мелазмы была также представлена в процессе изучения механизма действия РНК-H19. Было выявлено снижение экспрессии РНК-Н19 и микроРНК-675 в коже пациентов с меланодермией. Кроме того, чрезмерная экспрессия микроРНК-675 уменьшает экспрессию тирозиназы, TRP-1 и TRP-2, в то время как инактивация микроРНК-675 увеличивает их экспрессию. Хотя меланогенез происходит в меланоцитах, микроРНК-675 высвобождается из кератиноцитов. МикроРНК-675 содержится в экзосомах, которые представляют собой небольшие мембранные везикулы внутриклеточного происхождения. Высвобождаясь во внеклеточной среде, они содержат неизмененную и функционирующую микроРНК-675, являющуюся средством коммуникации между кератиноцитами и меланоцитами [8].
МикроРНК оказывают свое действие через мишени. В качестве одной из мишеней для микроРНК-675 был определен MITF. При понижении экспрессии микроРНК-675 возникает повышение уровня MITF у больных меланодермией. Было обнаружено, что отдельные микроРНК могут иметь в качестве мишени микроРНК и кадгерин 11 (CDH11), который также является мишенью и для микроРНК-675. Хотя экспрессия CDH11 не обнаруживается в меланоцитах, выявлено, что CDH11 в фибробластах или кератиноцитах стимулировал меланогенез с помощью сигнального пути Wnt и протеинкиназы В в культуре меланоцитов [9].
Также предполагается, что неблагоприятная экологическая обстановка может быть возможной причиной возникновения ГП. Загрязнение воздуха в виде взвешенных твердых частиц и ароматических полициклических углеводородов способствует их проникновению через кожные покровы в виде наночастиц. В дальнейшем происходит процесс генерации хинонов, которые участвуют в восстановительном цикле и производят активные формы кислорода. Твердые взвешенные частицы увеличивают производство активных форм кислорода, что является триггерным фактором повышения уровня металлопротеиназ, что ведет к внешнему старению, которое включает и ГП кожи [2].
В связи с возрастающим интересом к проблеме влияния экологических факторов на возникновение ГП некоторыми исследователями был предложен специальный термин «лентиго, индуцированное окружающей средой». Также предполагается роль активации арил-углеводородного рецептора посредством УФ-радиации и экологических токсинов, что играет важную роль в инициировании и поддержании нарушения межклеточного взаимодействия между меланоцитами, кератиноцитами и фибробластами, приводящего к развитию лентиго и его устойчивости к лечению, индуцированного окружающей средой в коже человека [10].
Несмотря на недавний прогресс в понимании патогенеза нарушений пигментации, связь между появлением ГП и каждым этиологическим фактором определена на сегодняшний день лишь частично. До сих пор остается неясным, какие факторы играют главную роль в запуске патогенетического механизма. Кроме того, не каждый пациент с ГП имеет сходные клинические и гистологические признаки. Предполагается, что развитие ГП может включать различные этиологические и патогенетические факторы.
Классификация ГП
Согласно классификации, неопухолевые меланиновые ГП подразделяются на первичные и вторичные. К первичным относятся врожденные/наследственные гипермеланозы (невус пигментный, лентигиноз наследственный, недержание пигмента, синдром Пейтца–Егерса) и приобретенные (мелазма, эндокринная меланодермия, токсическая меланодермия, артифициальная меланодермия), к вторичным – поствоспалительные, посттравматические меланодермии и татуировки [1]. Наиболее распространенными формами дисхромии являются мелазма и поствоспалительная ГП.
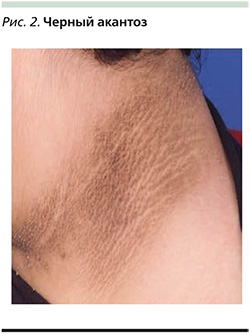
К эндокринным меланодермиям (первичным) относят черный акантоз (аcanthosis nigricans), который характеризуется симметричными, гиперпигментированными и бархатистыми бляшками с нечетко очерченными границами, обычно включающими интертригинозные участки (рис. 2). Ожирение является наиболее распространенной причиной аcanthosis nigricans, который все чаще наблюдается у детей и подростков и может являться кожным маркером инсулинорезистентности. Раннее распознавание аcanthosis nigricans важно, поскольку он также может быть кожным проявлением различных системных заболеваний и в редких случаях признаком внут-реннего злокачественного новообразования [16].
Артифициальная меланодермия – это искусственно вызванная ГП. В последнее время в связи с повсеместным применением капельниц, содержащих препараты железа, все чаще встречается данная нозология. Внутривенная инфузия железа может осложняться экстравазацией и приводить к стойкой пигментации кожи (рис. 3). Пигментация кожи после внутривенного введения железа может сохраняться с течением времени и нарушать качество жизни, особенно у молодых женщин [17].
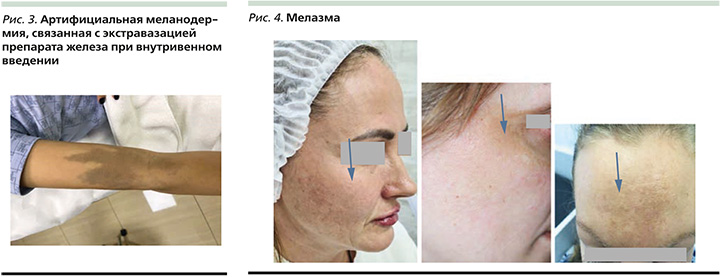
Мелазма – это приобретенный гипермеланоз, который поражает участки, богатые сальными железами у взрослых, особенно у женщин репродуктивного возраста (рис. 4). В возникновении мелазмы важную роль играют эстроген и прогестерон. Отмечается прямая зависимость между изменением в гормональном фоне и риском возникновения мелазмы. Так, в ряде исследований установлено, что у 8–34% женщин, принимающих оральные контрацептивы или заместительную гормональную терапию, и у 15,2% во время беременности развивалась мелазма [15].
Поздняя кожная порфирия – самая частая клиническая форма порфирии, которая характеризуется повышенной фотосенсибилизацией за счет нарушения порфиринового обмена. Выделяют наследственную (семейную) и спорадическую форму, чаще встречается у лиц зрелого возраста. Для спорадической формы основные триггеры включают прием эстрогенов (например, лечение аденомы у мужчин), контрацептивов, порфириногенных препаратов (гризеофульвин, антидиабетические препараты), злоупотребление алкоголем, сахарный диабет, гепатит С, ВИЧ-инфекция. Патогномоничный клинический признак поздней кожной порфирии – повышенная травматизация кожи с последующим формированием дисхромических очагов (рис. 5).
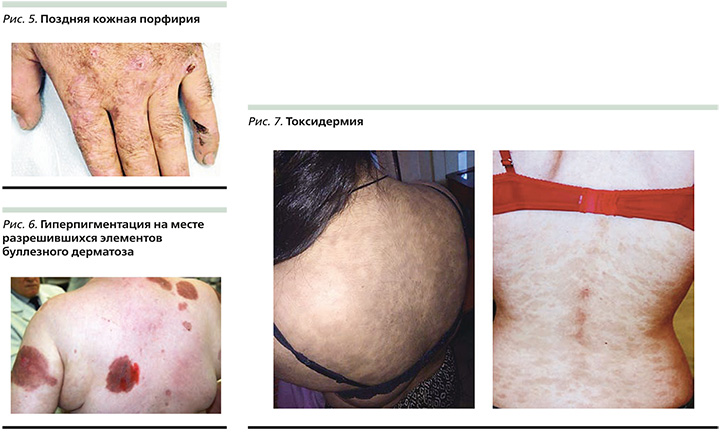
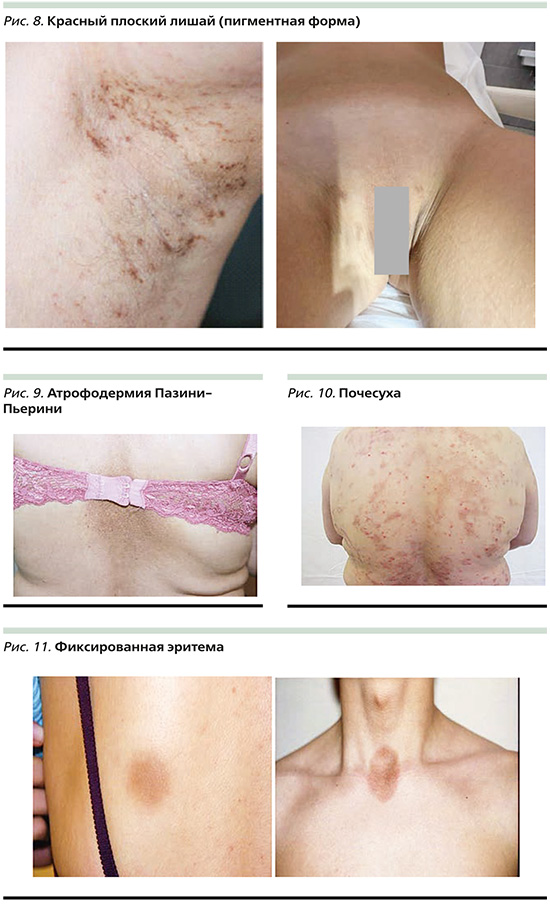
Поствоспалительная гиперпигментация (ПВГ) – самая частая причина формирования ГП. ПВГ чаще поражает людей с III–V фототипами кожи по Фицпатрику из-за повышенной реактивности меланоцитов [11]. ПВП возникает в результате избыточного производства меланина в ответ на эндогенные или экзогенные факторы. Эндогенными факторами считается наличие таких заболеваний, как акне, атопический дерматит, дерматиты, псориаз, красный плоский лишай, буллезные дерматозы, токсидермия, фиксированная эритема (рис. 6–11) и многие другие дерматозы [12].
ПВГ постакне (рис. 12), по данным исследования, встречается у 65,3% афроамериканцев, у 52,7% латиноамериканцев и у 47,4% азиатов [13].
У 90,5% афроамериканцев и латиноамериканцев с псевдофолликулитом развивается ПВГ [14].
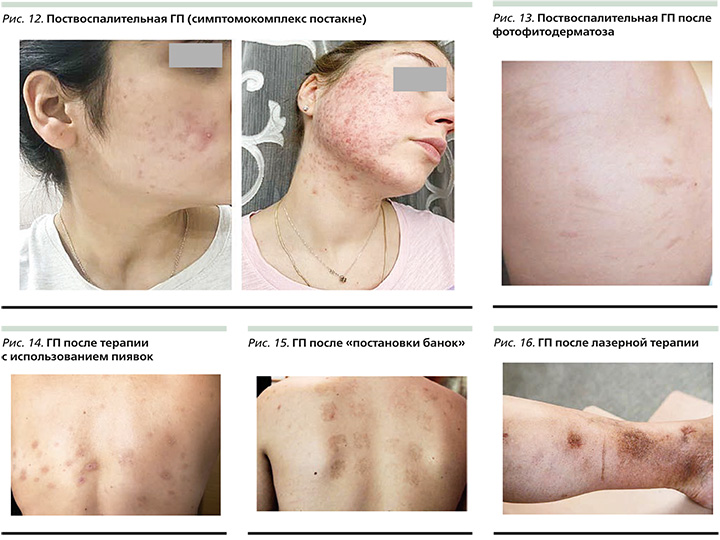
К экзогенным причинам, способствующим развитию ГП, относят воздействие внешних факторов с развитием контактного дерматита (фитоповреждение, ожоги, химические пилинги, лучевая терапия и лазерная шлифовка) (рис. 13–16).
Терапия ГП
Традиционная терапия ГП включает комбинацию фотозащиты и использования топических средств, пилингов, аппаратных методов (лазерные и световые технологии, RF-микроигольчатая терапия). Основной механизм действия данных методов основан на уменьшении продукции меланина и отшелушивании пигментированного эпидермиса. Потенциальные мишени для депигментирующих средств включают ингибиторы активности меланотропина, ингибиторы синтеза и активности тиразиназы, ингибиторы синтеза меланина [18]. Наиболее стойкие результаты в лечении ГП показала комбинация топической терапии и аппаратных методов [19].
Наиболее изученным и наиболее широко используемым местным активным ингредиентом для лечения ГП кожи является гидрохинон [20]. В Соединенных Штатах гидрохинон используется в концентрации 2% в лекарствах, отпускаемых без рецепта, и в концентрации 4% и выше в продуктах, отпускаемых по рецепту. Было продемонстрировано, что лечение 2%-ным гидрохиноном эффективно для лечения меланодермии [21]. Хотя гидрохинон довольно эффективно уменьшает ГП кожи, он имеет массу побочных эффектов: вызывает ирритантный дерматит, охроноз и поствоспалительную ГП [22]. Лечение более высокими концентрациями гидрохинона не должно превышать 3 месяцев, чтобы избегать серьезных побочных эффектов. Таким образом, необходим эффективный долгосрочный вариант лечения, альтернативный гидрохинону.
Ингибирование активности фермента тирозиназы является самым безопасным и эффективным способом уменьшения ГП. Однако клиническая эффективность современных ингибиторов тирозиназы ограничена из-за того факта, что они обычно выбирались на основе их способности ингибировать грибную тирозиназу [23].
В недавних исследованиях тиамидол был охарактеризован как особенно мощный ингибитор тирозиназы человека. In vitro тиамидол превосходил часто используемые ингибиторы ГП, такие как арбутин, койевая кислота и гидрохинон. Это превосходство тиамидола по сравнению с гидрохиноном было подтверждено в исследованих in vivo. Через 12 недель сторона лица, обработанная тиамидолом, продемонстрировала значительно более низкие показатели mMASI, чем сторона лица, обработанная гидрохиноном. Обращает на себя внимание тот факт, что концентрация тиамидола (0,2%), используемая в рецептуре, была в 10 раз ниже, чем используемая концентрация гидрохинона (2,0%). Во время лечения ни у одного из пациентов не наблюдалось обострения меланодермии на стороне лица, обработанной тиамидолом [24].
В исследованиях было показано, что тиамидол хорошо переносится, хорошо воспринимается пациентами и представляет собой эффективное и безопасное средство для борьбы с пигментацией. В нашей стране тиамидол доступен в форме сыворотки Eucerin anti-pigment dual serum, кроме того, его эффект усилен присутствием ликохалкона А, подавляющего секрецию эндотелиального фактора 1 и провоспалительных цитокинов. Также в линейке присутствует дневной и ночной кремы, что позволяет комплексно воздействовать на проявление меланодермий. Таким образом, можно рекомендовать серию Eucerin anti-pigment для домашнего использования в комплексной терапии ГП кожи различного генеза.


