Введение
Системная красная волчанка (СКВ) является хроническим аутоиммунным заболеванием неизвестной этиологии, характеризующимся иммуновоспалительным повреждением различных тканей и внутренних органов. У 50% больных СКВ с наличием антифосфолипидных антител (АФА) развивается вторичный антифосфолипидный синдром (АФС) [1, 2]. АФС – это симптомокомплекс, включающий рецидивирующие тромбозы и/или акушерскую патологию (чаще привычное невынашивание беременности) и связан с синтезом АФА: волчаночного антикоагулянта (ВА), антикардиолипиновых антител (аКЛ) и антител к β2-гликопротеиду I (анти-β2-ГП-I) [1]. Частота обнаружения АФА у больных СКВ колеблется от 12 до 44% для ВА и от 10 до 19% для анти-β2-ГП-I.
В 2003 г. был описан серонегативный вариант АФС, при котором в крови не определяются диагностически значимые титры «классических» антител, но могут присутствовать антитела к протромбину, аннексину V, фосфатидилэтаноамину, фосфатидилсерин/протромбиновому комплексу (аФС-ПТ) и к отрицательно заряженным фосфолипидам [3]. Роль этих антител в клинических проявлениях АФС до конца не определена. АФС может быть первичным или развиваться на фоне другого заболевания, чаще всего СКВ.
В терапии СКВ основная роль отводится препаратам с иммуносупрессивными свойствами: глюкокортикоидам (ГКС), цитостатикам (циклофосфамид [ЦФ], азатиоприн [АЗ], метотрексат [МТ], микофенолатомофетил [ММ]), аминохинолиновым средствам (хлорохин, гидроксихлорохин [ГХ]). ГКС короткого действия (преднизолон, метилпреднизолон) являются наиболее эффективным средством для лечения СКВ. При высокой активности СКВ для достижения быстрого контроля за проявлениями заболевания возможно использование пульс-терапии (метилпреднизолон 1000 мг в/в капельно последовательно три инъекции, а затем ежемесячно) [4, 5].
Цитотоксические препараты используются в комплексных схемах терапии совместно с ГКС, что позволяет ускорить достижение ремиссии и снизить поддерживающую дозу ГКС. ЦФ (Эндоксан) – препарат выбора для индукции ремиссии при волчаночном нефрите и тяжелом поражении центральной нервной системы. ЦФ используется совместно с ГКС в схеме комбинированной пульс-терапии и назначается по 1000 мг в/в капельно однократно в первый день [5]. АЗ (50–150 мг/сут) используется для поддержания индуцированной ЦФ ремиссии люпус-нефрита, лечения аутоиммунной гемолитической анемии, тромбоцитопении, при поражениях кожи, генерализованной СКВ. ММ (1000–3000 мг/сут) применяется в терапии люпус-нефрита. МТ (15–30 мг/нед) является препаратом выбора при волчаночном артрите и поражениях кожи. Назначение ГХ (200–400 мг/сут) снижает риск тромбообразования, способствует поддержанию ремиссии и предупреждению рецидивов у больных СКВ и АФА [4]. Роль иммуносупрессивной терапии больных СКВ с АФС в динамике АФА до сих пор не определена [5, 6].
Перспективы лечения больных СКВ с АФС связаны с использованием генно-инженерных биологических препаратов. Ритуксимаб (РТ) является химерным моноклональным антителом против антигена CD20, экспрессируемого на В-лимфоцитах и вводится по стандартной схеме, включающей две внутривенные инфузии по 500–100 мг с интервалом в 2 недели каждые 6 месяцев. Описаны данные о снижении уровня АФА на фоне терапии РТ у больных СКВ. Напротив, в исследовании D. Erkan и соавт. не обнаружено изменения в уровне АФА на фоне лечения РТ у больных СКВ и АФС [7, 8]. Несмотря на доказанную эффективность РТ в лечении СКВ, опыт его применения при СКВ с АФС весьма скромен и требует дальнейшего накопления.
В комплексном лечении СКВ с целью профилактики тромбозов у пациентов с АФС назначаются антиагреганты (ацетилсалициловая кислота, дипиридамол). При эпизодах тромбоза показаны антикоагулянты прямого действия (гепарин натрия с индивидуальным подбором дозы под контролем активированного частичного тромбопластинового времени, низкомолекулярный гепарин) с дальнейшим переводом на непрямые антикоагулянты – варфарин с контролем дозы по уровню международного нормализованного отношения [4].
Представленные данные свидетельствуют об отсутствии единой точки зрения о ведении больных СКВ с АФС.
Настоящее исследование было проведено с целью оценить влияние различных схем иммуносупрессивной терапии, включая применение РТ в варианте блокаторов пролиферации зрелых B-лимфоцитов, на клинико-иммунологическую активность и динамику АФА у больных СКВ с наличием и отсутствием АФС.
Материал и методы
В исследование были включены 52 больных СКВ, проходивших лечение в СПб. ГБУЗ КРБ № 25, из них 49 (94%) женщин и 3 (6%) мужчин. Средний возраст составил 45 лет, средняя продолжительность заболевания – 12 лет. Медиана активности СКВ по шкале SELENA SLEDAI была высокой и составила 12,2. Пациенты были распределены на две группы: основную группу составили 26 больных СКВ и с наличием АФА, из них 19 (70%) пациентов с СКВ и АФС и 7 (30%) больных СКВ без АФС. В контрольную группу вошли 26 пациентов с СКВ без АФА. Группы были сравнимыми по полу, возрасту, длительности и активности заболевания. В зависимости от проводимой иммуносупрессивной терапии пациенты основной и контрольной групп были распределены на две подгруппы: подгруппа А (в основной и контрольной группах по 7 больных) на первом этапе получала комбинированную пульс-терапию метилпреднизолоном 1000 мг в/в капельно № 3 и ЦФ 1000 мг в/в капельно однократно. Два пациента с СКВ и АФС основной группы получили РМ – 1000 мг в/в капельно два введения с перерывом в 2 недели. В последующем всем пациентам подгруппы А назначался преднизолон внутрь в дозе 0,5 мг/сут с постепенным снижением до 0,2 мг/сут, плаквенил – 200 мг/сут и АЗ – 100 мг/сут. Подгруппа В (в основной группе 17 больных, в контрольной – 19) исходно получала комбинированную терапию внутрь: преднизолон – 1 мг/кг/сут на протяжении 4 недель со снижением дозы до 0,2 мг/кг/сут, плаквенил – 200 мг/сут и АЗ – 100 мг/сут. Все пациенты с АФС (n=19) дополнительно получали дезагрегантную терапию в виде ацетилсалициловой кислоты 100 мг/сут.
Длительность наблюдения составила 6 месяцев. В динамике оценивалась активность СКВ по шкале SELENA SLEDAI. Методом иммунофлуоресценции определен уровень антител к двуспиральной ДНК, уровень компонентов комплемента С3 и С4 оценивался методом простой радиальной иммунодиффузии. Методом иммуноферментного анализа проведено определение уровня АФА: аКЛ IgG и IgM, анти-β2-ГП-IIgGAM, волчаночного антикоагулянта, аФС-ПТ и антител к аннексину V IgG/IgM. Анализ результатов исследования проведен с помощью программы STATISTICA 6.0, использованы методы непараметрической статистики (критерий U-теста Манна–Уитни). Уровень значимости принят за 0,05.
Результаты и обсуждение
Через 6 месяцев терапии в основной и контрольной группах показатели клинической активности СКВ по шкале SELENA SLEDA достоверно снизились по сравнению с исходными значениями и свидетельствовали о низкой активности болезни (табл. 1).
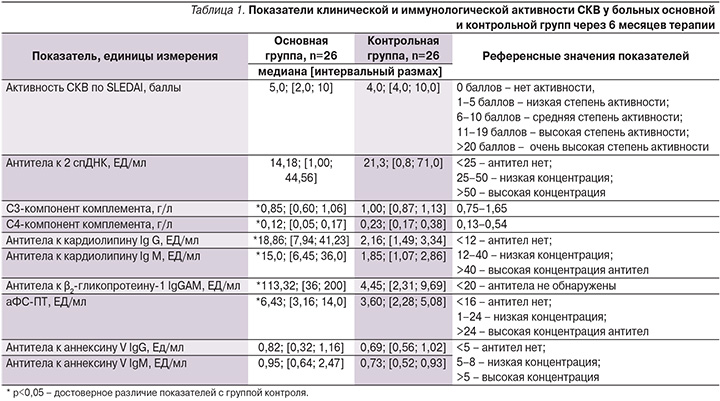
В основной группе медиана активности СКВ по SLEDAI оказалась выше, чем в группе контроля (5,0 и 4,0 балла соответственно), однако статистических различий по этому показателю выявить не удалось. Отмечены достоверно более низкие значения показателей С4- и С3-компонентов комплемента у больных СКВ и АФА по сравнению с группой СКВ без АФА (р<0,05). Напротив, уровни АФА (аКЛIgG и М, анти-β2-ГП-I и аФС-ПТ) оказались достоверно выше в основной группе, чем в группе контроля (р<0,05), хотя и не выходили за референсные значения нормы. Полученные изменения свидетельствовали о сохранившейся иммунологической активности больных СКВ и АФА после проведенного лечения. Важно отметить, что через 6 месяцев лечения у больных СКВ с бессимптомным носительством АФА (n=7) по сравнению с больными СКВ и АФС (n=19) были выявлены статистически более низкие показатели клинико-иммунологической активности по SLEDAI (Mе=2,0 [1,0; 6,0] и Mе=8,0 [5,0; 10,0], р=0,04; уровня аКЛ IgG Mе=4,08 [3,31; 10,52] и Mе=34,78 [11,00; 62,00] ЕД/мл, р=0,0004, и уровня анти-β2-ГП-I (Mе=27,80 [12,00; 200,00] и Mе=124,00 [41,00; 200,00] ЕД/мл, р=0,025 соответственно). Следовательно, у больных СКВ с АФС по сравнению с таковыми СКВ и носительством АФА отмечается более активное течение болезни, несмотря на проведенное лечение. Этот факт свидетельствует об обоснованности применения агрессивной иммуносупрессивной терапии пациентов с активным течением СКВ и АФС.
Сравнительная оценка клинико-иммунологических показателей у больных СКВ и СКВ с АФА в зависимости от проводимого лечения позволила установить, что через 6 месяцев терапии пациентов, исходно получавших пульс-терапию метилпреднизолоном и ЦФ, по сравнению с больными, получавшими терапию внутрь, показатели клинической активности по шкале SELENA SLEDA оказались ниже, хотя достоверных различий по этому показателю в изучаемых группах получено не было. Важно отметить, что к концу наблюдения у больных СКВ с АФА, получавших пульс-терапию, уровень аФС-ПТ и антител к аннексину V IgM оказался достоверно ниже, чем у больных этой группы, получавших комбинированную терапию внутрь (p=0,01 и 0,02 соответственно) (табл. 2). Полученные данные позволили установить, что применение высокодозных схем комбинированной пульс-терапии эффективно снижает антителопродукцию у больных СКВ с АФА, следовательно, приводит к уменьшению риска тромботических осложнений и улучшению прогноза данного заболевания. Та же тенденция наблюдалась у больных контрольной группы. У пациентов с СКВ без АФА, исходно получавших пульс-терапию метилпреднизолоном и ЦФ, по сравнению с больными, получавшими терапию внутрь, уровень анти-β2-ГП-I через 6 месяцев лечения оказался достоверно ниже (2,49; [0,08; 3,69] и 5,57; [2,78; 12,0] ЕД/мл соответственно, р<0,05), (табл. 2).
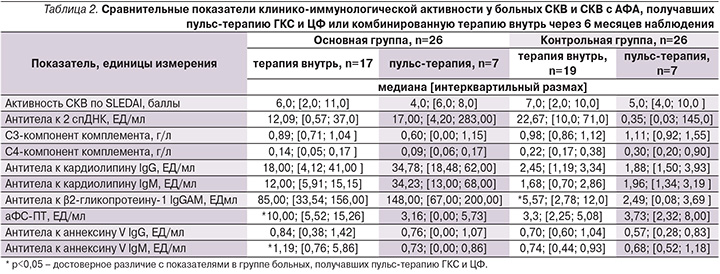
Пульс-терапия ГКС и ЦФ по сравнению с иммуносупрессивной терапией внутрь у больных СКВ с АФС через 6 месяцев наблюдения способствовала более значимому снижению активности СКВ по шкале SLEDAI, антител к кардиолипину IgM, IgG, аннексину V IgM и аФС-ПТ (p<0,05 соответственно). Интересно отметить, что у двух больных СКВ с АФС, получавших ритуксимаб, после двух инфузий показатели активности СКВ по шкале SLEDAI снизились более чем в 3 раза (с 14,2 до 4,6 и с 12,8 до 4,1 балла), уровень аФС-ПТ снизился почти в 5 раз (с 4,97 до 0,00 и с 5,01 до 0,00 ЕД/мл), а уровень антител к аннексину V IgM − более чем в 10 раз (с 1,12 до 0,00 и с 0,97 до 0,00 ЕД/мл). Можно полагать, что применение ритуксимаба больными СКВ с АФС является эффективным методом иммуносупрессивной терапии, однако эти данные требуют дальнейшего подтверждения на большем количестве наблюдений.
Выводы
- У больных СКВ с АФС по сравнению с больными СКВ без АФС и СКВ с бессимптомным носительством АФА наблюдаются более значимая клиническая активность по шкале SLEDAI и высокий уровень аКЛ IgG и анти-β2-ГП-I.
- При активном течении СКВ с АФС применение интенсивных схем иммуносупрессивной терапии, включающих комбинированную пульс-терапию метилпреднизолоном и ЦФ, способствует существенному снижению клинической активности по шкале SLEDAI и уровня АФА (аФС-ПТ, антител к аннексинуIgM, анти-β2-ГП-I), что приводит к уменьшению риска тромботических осложнений и улучшению прогноза данного заболевания.
- У двух больных СКВ с АФС, получивших две инфузии ритуксимаба, через 6 месяцев наблюдения показатели активности СКВ по шкале SLEDAI снизились более чем в 3 раза, уровень аФС-ПТ – в 5 раз, а уровень антител к аннексину V IgM – более чем в 10 раз. Полученные данные о высокой эффективности ритуксимаба для больных СКВ с АФС требуют дальнейшего подтверждения на большем количестве наблюдений.



