Группа системных васкулитов, ассоциированных с антинейтрофильными цитоплазматическими антителами (АНЦА-СВ), включающая гранулематоз с полиангиитом (ГПА), микроскопический полиангиит (МПА) и эозинофильный гранулематоз с полиангиитом (ЭГПА) [1], относится к редким аутоиммунным заболеваниям, на долю которых приходится примерно 20 случаев на 1 млн населения в год [2]. АНЦА-СВ характеризуются полиорганным поражением, гетерогенностью клинико-иммунологических форм, разнообразием манифестных проявлений и на всех этапах их течения требуют качественного взаимодействия между пациентом и ревматологом, а также врачами различных специальностей: в случаях с доминирующим тяжелым поражением почек в кооперации с нефрологами и специалистами отделения гемодиализа, в отдельных случаях с привлечением отоларингологов, офтальмологов, кардиологов, гастроэнтерологов, невропатологов, хирургов. Редкость АНЦА-СВ, сложность диагностики и ведения пациентов с этими заболеваниями, мало известными широкому кругу практикующих врачей, приводят к поздней постановке диагноза, неадекватному лечению и ухудшению прогноза.
Ключевая роль в ведении больных АНЦА-СВ, несомненно, должна принадлежать высококвалифицированным ревматологическим центрам. Так, в Европейских рекомендациях 2015 г., посвященных стандартам диагностики и лечения ЭГПА [3], на первое место вынесено положение о том, что ведение больных следует осуществлять при непосредственном участии центров, имеющих достаточный опыт работы с СВ. Это мнение базируется на итогах 20-летнего ретроспективного исследования более 100 пациентов с ЭГПА, согласно которому квалифицированное ведение больных ассоциировалось с более мягким течением заболевания и увеличением продолжительности жизни [4]. В рекомендациях Британского общества ревматологии (2014) также подчеркнуто, что пациенты с АНЦА-СВ должны получать лечение в экспертных центрах, обладающих большим опытом диагностики и лечения СВ с возможностью обращения в них в кратчайшие сроки; отмечена необходимость долгосрочного наблюдения больных АНЦА-СВ и персонифицированного подхода, важность включения пациентов в регистры [5]. В 2015 г. к наиболее перспективным направлениям дальнейших исследований европейские эксперты отнесли мониторинг пациентов и развитие международных регистров больных [3].
В ответ на возросшую потребность в совершенствовании подходов к ведению пациентов с АНЦА-СВ в ФГБНУ НИИР им. В.А. Насоновой при поддержке Общероссийской общественной организации «Ассоциация ревматологов России» разработан и с 2011 г. и поэтапно внедряется Национальный регистр больных АНЦА-СВ (НРАВ), представляющий собой регулярно обновляемую электронную базу динамического мониторинга пациентов с АНЦА-СВ, к настоящему времени объединившую более сотни больных, получающих анти-В-клеточную терапию ритуксимабом (РТМ) в ФГБНУ НИИР им. В.А. Насоновой и ряде регионарных медицинских учреждений. Предварительные результаты анализа НРАВ были опубликованы в 2014 г. [6].
За последние десятилетия существенно видоизменились цели терапии АНЦА-СВ: от сохранения жизни пациентов до поддержания стабильной ремиссии, снижения нежелательных реакций (НР) на лечение, контроля коморбидной патологии и достижения высокого качества жизни. Расширение потенциальных целей терапии АНЦА-СВ во многом стало возможным благодаря появлению новых стратегий лечения.
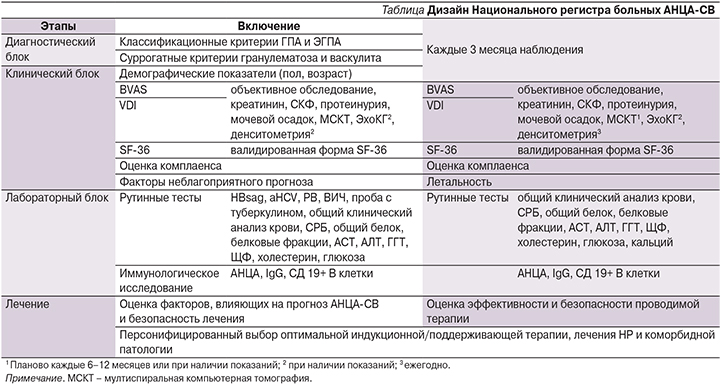
НРАВ следует рассматривать как инновационный инструмент, в рамках которого эти цели могут быть воспроизводимо достигнуты в соответствии с современной концепцией лечения СВ «до достижения цели» (treat to target) [7]. В основе НРАВ лежит регулярная, каждые 3 месяца, оценка клинических параметров и небольшого числа, как правило рутинных, лабораторных показателей (см. таблицу), воспроизводимых в любом центре ревматологии. Участие пациентов в НРАВ позволяет обеспечить преемственность лечения на разных его этапах – стационарном и амбулаторном.
Клиническая оценка включает Бирмингемский индекс активности СВ (Birmingham Vasculitis Activity Score, BVAS) [8], индекс повреждения органов и систем вследствие СВ (Vasculitis Damage Index, VDI) [9], оценку комплаенса и качества жизни по форме SF-36 [10] в версии, валидированной в России [11].
Индексы BVAS и VDI являются общепринятыми международными методами клинической оценки АНЦА-СВ, BVAS используют для оценки конечной точки в клинических исследованиях [12] и рассматривают как ключевую цель лечения «до достижения цели» (treat to target). Совокупность применяемых в НРАВ методов клинической оценки (BVAS, VDI, SF-36) рекомендована международными экспертами как основа рационального подхода к стандартизации больных СВ, выбора оптимального протокола лечения и оценки прогрессирования патологического процесса [13]. Эта концепция была поддержана в рекомендациях EULAR и Британского общества ревматологии [14, 15], но еще не получила широкого распространения в клинической практике.
Качество жизни больных АНЦА-СВ непосредственно связано с активностью заболевания, достижение ремиссии способствует его восстановлению [16]. Снижение качества жизни у больных СВ ассоциируется с пожилым возрастом (р<0,01), женским полом (р<0,04), тяжестью СВ (р<0,001) и небольшой продолжительностью заболевания (р<0,02). При легком течении СВ показатели качества жизни выше (р<0,001) [17]. Интересно, что, по данным тестирования больных АНЦА-СВ с использованием SF-36, наиболее низкие показатели наблюдаются в отношении физического функционирования (28,6 балла) и ролевого физического функционирования (21,3 балла), в то время как психологическое здоровье и ролевое эмоциональное функционирование было наименее подвержено изменениям; среди психических параметров наибольшее снижение отмечено в социальном функционировании (30,6 балла) [18].
Для уточнения BVAS и VDI требуется проведение ряда лабораторных и инструментальных исследований. Следует отметить, что МСКТ и магнитно-резонансная томография не позволяют стандартизировать при АНЦА-СВ оценку активности поражения респираторных органов [19], что может стать направлением дальнейшего развития. Интересные результаты могут быть получены при внедрении сцинтиграфии с мечеными аутологичными лейкоцитами для визуализации активного поражения верхних дыхательных путей при ГПА [20].
Признанные биомаркеры активности и предикторы рецидива АНЦА-СВ до настоящего времени отсутствуют, вопрос значения АНЦА для мониторинга активности дискутируется. С одной стороны, повышение титра или персистенция АНЦА в период ремиссии, по данным мета-анализа, имеет очень ограниченное значение [21], при значительном повышении титра АНЦА в период ремиссии у 29% пациентов стойко отсутствуют клинические проявления заболевания [22]. С другой стороны, показано, что у АНЦА-негативных больных с ремиссией, индуцированной циклофосфаном (ЦФ), переключение на лечение азатиоприном позволяет поддерживать ремиссию в 80% случаев через 2 года, в 62% – через 4 года, в то время как в АНЦА-позитивных случаях после назначения азатиоприна ремиссия сохраняется реже: через 2 года – у 58%, через 4 года – у 17% больных [23]. Отмечено несовпадение клинической ценности разных методов определения АНЦА – непрямой реакции иммунофлуоресценции (НРИФ) и иммуноферментного анализа (ИФА). Так, прогностическое значение увеличения титра АНЦА в отношении риска рецидива для НРИФ с цитоплазматическим типом свечения составляет 57%, для ИФА антител к протеиназе-3 – 71%, для ИФА антител к миелопероксида-зе – 100% [22].
Традиционные лабораторные маркеры воспаления, С-реактивный белок (СРБ) и СОЭ при АНЦА-СВ не надежны, поскольку могут отражать присутствие инфекции, особенно часто сопровождающей ГПА, при котором поражение верхних дыхательных путей нередко ассоциировано с носительством Staphylococcus aureus [24]. Показатели функции почек (креатинин, скорость клубочковой фильтрации – СКФ), несомненно, важны для оценки активности гломерулонефрита, но могут отражать хроническое повреждение почек вследствие АНЦА-СВ или плохо контролируемой гипертонии. Вместе с тем повышение уровня креатинина в сочетании с изменениями мочевого осадка, без сомнения, свидетельствуют об активности АНЦА-СВ и необходимости эскалации терапии.
Таким образом, комплексный подход при анализе клинико-лабораторных данных в каждом конкретном случае АНЦА-СВ приобретает важное значение для выбора оптимальной лечебной стратегии.
Лечение АНЦА-СВ подразделяют на этапы индукционной и поддерживающей терапии. Современную терапию АНЦА-СВ, так же как и онкогематологической патологии, осуществляют в соответствии с протоколами, разработанными в результате систематически и транспарентно развивающегося международного научного процесса и представляющими собой научно-обоснованные, ориентированные на практику руководства.
Всем пациентам с дебютом АНЦА-СВ, представляющим угрозу для жизни или необратимого повреждения органов, рекомендована стандартная индукционная схема с назначением высоких доз глюкокортикостероидов (ГКС) и ЦФ или инновационная терапия РТМ (уровень доказательности 1А) [5,25]. Монотерапия ГКС не оказывает существенного влияния на прогноз АНЦА-СВ, выживаемость больных генерализованным ГПА при монотерапии ГКС не превышает трех лет [26].
В соответствии с результатами рандомизированного клинического исследования (РКИ) индукционная терапия ЦФ позволяет достигать ремиссии у 88% больных АНЦА-СВ [27]. Позднее назначение ЦФ в 2 раза увеличивает риск генерализации ГПА и способствует более тяжелому течению заболевания с высокой клинической активностью и персистенции гранулематозного воспаления [28]. Среди причин возможной недостаточной эффективности ЦФ можно отметить запоздалое начало лечения, обусловленное поздней диагностикой, наличие прогностически неблагоприятных вариантов АНЦА-СВ, нарушение схемы индукционной терапии, нередко вынужденное из-за присоединения инфекционных НР. К предикторам неблагоприятного исхода АНЦА-СВ помимо инфекции относят СКФ <15 мл/мин, пожилой возраст больных, высокую клиническую активность и низкий уровень гемоглобина [29, 30].
Системные проблемы в лечении АНЦА-СВ могут быть связаны с неполным выполнением или ошибочным применением в условиях реальной клинической практики научно-обоснованных протоколов лечения. Присутствует тенденция к необоснованному применению редуцированных доз ЦФ, удлинению интервала между инфузиями, игнорированию контроля общей кумулятивной дозы ЦФ, недостаточному мониторингу показателей эффективности и безопасности лечения. Повсеместно в мире обращают внимание на рост в медицине разрыва между теоретическими знаниями и прикладной деятельностью [31].
С другой стороны, жесткое внедрение протоколов диагностики и лечения может приводить к сужению врачебного мышления и ошибкам.
Развитие регистра больных АНЦА-СВ как федеральной программы может играть ключевую роль в повышении эффективности лечения редких и тяжелых заболеваний, способствовать развитию информационных и телекоммуникационных медицинских технологий для обеспечения в кратчайшие сроки возможности консультативной и лечебной помощи пациентам с вероятным или уточненным АНЦА-СВ в экспертных центрах, уменьшению фармакоэкономических затрат.
В соответствии с данными недавно опубликованного американского медико-экономического исследования, включившего 2784 больных ГПА и 612 больных МПА [32], в группе пациентов с ГПА с тяжелым рецидивом финансовые расходы в течение 12 месяцев были существенно выше, чем у пациентов со стойкой ремиссией, что затрагивало как общие расходы на их ведение (соответственно 88 065 и 30 682 млн долл.; р<0,0001), так и расходы, непосредственно связанные с ГПА (соответственно 61 636 и 15 748 млн долл.; р<0,0001). Таким образом, развитие рецидива в 4 раза повышает ежегодные финансовые расходы на лечение ГПА. По сравнению с ГПА ежегодные расходы на ведение больных МПА были в 2 раза выше (30 166 и 56 642 млн долл.; р<0,0001).
Несмотря на внедрение стандартной терапии ЦФ, риск смерти при АНЦА-СВ повышен в 2,6 раза по сравнению с общей популяцией. Основными причинами смерти в течение первого года являются инфекции (48%) и активность АНЦА-СВ (19%), в дальнейшем основными причинами неблагоприятного исхода наряду с инфекциями (20%) становятся сердечно-сосудистые заболевания (26%) и новообразования (22%) [29]. В исследовании, включившем 255 пациентов с дебютом ГПА, со средней длительностью наблюдения 6,4 года, по сравнению с контрольной популяцией смертность больных ГПА была повышена в 9 раз в течение первого года заболевания (отношение рисков [OP] – 9,0; 95% доверительный интервал [ДИ] – 5,8; 13,9) за счет инфекций, активности ГПА и почечной недостаточности, особенно у пациентов в возрасте >65 лет (ОР – 19,9; 95% ДИ – 8,8; 44,9)]. В последующие 5 лет наблюдения летальность существенно снижалась (ОР – 1,68; 95% ДИ – 1,08; 2,60)] и вновь возрастала (ОР – 4,4; 95% ДИ – 2,0; 9,8)] через 10–15 лет [30].
Высокий риск инфекционных НР является существенной проблемой в лечении АНЦА-СВ. Причины могут быть многообразными и включают тяжелое поражение слизистой оболочки верхних дыхательных путей, естественного защитного барьера; деструктивные изменения в легких с формированием полостей распада, склонных к инфицированию; присутствие патологии нейтрофилов, играющих важную роль в защите организма от острых бактериальных и грибковых инфекций. В этих обстоятельствах необходимость длительного применения ЦФ значительно повышает риск инфекционных НР, в связи с чем, по мнению ведущих экспертов, кумулятивная доза ЦФ не должна превышать 25 г.
Решение проблем стандартного лечения АНЦА-СВ во многом стало возможным после внедрения инновационной анти-В-клеточной терапии РТМ. Начиная с 2011 г. после получения результатов двух РКИ [33, 34] и с учетом данных систематического обзора [35] РТМ был включен в число препаратов первого ряда для индукционной терапии ГПА и МПА наряду с ЦФ [14, 25, 36]. Было доказано, что РТМ (в суммарной дозе 2 г) не уступает ЦФ в качестве средства для индукции ремиссии АНЦА-СВ (уровень доказательности 1В) [33, 34] и даже может превосходить его при рецидивирующем течении заболевания [37]. Постепенно накапливается доказательная база эффективности РТМ при ЭГПА (уровень доказательности 4) [38].
По предварительным данным НРАВ, через год после начала терапии РТМ частота ремиссий составила 92%, а у 8% больных АНЦА-СВ наблюдалось снижение активности заболевания [6], при этом тяжелые инфекции отмечены у 12% пациентов, в то время как в одном из РКИ серьезные инфекции наблюдались чаще – у 18% больных [33].
В дебюте АНЦА-СВ назначение РТМ в качестве терапии первой линии может быть предпочтительным для женщин детородного возраста или пациентов с сопутствующей тяжелой инфекцией, онкологическими проблемами [39]. Отмечено, что РТМ обладает преимуществами по сравнению с ЦФ при назначении пациентам пожилого возраста. Так, среди 31 больного АНЦА-СВ старше 60 лет, получавшего индукционное лечение РТМ, у 97% пациентов была достигнута ремиссия, однолетняя выживаемость составила 100%, отсутствовали инфузионные НР или лейкопения, тяжелые инфекционные НР развились у 16% больных (у 4 – пневмонии, у 1 – Herpes zoster) [40].
По данным РКИ, частота НР на фоне лечения РТМ была меньше, чем в группе ЦФ (р=0,01), серьезные инфекционные НР наблюдали одинаково часто (7%) [34]. Основными факторами, влияющими на развитие инфекционных НР у больных, получающих лечение РТМ, являются сопутствующая терапия ГКС и цитостатиками, коморбидные состояния и органная недостаточность.
Следует подчеркнуть, что основой успешной индукционной терапии является рациональное и персонифицированное поддержание тонкого баланса между применением рекомендованного режима, достаточного для стойкого подавления активности АНЦА-СВ, и одновременного сдерживания риска НР лечения. В результате современной терапии летальность в острой фазе АНЦА-СВ удается снизить до 6–26% [33, 34], однако по-прежнему актуальна проблема частых рецидивов АНЦА-СВ, нередко превосходящих по тяжести дебют заболевания, наблюдаются НР лечения, формируются необратимые повреждения органов и систем [9].
АНЦА-СВ – свойственно рецидивирующее течение, которое отмечается как после стандартной индукционной терапии ЦФ (у 37–41% больных [22, 23]), так и после РТМ. До настоящего времени надежные предикторы рецидива АНЦА-СВ не установлены, риск рецидива выше среди больных ГПА (64%) по сравнению с МПА или ЭГПА (35–34%) [41]. К факторам риска рецидива АНЦА-СВ после индукционной терапии РТМ относят эпитопную специфичность АНЦА к протеиназе-3 (р=0,039), возобновление в циркуляции СД 19+ В клеток в течение 12 месяцев после последней инфузии РТМ (р=0,0038) и возобновление гиперпродукции АНЦА (р=0,0046) [42, 43].
Лечение рецидива требует индукционного протокола. Представлены данные, согласно которым для пациентов с первым рецидивом АНЦА-СВ с высокой активностью после ремиссии, индуцированной ЦФ, более эффективно и экономически целесообразно присоединение РТМ, чем возобновление ЦФ [44].
Рецидив АНЦА-СВ у пациентов с высокой кумулятивной дозой ЦФ рассматривается как показание к назначению РТМ. Возможность применения РТМ при высокой кумулятивной дозе ЦФ или сопутствующей инфекции отражает существующее убеждение, будто РТМ обладает лучшим профилем безопасности, чем ЦФ. Частота НР, включая инфекционные, не увеличивается при повторных курсах РТМ. Представлены данные об эффективном и безопасном использовании РТМ у 8 больных АНЦА-СВ с сопутствующими тяжелыми инфекциями [45]. При назначении РТМ пациентам пожилого возраста наблюдается снижение частоты инфекционных НР по сравнению с ЦФ [34, 40, 46]. При использовании фиксированных повторных курсов РТМ (1 г каждые 6 месяцев) лишь у 9% больных АНЦА-СВ отмечено вторичное иммунодефицитное состояние [42]. Вместе с тем накопленный опыт применения РТМ в онкогематологии свидетельствует, что в долгосрочной перспективе лечение РТМ способно вызывать тяжелые инфекции [47], что свидетельствует о необходимости длительного мониторинга безопасности РТМ.
Риск рецидива АНЦА-СВ сохраняется в долговременной перспективе, поэтому после достижения ремиссии требуется длительный регулярный мониторинг состояния пациентов, согласно рекомендациям Британского общества ревматологии, первоначально через 3 месяца, затем каждые 6 месяцев, а при сохранении долговременной стойкой ремиссии ежегодно (уровень доказательности 2В) [48]. Необходимость длительного поддерживающего лечения при АНЦА-СВ подтверждается фактом существенного снижения частоты рецидивов (до 17%) после трансплантации почки на фоне более активной и длительной, чем обычно, иммунодепрессивной терапии [49].
Для поддерживающего лечения АНЦА-СВ применяют низкие дозы ГКС, как правило, в сочетании с азатиоприном [50]. Важность персонифицированной редукции дозы ГКС подчеркивают данные крупного европейского исследования, продемонстрировавшие, что VDI определяется продолжительностью применения ГКс наряду с возрастом, тяжестью дебюта и частотой рецидивов АНЦА-СВ [51]. На фоне лечения РТМ вероятность отмены ГКС выше.
Для снижения риска рецидива можно рассматривать возможность превентивного назначения повторного курса РТМ. Важно, что после повторных курсов РТМ рецидивы наблюдаются реже, чем после единственного курса [42]. В соответствии с рекомендациями Британского общества ревматологии 2014 г. РТМ может быть использован для поддерживающей терапии АНЦА-СВ по схеме: 1 г каждые 4–6 месяцев в течение 2 лет [48]. По предварительным данным НРАВ [6], эффективность лечения РТМ также возрастала при повторных курсах, которые назначали в связи с наличием клинико-иммунологической активности АНЦА-СВ или возобновлением в циркуляции СД 19+ В клеток. При этом отмечена эффективность повторных редуцированных курсов РТМ (0,5-1 г), что обеспечило существенное снижение затрат на лечение. В одном из исследований при использовании редуцированного курса РТМ (однократно 375 мг/ м2) у 80% пациентов была отмечена полная ремиссия АНЦА-СВ, в 89% случаев – деплеция СД19+ В клеток (<0,005 клеток/мкл) с возобновлением этих клеток в циркуляции в среднем через 9 месяцев [52].
В ретроспективном исследовании, обобщившем 10-летний опыт применения РТМ у больных АНЦА-СВ, сроки повторных превентивных курсов РТМ (в общей сложности 138 курсов) определяли количеством В-клеток в циркуляции и уровнем АНЦА, что обеспечило поддержание ремиссии во всех случаях [43]. В другом исследовании при назначении 69 больным АНЦА-СВ повторных курсов РТМ в фиксированной дозе 1 г каждые 6 месяцев в течение 2 лет во всех случаях поддерживалась ремиссия на фоне низких доз преднизолона (в среднем 2,5 мг/сут). Однако после прекращения лечения в 41% случаев развились рецидивы – в среднем через 34 месяца после последней инфузии РТМ [42].
Не вызывает сомнений связь между активностью АНЦА-СВ и летальностью [29, 30], вместе с тем установлена еще более выраженная ассоциация между смертностью и прогрессированием необратимого повреждения органов и систем, при наличии 5 и более баллов VDI риск летального исхода увеличивается в 6,4 раза [53]. В связи с этим изменение VDI может рассматриваться в качестве суррогатной долгосрочной цели терапии АНЦА-СВ. Другие потенциальные цели лечения могут быть направлены на контроль коморбидной патологии, включая злокачественные новообразования [54, 55], сердечно-сосудистые заболевания [56], НР лечения [57, 58].
Хорошо известно повреждающее действие ЦФ на слизистую оболочку мочевого пузыря с развитием геморрагического цистита и рака мочевого пузыря, установлена его зависимость от кумулятивной дозы ЦФ [59, 60]. Риск рака мочевого пузыря возрастает при суммарной дозе ЦФ более 30 г, и опухоль может развиться через продолжительное время после окончания лечения ЦФ [61]. В связи с этим требуется не только тщательное обследование больных с персистирующей гематурией, но и регулярный, неопределенно долгий мониторинг всех больных, ранее получавших лечение ЦФ [48].
Очевидно, что достижения в лечении АНЦА-СВ со значительным повышением выживаемости пациентов будут со временем трансформироваться в новые проблемы, связанные с длительным бременем хронического заболевания с риском рецидива, к чему должны быть готовы специалисты, наблюдающие больных АНЦА-СВ. На этом пути кардинальное улучшение прогноза АНЦА-СВ во многом будет зависеть не только от совершенствования стратегии лечения, включая внедрение инновационных генно-инженерных биологических препаратов, но и от качества терапевтического сотрудничества врача и пациента. Недостатки последнего относят к причинам несоответствия эффективности лекарственных средств по данным РКИ и результатам лечения в условиях реальной клинической практики.
Интерес к проблеме комплаенса (и близким ему понятиям «приверженность лечению», «терапевтическое сотрудничество») существенно возрос в последние десятилетия в связи с общественно-правовыми изменениями в российской медицине и процессом интеграции с достижениями зарубежной науки [62]. По оценке ВОЗ, примерно половина всех больных не соблюдают рекомендаций врача, при лечении хронических патологических процессов качество терапевтического сотрудничества ниже, чем при острых заболеваниях.
В международных рекомендациях последних лет обращено внимание на важность образовательных программ для больных АНЦА-СВ в целях повышения комплаенса и улучшения долгосрочных результатов лечения [3, 48]. Известно, что поддержка врачей улучшает приверженность больных СВ лечению [63, 64]. Участие пациентов в НРАВ с длительным динамическим мониторингом несомненно несет образовательные функции и способствует укреплению терапевтического сотрудничества.
В целом пациенты с СВ характеризуются высоким уровнем комплаенса [65]. С меньшей приверженностью лечению ассоциируется молодой возраст больных СВ (р<0,03) [65, 66], как и у молодых больных ревматоидным артритом, что объясняют их высокой социальной активностью [67]. В исследовании, включившем 228 больных АНЦА-СВ, недостаточный комплаенс ассоциировался помимо молодого возраста (р<0,001) с женским полом (р<0,05), перенесенными НР лечения (р<0,05) и депрессивным синдромом (р<0,001), при этом клинические особенности и стадия АНЦА-СВ не оказывали влияния [65].
НР лечения ассоциируются с нарушением приверженности терапии [66]. По предварительным данным НРАВ, среди пациентов с серьезными НР часто отмечался недостаточный комплаенс (75%), что имело место в 100% случаев с летальным исходом. При высокой приверженности лечению частота серьезных НР снижалась до 6,7% [6].
Для достижения устойчивого качественного терапевтического сотрудничества следует учитывать комплекс факторов. Комплаенс взаимосвязан не только с клиническими, психологическими, демографическими, социальными факторами, но и с особенностями организации медицинской помощи, стоимостью лечения. В условиях современной тенденции к сокращению сроков стационарного лечения и длительному амбулаторному лечению может значительно снижаться качество терапевтического сотрудничества, в формировании которого важную роль игра.т уровень организации медицинской помощи, частота медицинских осмотров [68]. Возможность регулярного диспансерного наблюдения в свою очередь зависит от доступности медицинского обслуживания.
Предложенный в НРАВ научно-обоснованный протокол мониторинга клинико-иммунологической активности АНЦА-СВ, НР и коморбитной патологии у каждого конкретного пациента позволяет осуществлять персонифицированное лечение, оптимальным путем достигать ремиссии, снижать риск НР, предотвращать или смягчять возможные рецидивы, организовывать преемственность на разных этапах лечения, обеспечивать существенные фармако-экономические преимущества и может стать отправной точкой для последующих исследований.
Дальнейший прогресс лечения, направленного на «достижение цели», в первую очередь будет основываться на уточнении патогенетических механизмов отдельных нозологических форм АНЦА-СВ, что позволит модифицировать лечение, сделав его более целенаправленным и персонифицированным, и предложить новые потенциальные терапевтические цели. Так, получены данные, что гены рецепторного пути интерлейкина-7, Т-клеточного рецептора и Т-клеток памяти могут иметь предиктивную ценность в отношении рецидива АНЦА-СВ [69]. Для продвижения в этом направлении уникальная информация может быть предоставлена НРАВ, включая данные банка компонентов крови пациентов с различными клинико-иммунологическими формами АНЦА-СВ, на разных стадиях заболевания.
ОСНОВНЫЕ ЗАДАЧИ, РЕШЕНИЕ КОТОРЫХ ОСУЩЕСТВИМО ПРИ ПОМОЩИ НАЦИОНАЛЬНОГО РЕГИСТРА БОЛЬНЫХ АНЦА-СВ
- Оптимизация протоколов индукционного лечения АНЦА-СВ, стандартного с использованием ЦФ или инновационной анти-В клеточной терапии РТМ.
- Реализация персонифицированной поддерживающей терапии ГКС, цитостатиками или РТМ.
- Стабильное воспроизведение целей терапии АНЦА-СВ, включая поддержание устойчивой ремиссии, снижение НР лечения, контроль коморбидной патологии, достижение высокого качества жизни. Улучшение долгосрочных результатов лечения.
- Обеспечение преемственности лечения на разных этапах ведения больных АНЦА-СВ – стационарном и амбулаторном.
- Совершенствование качества терапевтического сотрудничества врача и пациента.
- Развитие информационных и телекоммуникационных медицинских технологий. Обеспечение в кратчайшие сроки возможности консультативной и лечебной помощи пациентам с вероятным или уточненным АНЦА-СВ в экспертных центрах.
- Создание банка компонентов крови пациентов с различными клинико-иммунологическими формами АНЦА-СВ, на разных стадиях заболевания. Последующее уточнение патогенетических механизмов АНЦА-СВ, способных модифицировать целеполагающее лечение.
- Изучение различных клинических аспектов АНЦА-СВ, включая разработку научно-обоснованных стандартов терапии, оптимизацию и планирование фармако-экономических затрат.
- Реализация организационно-методической и образовательной роли экспертных центров, в т.ч. создание врачебного сообщества при участии ревматологов, нефрологов, кардиологов и врачей первичного звена здравоохранения для внедрения единой стратегии диагностики и лечения АНЦА-СВ.
Прозрачность исследования
Исследование не имело спонсорской поддержки. Автор несет полную ответственность за предоставление окончательной версии рукописи в печать.
Декларация о финансовых и других взаимоотношениях
Автор принимал участие в разработке концепции статьи и в написании рукописи, он одобрил окончательную версию. Автор не получал гонорар за статью.


