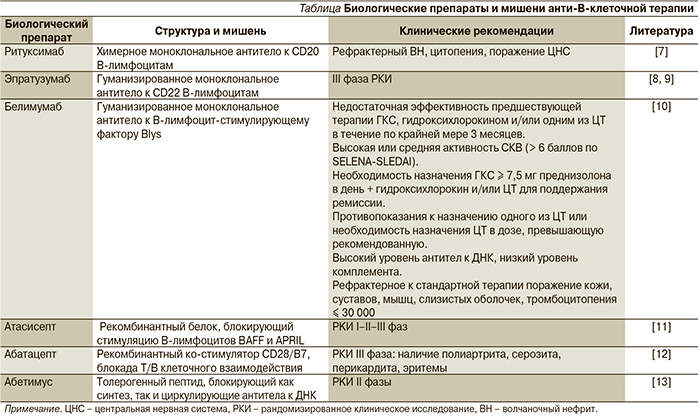
Системная красная волчанка (СКВ) является прототипом хронического аутоиммунного заболевания, при котором наблюдаются гиперпродукция аутоантител, образование иммунных комплексов, фиксирующихся на клеточных мембранах различных тканей в присутствии комплемента, развитие воспалительных реакций и тканевого повреждения [1]. Этиология СКВ неизвестна, определенную роль в развитии заболевания играют экологические триггеры: вирус Эпштейна–Барр, воздействие ультрафиолетового света, эстрогенсодержащие препараты, кварцевая пыль и курение [2, 3]. СКВ остается заболеванием, потенциально угрожающим жизни пациента даже при использовании высоких доз глюкокортикостероидных гормонов (ГКС) и цитостатиков (ЦТ), характеризуется высоким уровнем заболеваемости, смертности, значительными повреждениями органов и низким качеством жизни [4]. Распространенность составляет от 20 до 70 случаев на 100 тыс. женщин и варьируется в зависимости от расовой и этнической принадлежности [5, 6]. На рубеже ХХ–XXI столетий с появлением генно-инженерных биологических препаратов (ГИБП) сформировались новые стратегические подходы к терапии СКВ. Хорошо известно, что при СКВ отличительной чертой патогенеза является гиперпродукция аутоантител, в связи с чем неудивительно, что наибольший интерес представляют ГИБП, способные блокировать функцию В-лимфоцитов. Характеристика наиболее известных анти-В-клеточных препаратов представлена в таблице.
Ритуксимаб (анти-CD20-моноклональное антитело)
Ритуксимаб (РТМ) является химерным (человек/мышь) антителом, представляющим собой моноклон иммуноглобулина G1 (IgG1) каппа, направленный против антигена CD20, который находится на поверхности В-лимфоцитов и отсутствует на стволовых, про-В-лимфоцитах и плазматических клетках. Механизм действия РТМ до конца не изучен, деплеция (исчезновение из циркуляции) В-лимфоцитов может быть реализована антител-зависимой цитотоксичностью, комплемент-зависимой цитотоксичностью и прямым апоптозом [14]. РТМ с 1997 г. включен в стандарт лечения неходжскинских лимфом.
В связи с тем что в патогенезе СКВ ключевую роль играют активированные В-лимфоциты, гиперфункция которых приводит к продукции аутоантител, применение РТМ при этом заболевании представляется перспективным.
Эффективность РТМ при внепочечных проявлениях СКВ
В 2002 г. появилась первая публикация об успешном применении РТМ в группе больных СКВ с умеренно тяжелым и рефрактерным к стандартной терапии течением болезни [15]. Несмотря на отсутствие официально зарегистрированных показаний за последующее десятилетие, в многочисленных неконтролируемых проспективных исследованиях была продемонстрирована высокая эффективность РТМ (80–90 %) у больных СКВ с поражением кожи, суставов, серозных оболочек, а также в случаях критической тромбоцитопении, гемолитической анемии и тяжелым поражением центральной нервной системы – ЦНС [16–21]. Высокая эффективность РТМ при гематологических проявлениях СКВ может быть связана с подавлением антиэритроцитарных и антитромбоцитарных аутоантител. В то же время эффективность РТМ при других внепочечных проявлениях СКВ, появление которых не связано с синтезом специфических аутоантител, очень высока и колеблется в пределах 89–100 % [22].
Эффективность РТМ при волчаночном нефрите
Наибольший практический интерес представляет эффективность РТМ в отношении пациентов с наиболее тяжелым и прогностически неблагоприятным клиническим проявлением СКВ – волчаночным нефритом (ВН). После первых обнадеживающих результатов, подтвердивших благоприятное влияние анти-В-клеточной терапии на течение активного ВН, было опубликовано немало статей, посвященных этому вопросу [22–24]. В последнем исследовании I. Gunnarsson и T. Jonsdottir [24] анализируются данные публикаций, в которых представлены результаты лечения как минимум 5 взрослых пациентов. Диагноз ВН был подтвержден биопсией почки, длительность наблюдения была не менее 6 месяцев, и сформулированы критерии ответа на терапию. Авторы проанализировали 12 публикаций, содержащих сведения о применении РТМ 161 пациентом с ВН. Оказалось, что достижение частичной или полной ремиссии наблюдалось среди 70–77 % больных и зависело от выраженности морфологического повреждения и функционального состояния почек, предикторами неэффективности были наличие нефросклероза и почечной недостаточности. В группе «ответчиков» факторами, влияющими на развитие ремиссии ВН после применения РТМ, были сохранная фильтрационная функция почек, более высокий уровень альбумина, менее выраженная протеинурия, меньшая частота развития нефротического синдрома. Весьма интересным кажется тот факт, что достижение ремиссии чаще наблюдалось при развитии стойкой и длительной деплеции В-лимфоцитов и, напротив, короткий период деплеции или ее позднее развитие чаще ассоциировались с персистирующей активностью ВН [26]. Для максимальной объективизации эффекта РТМ при ВН важную роль играет анализ повторных биопсий почек. В подавляющем большинстве исследований выявлено снижение морфологической активности, коррелировавшей с клиническим улучшением [26–29]. В четко проведенном исследовании I. Gunnarsson и соавт. [28] повторные биопсии проводились через 6–7 месяцев невзирая на клинический результат. Было показано, что достижение клинического ответа соответствовало снижению индекса морфологической активности без возрастания индекса хронизации. Хорошо известно, что достижение клинико-лабораторной ремиссии у больных мембранозной формой ВН (V класс по классификации Всемирной организации здравоохранения) наблюдается редко – даже при использовании высоких доз ГКС и ЦТ. Немногочисленные публикации, посвященные результатам применения РТМ при резистентных формах мембранозного ВН, свидетельствуют об определенных перспективах анти-В-клеточной терапии. Так, при анализе данных 164 пациентов Европейской когорты достижение частичной ремиссии выявлено у 73 %, а полной – у 65 % больных ВН V класса [29].
Несмотря на эффективность терапии РТМ, продемонстрированной в открытых испытаниях, два проведенных рандомизированных клинических исследования (РКИ) не подтвердили его эффективности по сравнению с плацебо у больных ВН (LUNAR) [30] и при СКВ без поражения почек (EXPLORER) [31]. В то же время при более детальном анализе данных установлено, что по сравнению с группой плацебо RTX оказывал значительно больший эффект на пациентов с достигнутой деплецией, высоким уровнем а-ДНК и низким комплементом [22, 25]. К возможным объяснениям неудач РКИ можно отнести слишком короткий срок наблюдения, высокие дозы ГКС и применение мофетила микофенолата (ММФ) в группе плацебо.
Негативные результаты недостаточно корректно проведенных РКИ по сравнению с высокой эффективностью применения РТМ сотнями больных СКВ в неконтролируемых исследованиях позволяют с оптимизмом надеяться, что ритуксимаб «скорее жив, чем мертв…» и занимает достойное место в лечении рефрактерной СКВ [22, 32, 33]. Подтверждением оптимистического взгляда на перспективы применения РТМ при СКВ являются феноменальные результаты применения комбинации РТМ и ММФ без системной терапии ГКС-гормонами больных ВН [34]. В исследование были включены 50 больных ВН IV–V классов по классификации ISN/RPS (International Society of Nephrology/Renal Pathology Society), только 16 из них недолго получали незначительные дозы ГКС. Согласно протоколу, всем пациентам назначали 2 инфузии РТМ по 1 г в комбинации с метилпреднизолоном по 0, 5 г с интервалом в 2 недели, ММФ назначали в дозах от 0,5 до 1,5 г в сутки. Длительность наблюдения составила в среднем 37 недель, частичная или полная ремиссия была выявлена у 45 (90 %) из 50 больных. Безусловно, результаты этого исследования хотя и требуют подтверждения, но в то же время вселяют надежду на изменение основополагающего принципа терапии СКВ – длительной терапии ГКС.
Таким образом, РТМ:
- приводит к деплеции В-лимфоцитов, снижению анти-ДНК, повышению С3-, С4-комплемента;
- применение оправданно при рефрактерном ВН с сохранной функцией почек, тромбоцитопении, анемии, поражении ЦНС.
Эпратузумаб (анти-CD22-моноклональное антитело)
Среди нескольких ГИБП, имеющих своей мишенью В-лимфоциты, особо следует отметить эпратузумаб (ЭПМ), в первую очередь потому, что он, как и РТМ, представляет собой моноклональные антитела к рецепторам В-лимфоцита (анти-CD22). CD22 является трансмембранным лектиноподобным рецептором, который присутствует на поверхности зрелых, наивных и переходных клеток, но отсутствует на клетках памяти и плазматических клетках, играет важную роль в регуляции функции В-клеток [35]. ЭПМ скорее модулирует функцию В-лимфоцитов, вызывая их умеренное истощение, в отличие от РТМ не вызывает апоптоза и не приводит к полной деплеции В-лимфоцитов. Его основной мишенью являются наивные, зрелые и переходные В-лимфоциты, содержание которых сокращается на 40 % после применения ЭПМ [36].
В настоящее время проводится РКИ по изучению эффективности ЭПМ у больных СКВ со средней и тяжелой степенями активности. Получены промежуточные результаты 12-недельного многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования IIb фазы EMBLEM, имеющего целью оценить эффективность и безопасность ЭПМ, определение дозы препарата для 227 пациентов с умеренной и тяжелой СКВ. Было показано, что ЭПМ в кумулятивной дозе 2400 мг продемонстрировал выраженную клиническую эффективность, которая заключалась в снижении активности заболевания, измерявшуюся с помощью специального композитного индекса BICLA. Применение ЭПМ в дозе 600 мг в неделю было связано с наибольшим улучшением по оценке BILAG-2004 (от A/B до C/D) по сравнению с плацебо во всех доменах органов; отмечена также хорошая переносимость препарата и отсутствие тяжелых осложнений [35]. В настоящее время заканчиваются еще два РКИ III фазы, состоящие из 12-недельных циклов, пациентов с умеренной и тяжелой СКВ (EMBODY™1 и EMBODY™2). Еще одно открытое клиническое исследование по оценке эффективности и безопасности ЭПМ с включением 1400 пациентов с умеренной и тяжелой СКВ планируется завершить в 2016 г. (NCT01408576, www.clinicaltrials.gov). Предварительный анализ данных 90 пациентов, включенных в два контролируемых исследования (ALLEVIATE-1 и -2) и в открытое исследование (SL0006), выявил более высокую эффективность ЭПМ в дозе 360 мг/м² по сравнению с плацебо на 12-й и 48-й неделях от начала терапии и уменьшение общего счета индекса BILAG в открытом исследовании к 100-й неделе [37]. Результаты единственного завершенного открытого исследования, посвященного изучению эффективности ЭПМ для больных СКВ со средней степенью активности, свидетельствуют о достаточно высокой эффективности инфузий ЭПМ (360 мг/м² каждые 2 недели, 4 дозы на курс).
Было показано, что уже к 6-й неделе исследования общий счет BILAG уменьшился у 77 % больных на 50 %. Отмечено снижение циркулирующих В-лимфоцитов на 35 % к 18-й неделе, их уровень оставался сниженным и на 6-м месяце от начала терапии. В то же время отмечен непродолжительный эффект терапии ЭПМ, уже к 32-й неделе число пациентов с более чем 50 %-ным улучшением составляло всего 15 % [38]. До настоящего времени остаются неизученными возможность и целесообразность комбинации различных генно-инженерных препаратов, в т.ч. и анти-В-клеточных при СКВ. В связи с этим большой интерес представляет исследование J. Carnahan и соавт. (2007) [39]. Было показано, что in vivo комбинация РТМ и ЭПМ оказывает более значимое воздействие на пролиферацию и апоптоз В-лимфоцитов, что может увеличивать клиническую эффективность терапии. По всей вероятности, основным показанием к назначению ЭПМ будут среднетяжелое течение СКВ, необходимость снижения дозы ГКС, предотвращение обострений и достижение стойкой ремиссии.
Анти–BlyS-терапия. Белимумаб
В отсутствие прямых показаний к применению РТМ при СКВ и незавершенных к настоящему времени исследований по эффективности применения ЭПМ настоящей сенсацией стало сообщение о регистрации Food and Drug Administration нового биологического препарата для лечения СКВ – белимумаба [40]. Белимумаб – первый ГИБП, специально созданный для лечения СКВ, что по праву рассматривается как одно из наиболее крупных достижений ревматологии за последние 50 лет. Открытие ключевого значения В-клеток в иммунопатогенезе СКВ привлекло внимание к изучению не только самих В-клеток, но и В-клеточных цитокиновых лигандов в качестве возможных «мишеней» терапевтических воздействий. Особый интерес привлек В-лимфоцитарный стимулятор (В lymphocyte stimulator – BLyS), также известный как В-клеточный активирующий фактор (B cell-activating factor – BAFF) и лиганд суперсемейства фактора некроза опухоли 13b, который является важнейшим компонентом цитокиновой регуляции функции, пролиферации и дифференцировки В-клеток [41].
В клинических исследованиях было показано, что у пациентов с СКВ наблюдается увеличение концентрации BLyS в сыворотке, коррелирующее с концентрацией антител к двуспиральной (дс) ДНК (анти-дсДНК) и динамикой активности заболевания [42]. Эти и многие другие данные [43] послужили теоретическим обоснованием разработки анти-BLyS-препаратов, в первую очередь белимумаба, для лечения СКВ. Белимумаб – полностью человеческие рекомбинантные моноклональные антитела (IgG1λ), предотвращают взаимодействие рBlyS с клеточными рецепторами аутореактивных «переходных» (transitional) и наивных В-клеток, что в свою очередь приводит к подавлению характерной для СКВ В-клеточной гиперреактивности, в частности синтеза аутоантител [44]. Программа клинических исследований белимумаба при СКВ продолжается более 10 лет и включает 4 РКИ.
В основные РКИ (BLISS-52 и BLISS-76) вошли 1693 пациента из 31 страны (223 клинических центра), открытая фаза этих исследований продолжается (более 6 лет). В настоящее время завершено два РКИ фазы III, BLISS-52 и BLISS-76 [45, 46], результаты которых послужили основанием регистрации препарата. Создание белимумаба ознаменовало новую эру в лечении СКВ, связанную с началом широкого применением ГИБП и созданием нового класса лекарственных препаратов – ингибиторов BLyS, которые могут иметь важный терапевтический потенциал не только при СКВ, но и при широком круге аутоиммунных заболеваний человека.
Показания к назначению белимумаба при СКВ (адаптировано из (RamosCasals M. и соавт.) [47]:
- Недостаточная эффективность предшествующей терапии ГКС, гидроксихлорокином и/или одним из ЦТ в течение по крайней мере 3 месяцев.
- Высокая или средняя активность СКВ (> 6 баллов по SELENA-SLEDAI).
- Необходимость назначения ГКС ≥ 7,5 мг преднизолона в сутки + гидроксихлорокин и/или ЦТ для поддержания ремиссии.
- Противопоказания к назначению одного из ЦТ или необходимость назначения ЦТ в дозе, превышающей рекомендованную.
- Высокий уровень антител к ДНК, низкий уровень комплемента.
- Рефрактерное к стандартной терапии поражение кожи, суставов, мышц, слизистых оболочек, тромбоцитопения ≤ 30 тыс.
- Полиорганная рефрактерность к стандартной терапии.
Противопоказаниями к назначению белимумаба служат критическое течение СКВ, активный ВН, поражение ЦНС.
В заключение необходимо подчеркнуть, что теперь в арсенале ревматолога имеются «таргетные» ГИБП, непосредственно влияющие на В-лимфоциты, основное звено патогенеза СКВ (ритуксимаб, белимумаб), которым не свойственны значительные повреждающие эффекты (бесплодие, развитие атеросклероза, диабет, катаракта, остеопороз, тяжелые инфекции, поражение ЖКТ и др.). Внедрение ГИБП в комплексную терапию СКВ, вероятно, позволит не только увеличить продолжительность жизни, но и сделать ее более полноценной и комфортной.
Авторы выражают благодарность профессору С.К. Соловьеву за помощь в подготовке данной статьи.



