Наследственные ферментопатии, обусловленные недостаточностью активности ферментов или их отсутствием, способствуют формированию патологического процесса, изменению микрофлоры. Среди них наиболее изученной формой является целиакия. Заболевание обусловлено нарушением расщепления продуктов белков растительного происхождения в результате отсутствия специфического фермента трансглутаминазы, расщепляющего клейковину злаковых культур [1]. Несостоятельность кишечных пептидаз обусловливает устойчивость пептидов растительного белка к кишечному протеолизу и нарушение мембранного гидролиза, способствует дисбиотическим расстройствам. Невсасываемые нутриенты приводят к росту биомассы соответствующих бактерий, вызывая изменение осмолярности и повышенное высвобождение водорода и углекислого газа при бактериальной ферментации нутриентов.
На протяжении многих лет микрофлора кишечника является предметом многостороннего изучения. Это вызвано исключительно важной ролью, которую играют микроорганизмы в пищеварении человека. В толстой кишке происходит симбионтное пищеварение, осуществляемое ферментами, которые синтезированы микрофлорой и выделены в полость толстой кишки. Под действием этих ферментов происходит переваривание веществ, не расщепленных в тонкой кишке, и компонентов пищеварительных секретов. Кишечная микрофлора является важным органом вторичного переваривания пищи и формирования каловых масс, в соответствии с теорией адекватного питания обеспечивает возможность широкого варьирования рациона питания и устойчивость к новым видам пищи. Благодаря бактериальной флоре происходит разрушение остатков непереваренной пищи и компонентов пищеварительных секретов с образованием органических кислот, газов – углекислого, метана, сероводорода, и токсичных для организма веществ – фенола, скатола, индола, крезола. Продукты метаболизма бактерий, в частности заселяющих кишечник, являются источником питания для слизистой оболочки кишечника, а некоторые обладают бактерицидными свойствами и подавляют рост вредных бактерий.
В основе расстройств микробиоценоза кишечника с изменением видового, численного составов и инфраструктуры микробиоценоза в толстой кишке лежат нарушения сложных механизмов мембранного переваривания в тонкой кишке. Чрезмерное поступление нерасщепленных субстратов в толстую кишку в процессе микробного метаболизма в толстой кишке обусловливает образование метана, водорода, углекислого газа и короткоцепочечных жирных кислот (КЦЖК), которые утилизируются колоноцитами, что приводит к развитию моторно-эвакуаторной дисфункции кишечника. Моторика кишечника характеризуется дискоординированными сокращениями, приводящими к задержке продвижения содержимого пищеварительного тракта, накоплению токсинов и газов. Говоря о КЦЖК, синтезированных в результате микробного метаболизма, следует отметить, что их синтез является важным фактором колонизационной резистентности, обеспечивающим стабильность состава кишечной микрофлоры, одним из механизмов обеспечения поддержания оптимальных значений рН в просвете толстой кишки. Повышение концентрации КЦЖК сочетается со снижением осмотического давления в толстой кишке в связи с расщеплением полисахаридов [4, 5]. Несмотря на регуляцию моторики желудочно-кишечного тракта (ЖКТ), включающую нервную и гуморальную регуляцию, а также местную регуляцию благодаря наличию водителей ритма в гладкой мускулатуре, значительная роль принадлежит микроорганизмам. Микроорганизмы помимо газообразования и снижения порога чувствительности миоцитов вырабатывают огромное количество различных веществ, воздействующих на моторику, в т.ч. бактериальных метаболитов желчных кислот и КЦЖК, которые являются одним из важнейших метаболитов кишечной микрофлоры, оказывающих как местное, так и системное влияние. Регуляция кишечного транзита органическими кислотами связана не только с изменением осмотического давления в результате их синтеза. В проксимальных отделах толстой кишки КЦЖК стимулируют рецепторы L-клеток, которые вырабатывают регуляторный пептид PYY, замедляющий моторику кишечника. Нарушение состава кишечной микрофлоры приводит к изменению спектра продуцируемых ею метаболитов, в т.ч. и КЦЖК, что оказывает негативное влияние на моторику кишечника. Однако существует и обратная связь: нарушения моторики ЖКТ приводят к изменению внутренней среды кишки, нарушению переваривания и всасывания, что отрицательно сказывается на состоянии микрофлоры.
Новым подходом к лечению дисбиотических нарушений является использование готовых активных метаболитов представителей естественной микрофлоры, т.н. метабиотических препаратов. Метабиотики, являясь продуктом метаболизма микроорганизмов, не разрушаются под воздействием желудочного сока и пищеварительных ферментов при попадании в кишечник. В результате длительной разработки в НИИ особо чистых биопрепаратов (Санкт-Петербург) был создан новый препарат, названный Актофлор-С, не имеющий прямых аналогов [6, 7].
Метабиотик последнего поколения Актофлор-С применим для восстановления микрофлоры кишечника и нормализации ее метаболической активности, а также в качестве дополнительного источника аминокислот, в т.ч. незаменимых и органических кислот, обладающих доказанным регуляторным действием. Компоненты метабиотика представлены в оригинальной композиции бактериальных метаболитов, которые обладают выраженным синергическим действием в отношении нормальной микрофлоры и оказывают положительное влияние на пролиферативную активность клеток иммунной ткани, стимулируя иммунитет человека. В состав препарата Актофлор-С входят следующие биологически активные вещества (мг/мл): янтарная кислота – не менее 14,0, аспарагиновая кислота – 0,91, глутаминовая кислота – 6,71, аланин – 2,03, глицин – 1,2, валин – 6,68, лейцин – 1,5, лизин – 6,67, метионин – 3,4, муравьиная кислота – 10,49, уксусная кислота в пересчете на ацетат натрия– 116, молочная кислота – 24,7.
Целью настоящего исследования стало изучение клинической эффективности препарата Актофлор-С при коррекции симптомов нарушения стула и кишечной диспепсии у больных целиакией в составе комплексной терапии.
Материал и методы
В исследование были включены пациенты с верифицированным диагнозом «целиакия», ассоциируемая с синдромом констипации (частота стула от 1 до 2 раз в неделю), подтвердившие информированное согласие на проведение исследования. В исследование были включены 15 больных целиакией с преобладанием констипации и признаками кишечной диспепсии. Возраст пациентов составил 31,8±9,5 лет. Все больные получали Актофлор-С по 1 тюбик-капельнице внутрь 2 раза сутки во время еды в стакане воды (250 мл) в течение месяца. Все пациенты благополучно завершили участие в исследовании. Исключений пациентов в процессе проведения исследования не было.
Исследование моторно-эвакуаторной функции ЖКТ проведено методом электрогастроэнтерографии (ЭГЭГ) с помощью прибора «Гастроэнтеромонитор ГЭМ-01» («Гастроскан-ГЭМ») до и после курса терапии с оценкой динамики показателей электрической активности ЖКТ.
Оценка качественного и количественного составов микрофлоры кишечника проведена методом хроматографии-масспектрометрии с применением хроматографа-масспектрометра ГХ/МС Agilent. Всего оценивали 57 показателей (Приложение).
Статистическая обработка проведена с использованием параметрических и непараметрических методов (тест Колмогорова–Смирнова), признаки с интервальной шкалой измерения представлены средним арифметическим значением (M) и средним квадратическим отклонением (σ) в виде M±σ при близости их распределений к нормальному закону: медианой (Ме), нижним (Q1) и верхним (Q3) квартилями в виде Me [Q1; Q3] – в противном случае. Анализ качественных признаков (номинальных, порядковых, дихотомических) строили в таблицах сопряженности, представленных распределением частот [8]. При сравнительном анализе показателей в зависимости от вида их распределения применяли критерий Стьюдента или Манна–Уитни, при сравнении частотных величин – χ2-критерий Пирсона и точный критерий Фишеpа. Для оценки динамики исследуемых количественных показателей (периферической ЭГЭГ натощак и при пищевой стимуляции до и после лекарственной терапии) применены парные тесты (одновыборочный t-критерий Стьюдента или критерий Вилкоксона); различия частотных величин оценены при анализе доверительного интервала для разности относительных частот в связанных выборках [9]. Статистическая обработка данных выполнена с использованием программы Statistica 10.0 (StatSoft, США) и встроенных функций пакета EXCEL (Microsoft, США).
Результаты исследования
У включенных в исследование пациентов с целиакией наиболее распространенными жалобами были запоры, которые на момент начала лечения беспокоили 100% пациентов. Частота встречаемости клинических проявлений целиакии до и после курса приема функционального питания представлена в табл. 1.
До и после терапии проведен анализ жалоб и данных периферической ЭГЭГ. Эффективность использования препарата Актофлор-С оценена по динамике клинической симптоматики и результатам периферической ЭГЭГ.
Согласно полученным данным, у пациентов клиническая картина характеризовалась частотой стула от 1 до 2 раз в неделю, что соответствовало нарушению стула по типу констипации. Частота стула в сутки и число дефекаций в неделю оценены согласно Бристольской шкале. После проведенной терапии отмечена положительная динамика: у 13 (86,7%) пациентов нормализация частоты стула и у 2 (13,3%) частота стула составляли 2–3 раза в неделю, однако по консистенции стул был оформленным и мягким. У 20% пациентов стул относился к 3-му типу, у 80% – к 4-му. Таким образом, была отмечена положительная динамика типов стула в соответствии с Бристольской шкалой на фоне применения метабиотика Актофлор-С.
Оценив качественный состав микрофлоры после лечения, оказалось, что у пациентов общее содержание нормальной флоры увеличилось с 10,0 до 15,0%, а содержание условно-патогенной флоры, грибов и вирусов в целом снизилось в 1,5 раза (табл. 2).
Количественные значения основных представителей микрофлоры толстого кишечника пациентов были получены с помощью метода газовой хроматографии-масспектрометрии.
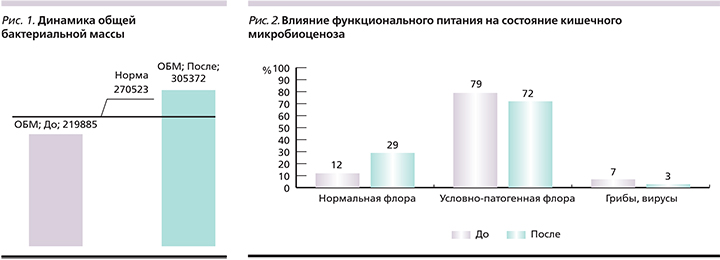
На рис. 1 представлено исходно количественное содержание общей бактериальной массы представителей толстой кишки.
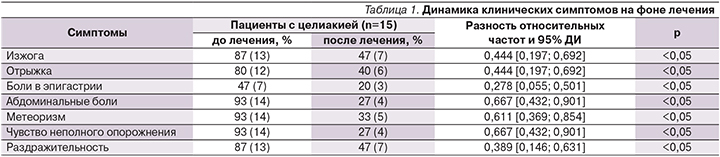
После проведенного лечения препаратом Актофлор-С у пациентов отмечено достоверное увеличение общей бактериальной массы за счет нормальной микрофлоры (p<0,05). Как видно из рис. 2, отмечено увеличение общего количества семейства лакто- и бифидобактерий. Исходно у 12% больных наблюдалось снижение представителей нормальной микрофлоры; у 79% пациентов – повышение количества условно-патогенной флоры, грибов; у 7% пациентов – повышение количества вирусов и их метаболитов.
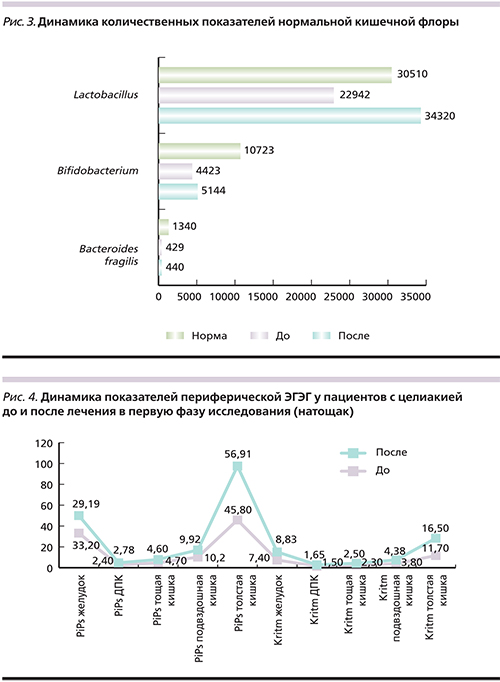
Как представлено на рис. 3, количественное содержание Lactobacillus составило 22 942 кл/г×105 [6567,8×105; 22378,8×105], Bifidobacterium – 4423 кл/г×105 [2311,0×105; 6321,2×105] и Bacteroides fragilis – 429 кл/г×105 [93,0×105; 430,5×105], после приема Актофлора-С у пациентов достоверно увеличилось.
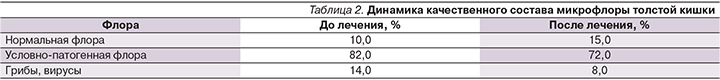
При оценке двигательной активности ЖКТ у пациентов исходно выявлены изменения тонической и пропульсивной активности пищеварительного тракта. В первую фазу показатели PiPs и Kritm были повышенными на частоте желудка и двенадцатиперстной кишки (ДПК), что расценивалось как признаки гипертонической и гиперкинетической активности (рис. 4). Показатели двигательной активности тощей и подвздошной кишки расценивались как спастические нарушения моторики по гипертоническому типу. Показатели толстой кишки были ниже референсных значений, что указывало на снижение моторно-эвакуаторной функции по гипотоническому и гипокинетическому типам. После проведенного лечения препаратом Актофлор-С у пациентов отмечена положительная динамика показателей электрической активности (PiPs, Kritm) на частотах желудка и толстой кишки.
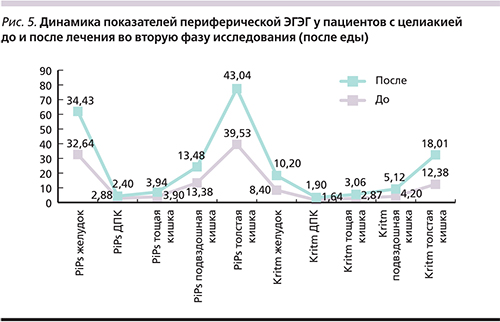
Как показано на рис. 5, во вторую фазу исследования до лечения у пациентов были выявлены признаки недостаточного ответа желудка и ДПК по мощности и ритмичности и снижение показателей PiPs и Kritm на частоте толстой кишки на стандартную пищевую стимуляцию. После проведенного курса терапии Актофлором-С в постпрандиальную фазу наблюдалась положительная динамика в виде нормализации ответа желудка по мощности и ритмичности, а также повышения показателей PiPs и Kritm на частотах желудка и толстой кишки.
Таким образом, применение метабиотика больными целиакией способствовало улучшению нормализации тонической и сократительной активности пищеварительного тракта путем количественного восстановления микрофлоры кишечника и ее метаболической активности, что оказало регуляторное действие.
За весь период наблюдения исследуемого продукта БАД Актофлор-С все пациенты завершили полный курс лечения. Таким образом, высокую приверженность лечению продемонстрировали 100% пациентов, принимавших исследуемый комплекс.
Заключение
Проведенное исследование клинической эффективности применения нового метабиотика, Актофлора-С, в отношении больных целиакией, ассоциированной с констипацией, показало, что в комплексной терапии эффективно применение оригинальной композиции бактериальных метаболитов для купирования симптомов диспепсии и нормализации стула по частоте и консистенции, что подтверждено статистически значимым снижением частоты субъективных расстройств после курса лечения (p<0,05). После приема Актофлора-С наблюдалась положительная динамика типов стула: у большей части больных (80%) стул соответствовал 4–5-му типам по Бристольской шкале. Пробиотический эффект исследуемого продукта подтверждается повышением общей бактериальной массы за счет представителей облигатной флоры (лакто- и бифидобактерий). Факт количественного восстановления микрофлоры кишечника и функциональной активности, а также нормализации тонической и сократительной активности пищеварительного тракта свидетельствует о положительном воздействии препарата Актофлор-С на течение целиакии.



