Общеизвестно, что антибактериальные препараты высокоэффективны и широко используются в фармакотерапии различных заболеваний, а сравнимой по силе действия альтернативы им пока не существует. Тем не менее при назначении антибиотиков следует помнить о риске возникновения целого ряда осложнений и неблагоприятных последствий, таких как:
- антибиотикассоциированная диарея (ААД), развивающаяся у 3–29% пациентов, принимающих антибиотики;
- нарушения микрофлоры (дисбиоз) кишечника, выявляющиеся у 80–90% больных на фоне приема антибиотиков;
- возможное развитие заболеваний, вызванных оппортунистическими микроорганизмами;
- формирование резистентности микроорганизмов к антибиотикам и др. [1–3]
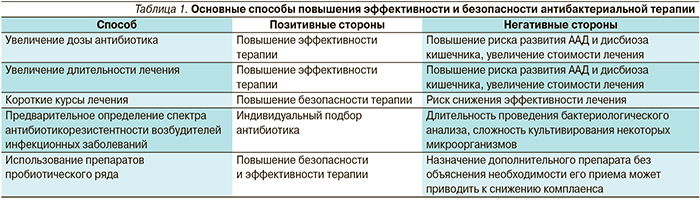
Для повышения эффективности и безопасности антибактериальной терапии используются различные способы (табл. 1).
Эффективность назначения пробиотиков в качестве терапии прикрытия при приеме антибиотиков доказана в ряде исследований. Так, установлено, что использование пробиотиков на фоне антибактериальной терапии способствует профилактике развития избыточного кандидозного обсеменения кишечника (табл. 2).
Согласно результатам мета-анализа (общее число пациентов – 1671), дополнительное использование пробиотиков на фоне приема антибиотиков способствует снижению частоты побочных эффектов антибактериальной терапии с 38,5 до 24,5% [3].
К сожалению, в ряде случаев, даже при назначении индивидуально подобранного препарата (с учетом чувствительности к нему возбудителя), при правильной дозе и коротком курсе лечения полное восстановление количественного и качественного состава микрофлоры кишечника происходит не ранее чем через месяц, а достаточно часто (в 5–25%, а по некоторым данным, в 3–29% случаев) развивается ААД (3 и более эпизодов неоформленного стула в течение 2 последовательных дней или более, развившихся на фоне применения антибактериальных средств) [3–5].
Основные факторы, повышающие риск развития нарушений микрофлоры кишечника на фоне антибиотикотерапии можно разделить на две группы:
- Общие: стрессы различного генеза, особенно хрониостресс; нерегулярное и/или несбалансированное по составу нутриентов питание, дефицит пищевых волокон, резкая смена рациона и режима питания, использование ксенобиотиков различного происхождения; нарушение биоритмов, повышенный радиационный фон, магнитные возмущения.
- Индивидуальные, связанные с заболеваниями и приемом лекарств: заболевания внутренних органов; терапия гормонами, цитостатиками, лучевая терапия, оперативные вмешательства; острые инфекционные заболевания желудочно-кишечного тракта; снижение иммунного статуса различного генеза [6].
Говоря о дисбиозе кишечника, следует отметить, что отсутствие этого термина как диагноза в Международной классификации болезней 10-го пересмотра не позволяет отрицать существования данного синдрома, имеющего четкое определение, симптомы и классификацию по степени тяжести. Дисбиоз кишечника – это клинико-микробиологический синдром, характеризующийся количественными, качественными и топографическими изменениями нормальной кишечной микрофлоры, являющийся выражением адаптационных реакций системы «организм человека–нормальная микрофлора», проявляющийся прогредиентным нарастанием клинических проявлений основного заболевания [6, 7].

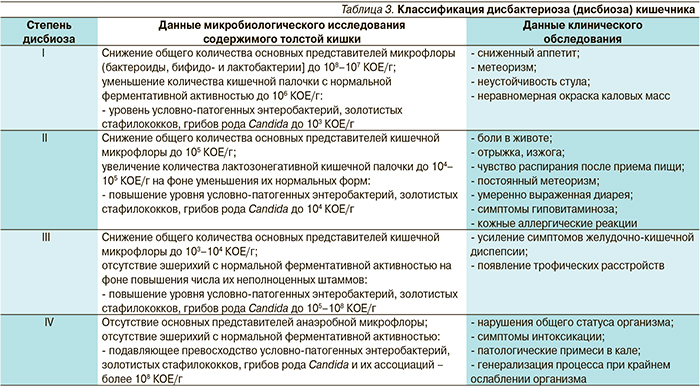
К основным клиническим проявлениям дисбиоза кишечника относятся периодические схваткообразные боли по ходу толстой кишки, метеоризм, расстройства стула со склонностью к поносу, запору или их чередование. Выделяют четыре степени дисбиоза кишечника. В табл. 3 представлен модифицированный вариант классификации данного синдрома, согласно Методическим рекомендациям по микробиологической диагностике дисбактериозов кишечника в лечебно-диагностических учреждениях армии и флота (1999) с дополнениями, основанными на обобщении литературных данных о клинико-микробиологических параллелях при дисбактериозе кишечника [7].
В зависимости от степени тяжести дисбиоза кишечника варьируются доза и длительность назначения пробиотических препаратов, используемых для коррекции нарушений кишечной микрофлоры.
К факторам риска развития ААД (крайнего проявления дисбиоза кишечника) относят [8–11]:
Возраст до 5 и старше 65 лет.
Тяжелые соматические заболевания в анамнезе (тяжелые и сочетанные травмы, уремия, тяжелая сердечная недостаточность и др.).
Хронические заболевания органов пищеварения.
Несоблюдение режима приема антибиотиков (слишком короткий или длительный курс, частая смена антибиотиков, высокие дозы препаратов).
Длительное пребывание в стационаре.
Лечение цитостатическими и иммуносупрессивными препаратами, а также врожденные иммуноде-фициты.
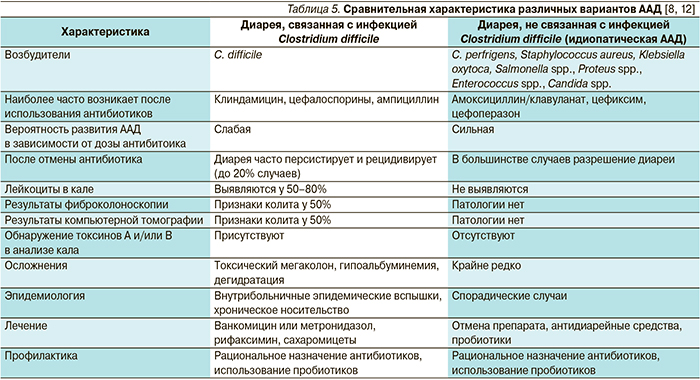
Следует помнить также об антибактериальных препаратах, наиболее часто вызывающих ААД (табл. 4) [8].
ААД подразделяется на два варианта, что связано с особенностями течения, диагностических находок, а также подходов к лечению (табл. 5).
Как видно из представленной таблицы, пробиотики рекомендуются в лечении и профилактике обоих вариантов ААД, их использование больными, получающими антибиотики, положительно влияет на состояние кишечной микрофлоры и улучшает переносимость антибиотикотерапии [1, 2, 5]. Эффективность и актуальность назначения пробиотиков совместно и одновременно с антибиотиками с целью профилактики ААД подтверждена результатами мета-анализа [13]. При этом имеет место статистически значимое снижение риска развития ААД на 44%, а диареи, ассоциированной с инфекцией C. difficile – на 71%. Важно отметить, что для достижения максимального эффекта пробиотики следует назначать с первого дня антибиотикотерапии.
Пробиотические препараты кроме коррекции нарушений кишечной микрофлоры обеспечивают ряд дополнительных положительных эффектов, в частности способствуют улучшению иммунологических показателей гуморального и клеточного иммунитета, снижению аллергизации организма, а также стимуляции местной иммунологической защиты, например укреплению слизистого защитного барьера и снижению выраженности воспаления слизистой оболочки желудка [2, 14]. Таким образом, можно говорить о сверхсуммарном положительном эффекте пробиотиков, а их назначение совместно с антибиотиками способствует не только повышению безопасности, но и эффективности лечения инфекций. Перспективным считается использование в качестве адъювантной терапии при лечении антибиотиками пробиотиков на основе Bifidobacteria spp., Lactobacilli spp. и Enterococcus faecium, а также их различных комбинаций. Эти бактерии являются основными представителями нормального микробиоценоза кишечника и, следовательно, ответственны за большинство положительных эффектов кишечной микрофлоры: от профилактики и коррекции дисбиоза кишечника до стимуляции иммунитета и синтеза витаминов [15].

Актуальным считается использование препаратов на основе Bacillus subtilis, т.к. они способствуют существенному угнетению представительства условно-патогенных микроорганизмов в толстой кишке и повышению активности иммунной системы организма человека [2, 16]. Эффективно использование непатогенных дрожжевых грибков Saccharomyces boulardii в лечении и профилактике развития ААД, в т.ч. в комбинации с ванкомицином [12]. Результаты последних исследований показали, что актуальным остается использование не просто пробиотиков на основе живых микроорганизмов, а использование метабиотиков – препаратов на основе продуктов метаболизма или структурных компонентов пробиотических микроорганизмов [17]. Одним из ярких примеров метабиотиков является Бактистатин – комбинированный препарат на основе метаболитов Bacillus subtilis. Высокая эффективность данного препарата обусловлена его уникальным составом (см. рисунок).
Согласно нашим данным, при назначении Бактистатина в сочетании с антибиотиками отмечается более быстрый и полный регресс клинических симптомов, уменьшение частоты встречаемости побочных эффектов антибиотикотерапии, а также достоверное улучшение качества жизни больных, что в свою очередь способствует повышению приверженности пациента к лечению [18]. Улучшение состояния микробиоценоза кишечника практически по всем показателям имело место у лиц, получающих Бактистатин. При приеме антибиотиков без прикрытия пробиотиком наблюдалась тенденция к увеличению выраженности дисбиотических изменений в толстой кишке с достоверным уменьшением количества лактобацилл. Кроме того, обращало на себя внимание, что в группе исследования не наблюдалось учащения стула в отличие от группы сравнения, где имела место четкая тенденция в сторону диареи [18]. Бактистатин устойчив к действию антибиотиков, и, следовательно, может назначаться с первого дня антибиотикотерапии, что обеспечивает максимальный положительный эффект в отношении профилактики и коррекции дисбиотических изменений в кишечнике [19].
В последнее время высокую актуальность приобретает изучение бактериоцинов бактериального происхождения в отношении разработки новых антимикробных препаратов с направленным бактерицидным действием и обладающих меньшим, чем антибиотики, числом побочных эффектов. Бактериоцины рассматривают как факторы межмикробного антагонизма, обеспечивающие регуляцию популяции бактерий и колонизационную устойчивость организма человека и животных к патогенным микроорганизмам. Стерилизованная культуральная жидкость Bacillus subtilis 3 в составе Бактистатина помимо прочих компонентов содержит бактериоцины, что также может быть причиной высокой антагонистической активности препарата в отношении условно-патогенных и патогенных микроорганизмов.
В заключение заметим, что совместное использование антибиотиков и пробиотиков существенно повышает эффективность и безопасность терапии инфекционных заболеваний. Данное сочетание препаратов может быть рекомендовано в лечении острых респираторных заболеваний, острых кишечных инфекций, лямблиоза, в эрадикации Helicobacter pylori, в терапии заболеваний мочевыделительной системы и заболеваний, передаваемых половым путем, и т.п. Хочется надеяться, что назначение пробиотиков совместно с курсом антибиотиков, особенно лицам, имеющим факторы риска развития ААД, прочно войдет в рутинную медицинскую практику.



