Системные васкулиты (СВ), ассоциированные с антинейтрофильными цитоплазматическими антителами (АНЦА), являются жизнеугрожающими аутоиммунными заболеваниями, для которых характерно полиорганное поражение. В соответствии с современной классификацией группа АНЦА-СВ включает гранулематоз с полиангиитом (ГПА), микроскопический полиангиит (МПА) и эозинофильный гранулематоз с полиангиитом (ЭГПА), объединенные общностью патогенеза с ключевой ролью гиперпродукции АНЦА, сходством клинического течения и прогноза [1]. Необходимость ранней диагностики АНЦА-СВ и неотложного назначения активной терапии продиктована упорным, прогрессирующим течением этих заболеваний с фатальным прогнозом в отсутствие своевременного и адекватного лечения. Так, средняя продолжительность жизни больных ГПА без лечения не превышает 5 месяцев, летальность за первый год болезни достигает 82% [2]. МПА отличает худший прогноз по сравнению с другими формами АНЦ-СВ [3, 4].
Лечение АНЦА-СВ подразделяют на этапы индукционной и поддерживающей терапии. Термин «индукционная терапия» (ИТ) применяют по отношению к протоколам лечения, направленным на достижение ремиссии заболевания. Современное лечение аутоиммунных заболеваний, так же как и онкогематологической патологии, осуществляют в соответствии с протоколами, разработанными в результате систематически и транспарентно развивающегося международного научного процесса и представляющими собой научнообоснованные, ориентированные на практику руководства. Такие рекомендации, как правило, одобрены консенсусом комиссии экспертов в соответствии с рейтинговой схемой, включающей общепринятые понятия: уровень доказательности и силу рекомендации [5]. Так, уровень доказательности Ia и Iв обоснован как минимум одним рандомизированным контролируемым клиническим исследованием хорошего качества, непосредственно посвященным теме данной рекомендации и демонстрирующим общую устойчивость результатов.
Системные проблемы в лечении АНЦА-СВ могут быть связаны с неполным выполнением или ошибочным применением в условиях реальной клинической практики научно-обоснованных протоколов лечения. Повсеместно в мире обращают внимание на рост несоответствия между теоретическими знаниями и прикладной деятельностью [6]. С другой стороны, жесткое внедрение протоколов диагностики и лечения может приводить к сужению врачебного мышления.
В настоящее время при АНЦА-СВ эффективно применяют два общепринятых протокола ИТ: стандартное лечение циклофосфаном (ЦФ) в сочетании глюкокортикоидами (ГК) и пополнившую в последние годы арсенал ИТ биологическую анти-В-клеточную терапию ритуксимабом (РТМ) [7]. Поздняя диагностика и запоздалое назначение ЦФ или РТМ способствуют более тяжелому течению АНЦА-СВ с необратимым повреждением органов, присоединением осложнений, повышением риска рецидива.
Несмотря на высокую эффективность при АНЦА-СВ и относительную безопасность новой стратегии с использованием РТМ, в т.ч. для больных с длительным рецидивирующим течением заболевания или рефрактерных к ЦФ [8–11], стандартная схема, включающая ЦФ, по-прежнему обоснованно сохраняет равноправное значение как метод лечения первого ряда.
При планировании ИТ необходимо учитывать ряд факторов, в первую очередь тяжесть течения АНЦА-СВ и наличие коморбидной патологии. Рациональное и персонифицированное назначение ИТ базируется на оценке степени активности (индекс активности) [12] и фазы клинического течения (дебют, рецидив, ремиссия), определении риска тяжелых осложнений заболевания и факторов неблагоприятного прогноза [13], степени повреждения органов или тканей (индекс повреждения) [14], которое в отличие от воспалительной активности не будет поддаваться обратному развитию в результате лечения.
Выделяют рефрактерный вариант течения АНЦА-СВ, при котором отсутствует обратное развитие клинических проявлений заболевания или наблюдается увеличение клинической активности, несмотря на стандартную ИТ в течение 6 недель. В таких случаях эффективным может быть назначение РТМ или альтернативных методов лечения. В реальной клинической практике одним из распространенных заблуждений считается преувеличение возможностей ГК для контроля АНЦА-СВ.
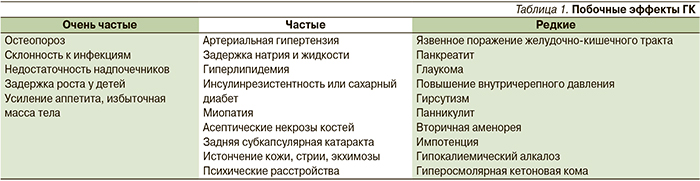
Вместе с тем хорошо известно, что монотерапия ГК не оказывает существенного влияния на прогноз АНЦА-СВ. Так, выживаемость больных ГПА при монотерапии ГК не превышает трех лет [15]. Сроки назначения ГК не влияют на тяжесть последующего течения ГПА, в то время как позднее назначение ЦФ в два раза увеличивает риск генерализации ГПА и способствует более тяжелому течению с высокой клинической активностью и персистенции гранулематозного воспаления [16]. В крупном европейском исследовании недавно было продемонстрировано, что индекс повреждения АНЦА-СВ определяется продолжительностью примененияГК (наряду с возрастом, тяжестью дебюта и частотой рецидивов заболевания) [17].
В то же время применение ГК занимает определенное и важное место в схеме ИТ, а отмену ГК относят к факторам риска рецидива АНЦА-СВ, как и отмену лечения иммуносупрессантами, низкую кумулятивную дозу ЦФ, эпитопную специфичность АНЦА к протеиназе-3, персистенцию АНЦА в период ремиссии и гранулематозное поражение дыхательных путей [18, 19].
Неэффективность монотерапии и частые серьезные побочные эффекты терапии высокими дозами ГК (табл. 1) [20] способствовали разработке схем лечения АНЦА-СВ, включающих иммуносупрессанты, прежде всего ЦФ. В 1985 г. исследования А. Fauci, посвященные внедрению ЦФ и ГК для лечения СВ, были причислены Стэнфордским Университетом к одним из наиболее важных достижений последних двух десятилетий в лечении ревматических заболеваний.
Эффективность применения ЦФ обусловлена прежде всего его сильной антипролиферативной активностью [21], что подтверждается мощным подавлением продукции антител плазматическими клетками и нарушением функции Т-лимфоцитов при введении ЦФ в пролиферативную фазу иммунного ответа. Предшественники клеток, продуцирующих антитела, особенно высокочувствительны к ЦФ, поскольку являются быстропролиферирующей популяцией. Функции регуляторных Т-клеток более чувствительны, чем функции цитотоксических эффекторных предшественников, ЦФ в большей степени, чем Th1-зависимые иммунные реакции, подавляет Th2. Прием низких доз ЦФ вызывает преимущественно депрессию клеточного иммунитета, а пульсовое введение высоких доз – гуморального иммунитета. Таким образом, сила повреждающего действия на лимфоидную и миелоидную ткани зависит от способа введения ЦФ и его дозы [22].
Применение ЦФ способствовало значительному повышению выживаемости больных АНЦА-СВ, которая при ГПА достигает 82% за 5 лет болезни [21]. В то же время по-прежнему сохраняется проблема летальности, обусловленная не только проявлениями АНЦА-СВ, но и побочными эффектами терапии.
Принципы безопасного применения ЦФ, разработанные в онкологии [22], применяют при лечении больных АНЦА-СВ. В первую очередь они включают приоритетное использование внутривенного пульсового введения ЦФ в связи с его низкой токсичностью по сравнению с назначением внутрь [24]. В исследовании CYCLOPS продемонстрировано отсутствие различий в частоте достижения ремиссии АНЦА-СВ при применении ЦФ в режиме ежедневного приема внутрь или пульсового внутривенного введения [24]. Одновременно внутривенный режим позволяет снизить кумулятивную дозу ЦФ при сохранении терапевтического эффекта и уменьшить частоту побочных эффектов. Снижение риска нейтропении при внутривенном введении ЦФ относят к главному фактору уменьшения инфекционных осложнений. С другой стороны, в долгосрочной перспективе снижение кумулятивной дозы ЦФ может ассоциироваться с более высоким риском рецидива АНЦА-СВ [18].
Всем пациентам с дебютом АНЦА-СВ, представляющим угрозу для жизни или необратимого повреждения органов, рекомендована ИТ, включающая сочетанное применение ГК и внутривенно ЦФ или РТМ (в соответствии с рекомендациями 2014 г. Британского ревматологического общества и Британской ассоциации ревматологов по лечению АНЦА-СВ уровень/сила рекомендации 1a/А, окончательный консенсус 100%) [7].
В отношении больных АНЦА-СВ без повреждения почек или других органов (например, при изолированном поражении верхних дыхательных путей без компьютерно-томографических признаков деструкции костной ткани) может обсуждаться альтернативная ИТ с назначением препарата второго ряда метотрексата (МТ) (1b/А, 90%) или в случае его непереносимости – микофенолата мофетила (ММФ) (2а/В, 90%) [7]. Вместе с тем, по данным исследования NORAM, при сравнительном наблюдении в течение 18 месяцев пациентов с АНЦА-СВ без тяжелого поражения почек в результате лечения ЦФ безрецидивный период был продолжительнее и безрецидивная выживаемость выше, чем в группе МТ [25]. Об эффективности ММФ при АНЦА-СВ свидетельствуют предварительные результаты исследования MYCYC, в соответствии с которым ММФ не уступает ЦФ в отношении индукции первичной ремиссии [26].
Среди причин возможной недостаточной эффективности ЦФ следует отметить позднюю диагностику и позднее начало лечения, наличие прогностически неблагоприятного варианта АНЦА-СВ, неадекватные схемы ИТ, быстрый переход к поддерживающей схеме лечения или прерывание лечения – нередко в связи с присоединением инфекционных осложнений.
В реальной клинической практике присутствует тенденция к необоснованному искажению протокола стандартной ИТ в виде применения редуцированных доз ЦФ, удлинения интервала между инфузиями, игнорированию контроля общей кумулятивной дозы ЦФ, недостаточному мониторингу показателей безопасности и эффективности лечения.
АНЦА-СВ свойственно рецидивирующее течение, риск развития обострения выше среди больных ГПА (64%) по сравнению с МПА или ЭГПА (35–34%) [27]. Риск рецидива сохраняется и в долговременной перспективе, поэтому после достижения ремиссии необходим регулярный мониторинг состояния пациентов первоначально через 3 месяца, затем каждые 6 месяцев, а при сохранении долговременной стойкой ремиссии ежегодно (2b/В, 100%) [7]. При развитии рецидива возобновляют лечение в соответствии с протоколом ИТ.
Рекомендовано внутривенное введение ЦФ 15 мг/кг в течение 40–60 минут, первоначально с интервалом в две недели (первые 2–3 инфузии), затем каждые 3 недели (1a/А, 90%) [7]. Однократная доза ЦФ не должна превышать 1,5 г. Перед инфузией ЦФ проводят гидратацию (например, введение 1 л изотонического раствора), а в последующие 3 дня увеличивают прием жидкости до 3 л в сутки, рекомендуют частое опорожнение мочевого пузыря.
Продолжительность каждого курса ЦФ должна быть не менее 3 месяцев, но не превышать 6 месяцев (1b/B, 90%) [7], более длительное лечение ассоциируется с повышением частоты побочных эффектов, в первую очередь инфекционных. Поскольку долгосрочная токсичность ЦФ определяется суммарной дозой всех курсов, общая кумулятивная доза ЦФ, по мнению ведущих экспертов, не должна превышать 25 г (3/C, 90%) [7, 25, 28].
Возможность перехода на поддерживающую терапию через 3–6 месяцев лечения ЦФ обоснована клиническими исследованиями [18]. После отмены ЦФ поддерживающее лечение проводят азатиоприном (АЗ) 2 мг/кг/сут с возможным снижением дозы до 1,5 мг/кг/сут через год (А), лефлуномидом 20–0 мг/сут или ММФ 1–2 г/сут (В).
Важной составляющей частью ИТ является применение высоких доз ГК (С), способных ингибировать синтез провоспалительных простагландинов, лейкотриенов, брадикинина, гистамина, фосфолипаз, нитроксильных радикалов и экспрессию адгезивных молекул, резко ограничивать такие проявления воспаления, как отек, расширение сосудов, приток нейтрофилов и моноцитов в очаг воспаления, что одновременно служит причиной снижения защиты организма против инфекций [29, 30]. В отличие от Т-лимфоцитов В-лимфоциты относительно мало чувствительны к иммуносупрессивному действию ГК. Так, доза преднизолона (ПЗ) 20 мг/сут не оказывает влияния на функциональную активность нейтрофилов, продукцию антител или концентрацию иммуноглобулинов в сыворотке крови.
В основе эффектов ГК лежит геномный механизм, основанный на взаимодействии с факторами транскрипции. В то же время при назначении высоких и сверхвысоких доз ГК включаются негеномные механизмы с изменением свойств биомембран, подавлением экспрессии рецепторов, регуляцией активации лимфоцитов, ингибицией синтеза провоспалительных цитокинов.
ГК назначают внутрь или при высокой активности АНЦА-СВ, поражении жизненно важных органов, неблагоприятных прогностических признаках применяют внутривенное пульсовое введение метипреда (МП) суммарно в дозе 0,5–3 г (В) [31]. При индукционном пульсовом введении МП в ряде случаев может быть эффективна редуцированная доза ПЗ внутрь (С). Рекомендованная доза ПЗ внутрь 1 мг/кг/сут утром (не более 80 мг) до достижения эффекта, как правило, не менее месяца. В дальнейшем дозу ПЗ постепенно снижают по 1,25 мг – на 25% в месяц до достижения дозы ПЗ 20 мг/сут, затем на 10% каждые 2 недели до 10 мг/сут, далее со скоростью 1,25 мг каждые 4 недели.
В период индукции ремиссии ежемесячно оценивают эффективность лечения и активность АНЦА-СВ. Если ремиссия не достигнута, заболевание рассматривается как рефрактерное и требуется альтернативная терапия. При рефрактерности ЦФ или при его непереносимости может быть высокоэффективно лечение РТМ (B), однако рутинного сочетания ЦФ и РТМ следует избегать в связи с повышением риска побочных эффектов, в первую очередь нейтропении и инфекций [32–34].
Несмотря на существование научно обоснованного протокола ИТ, применение ЦФ, несомненно, требует персонифицированного подхода. Поскольку реакция иммунной системы в ответ на лечение является во многом индивидуальной, каждое последующее введение ЦФ осуществляют с учетом реакции пациента на предыдущее введение. На протяжении всего лечения ЦФ и ГК проводят тщательный мониторинг возможных осложнений и при необходимости модифицируют протокол в соответствии с показателями безопасности.
Регулярно контролируют число лейкоцитов периферической крови и снижают дозу ЦФ при выявлении лейкопении и/или нейтропении (1b/В, 100%) [7]. Общий клинический анализ крови выполняют на 7–10-й день после первого внутривенного введения ЦФ. При снижении числа лейкоцитов крови менее 3×109/л (нейтрофилов менее 1,5×109/л) уменьшают последующую дозу ЦФ на 40% (если лейкоциты 1–2×109/л, нейтрофилы 0,5–1,0×109/л) или на 20% (если лейкоциты 2–3×109/л, нейтрофилы 1,0–1,5×109/л). Даже при восстановлении в день инфузии ЦФ лейкоцитов до 4×109/л (нейтрофилов до 2×109/л), дозу ЦФ следует снижать. В дальнейшем каждый раз накануне дня инфузии ЦФ контролируют общий анализ крови. При снижении числа лейкоцитов менее 4×109/л (нейтрофилов менее 2×109/л) лечение ЦФ откладывают до нормализации показателей, еженедельно контролируя общий анализ крови. При последующем развитии эпизода лейкопении и/или нейтропении плановую дозу ЦФ снижают на 25%.
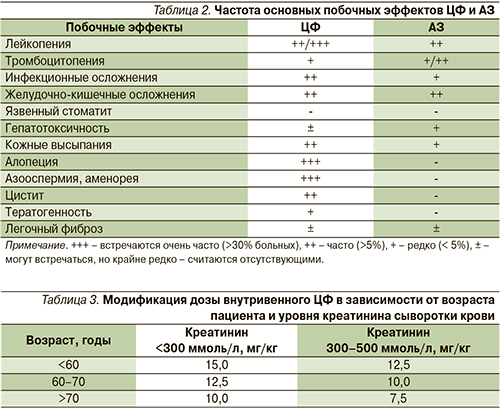
Лечение ЦФ может сопровождаться разнообразными осложнениями (табл. 2), в первую очередь инфекционными.
Только за первый год стандартной терапии серьезные побочные эффекты отмечаются у каждого четвертого пациента [35]. Около трети от общего числа летальных исходов ГПА составляют побочные эффекты длительной терапии ЦФ, и в первую очередь инфекции. Инфекционные осложнения и развитие лейкопении служат независимыми предикторами неблагоприятного исхода.
Для профилактики пневмоцистной пневмонии назначают триметоприм/сульфаметоксазол в дозе 960 мг 1–2 раза в сутки или 3 раза в неделю (B). При его непереносимости альтернативой являются ингаляции пентамидина 300 мг 1 раз в месяц. Поскольку инфекции, в т.ч. носительство Staphylococcus aureus, провоцируют обострения ГПА [36], рекомендовано длительное применение мупироцина местно на слизистую оболочку полости носа (С). Проводят вакцинацию против пневмококковой инфекции, гепатита В и гриппа (С).
Пациентам, получающим высокие дозы ЦФ и ГК, рекомендовано проведение противогрибковой профилактики с назначением внутрь флуконазола или амфотерицина (3/С, 100%) [7]. Эффективность нистатина не превышет эффективности плацебо по данным мета-анализа превентивного применения противогрибковых препаратов у больных, получающих иммуносупрессанты [28].
Хорошо известно повреждающее действие ЦФ в отношении мочевого пузыря в виде геморрагического цистита и рака мочевого пузыря [37]. Установлена зависимость развития этих осложнений от кумулятивной дозы ЦФ [38]. Риск рака мочевого пузыря возрастает при суммарной дозе ЦФ более 30 г [28]. Он может развиваться через продолжительное время после окончания лечения ЦФ [28] и требует тщательного обследования больных персистирующей гематурией. Всем больным, ранее получавшим ЦФ, следует неопределенно долго и регулярно (каждые 3–6 месяцев) контролировать общий анализ мочи (2b/C, 100%) [7].
Для снижения риска повреждения мочевого пузыря превентивно назначают внутривенное введение 2-меркаптоэтансульфоната натрия (2b/С, 100%) [7], который защищает мочевые пути от токсичного метаболита ЦФ акролеина. Разовая доза препарата составляет 20% от дозы внутривенного ЦФ, 2-меркаптоэтансульфонат натрия вводят внутривенно непосредственно перед инфузией ЦФ и затем через 2 и 6 часов после нее внутривенно или внутрь.
Поскольку фармакологической активностью обладают только реактивные метаболиты ЦФ, образующиеся в печени под действием монооксигеназ, при нарушении метаболической активации, например при патологии печени, ЦФ теряет свою фармакологическую активность. Метаболиты ЦФ, в первую очередь акролеин, опосредуют его токсическое действие. Таким образом, токсические и иммуносупрессивные эффекты ЦФ тесно связаны между собой. Интересно, что гипергликемия блокирует разрушение активных метаболитов ЦФ, изменяя его фармакокинетику и увеличивая противоопухолевую активность при злокачественных новообразованиях [39]. ЦФ проявляет гепатотоксичность [40], и в процессе лечения необходим плановый мониторинг печеночных трансаминаз (C).
Процедура гемодиализа эффективно удаляет из циркуляции ЦФ и его активные метаболиты [41, 42]. Больным, получающим гемодиализ, перед проведением трансплантации почки назначают высокие дозы ЦФ без усиления токсичности [42, 43].
При хронической почечной недостаточности (ХПН) отмечено повышение и пролонгация концентрации ЦФ в сыворотке крови [41, 44–46]. В то же время не установлена связь между выраженностью ХПН и глубиной или продолжительностью миелосупрессии у больных поражением почек даже при применении сверхвысоких доз ЦФ [47]. У пациентов с миеломной болезнью не обнаружено корреляции между клиренсом креатинина и клиренсом ЦФ или его метаболитов [48]. Вместе с тем, по общему мнению, при АНЦА-СВ рекомендовано снижение дозы внутривенного ЦФ при повышении уровня креатинина или в пожилом возрасте (табл. 3) [7, 41].
Наличие ХПН не влияет на степень иммуносупрессии, вызванной АЗ. Тем не менее пациентам с недостаточным клиренсом креатинина рекомендовано снижение дозы АЗ на 25% (при клубочковой фильтрации 10–50 мл/мин) или 50% (менее 10 мл/мин) [49].
Накоплен опыт, свидетельствующий о хороших перспективах трансплантации почки больным АНЦА-СВ. В настоящее время при АНЦА-СВ выживаемость больных после трансплантации почки и функциональная выживаемость почечного трансплантата выше, чем при других заболеваниях почек, наблюдается снижение риска рецидива васкулита после трансплантации. Поскольку летальность пациентов несколько выше при выполнении трансплантации менее чем через один год после индукции ремиссии, целесообразно ее проведение по истечении этого срока [50].
Таким образом, стандартная ИТ может быть эффективной для 90% больных АНЦА-СВ [24], основой успешной ИТ является поддержание тонкого баланса между применением рекомендованного режима дозирования препаратов, достаточного для стойкого подавления активности АНЦА-СВ и одновременного сдерживания риска разнообразных осложнений лечения.



