На сегодняшний день побочные эффекты, ассоциированные с приемом нестероидных противовоспалительных препаратов (НПВП), являются актуальным предметом научно-практических дискуссий и объектом многочисленных экспериментальных и клинических исследований. Долгие годы пристальный интерес ученых-медиков был прикован к НПВП-индуцированным поражениям желудка и двенадцатиперстной кишки. Хорошо изучены и известны как клинические, так и патоморфологические особенности данной патологии. Между тем нередкой и серьезной проблемой, с которой приходится сталкиваться практикующим врачам, является лекарственная патология пищевода, в т.ч. связанная с приемом НПВП. Так, согласно данным некоторых исследователей, прием НПВП (включая низкие дозы аспирина) способен существенно (примерно в два раза) увеличивать вероятность развития пептического эзофагита с риском образования язв, кровотечения или формированием стриктуры [1]. Значение данной проблемы определяется чрезвычайно широким использованием НПВП в качестве эффективного и доступного средства для патогенетической терапии боли и воспаления.
Общеизвестно, что к концу XX столетия отмечено увеличение частоты гастроэзофагеальной рефлюксной болезни (ГЭРБ), тогда как число пациентов с язвенной болезнью стало уменьшаться. В связи с этим европейское сообщество гастроэнтерологов в 1997 г. на Объединенной европейской гастронеделе в Бермингеме провозгласило лозунг «XX век – век язвенной болезни, XXI век – век ГЭРБ». Учитывая столь широкое и распространенное потребление НПВП населением всего земного шара, можно в полной мере говорить о существенной значимости данного класса препаратов как одного из основных причинно-следственных факторов увеличения распространенности ГЭРБ. Следовательно, прием НПВП может быть независимым фактором риска развития ГЭРБ, что подтверждается результатами как зарубежных, так и отечественных исследователей.
Так, в рамках реализации многоцентровой научно-исследовательской программы МЕГРЭ по изучению распространенности изжоги в российской популяции нами было отобрано и проанкетировано 1288 человек, проживающих в Красногвардейском районе Санкт-Петербурга [2]. При этом оказалось, что жалобы на изжогу и другие проявления ГЭРБ, такие как регургитация желудочного содержимого в пищевод и/или глотку, предъявляли 53% опрошенных. Однако принципиальным стало выявление следующей закономерности: никто из респондентов, принимавщих НПВП реже одного раза в неделю, не предъявлял жалоб, указывающих на возможность наличия ГЭРБ, тогда как лица с клиническими проявлениями ГЭРБ в 25% случаев принимали НПВП не реже 1 раза в неделю, а 41% опрошенных с жалобами на изжогу принимали НПВП несколько раз в течение месяца. Более того, основной симптом ГЭРБ – «изжога» – встречался чаще всего именно у респондентов, принимавших НПВП (аспирин и неселективные НПВП), тогда как другие причины появления симптоматики ГЭРБ отмечались несколько реже.
Результаты анализа трехмесячного исследования, проведенного во Франции, показали, что среди 10 тыс. респондентов 6823 (72,6%) принимали НПВП и в 68% случаев имели клинические проявления ГЭРБ в виде изжоги и/или регургитации кислого желудочного содержимого в пищевод с увеличением частоты жалоб [3]. При этом превалирование симптомов ГЭРБ отмечалось у 27% пациентов, принимавших НПВП, в возрасте старше 65 лет, среди которых преобладали женщины.
B. Avidan и соавт. (2001) отметили, что в группе из 195 больных ревматическими заболеваниями, принимавших НПВП и прошедших эндоскопическое исследование, признаки эзофагита были выявлены у 21% пациентов [4].
На базе СЗГМУ им. И.И. Мечникова было проведено исследование по изучению клинико-эндоскопических проявлений НПВП-индуцированных поражений пищевода у 430 пациентов с ревматическими заболеваниями (большинство из них с остеоартрозом крупных суставов), ежедневно принимавших НПВП свыше 1 месяца, и оценке возможных факторов риска развития данной патологии [5]. Средний возраст больных составил 58 лет, лица 65 лет и старше составили 25,3% (n=109). Жалобы на изжогу предъявляли 57,7% (n=248), при этом у подавляющего большинства больных (n=159, 64,1%) изжога носила выраженный характер. Жалобы на отрыжку кислым (регургитацию) отмечались у 11,6 % (n=50) опрошенных, тошноту – 29,06% (n=125), боли за грудиной при изменении положения тела – 19,06% (n=82), солоноватый привкус во рту – 11,4% (n=49), болезненное прохождение пищи по пищеводу – 10,69% (n=46), затрудненное прохождение пищи по пищеводу – 10,7% (n=47), кашель после приема НПВП – 6,27% (n=27) пациентов.
Среди обследованных больных эндоскопически позитивный вариант ГЭРБ – эрозивный эзофагит – был выявлен у 54 (15,2%) пациентов, возраст 32 (38,5%) из них составил 65 лет и старше. У подавляющего большинства больных с этой патологией (n=49; 66,2%) отмечались выраженные клинические проявления (изжога, регургитация, тошнота, солоноватый привкус во рту), у 5 человек эрозивный эзофагит оказался случайной находкой. Грыжа пищеводного отверстия диафрагмы выявлена у 115 (26,74%) больных, с эрозивным эзофагитом – у 39 (52,7%). Эрозивные повреждения желудка и/или двенадцатиперстной кишки выявлялись у 111 (25,8%) больных, язвы (дефект стенки размером > 5 мм и видимой глубиной) желудка и/или двенадцатиперстной кишки – у 76 (17,67%) пациентов. Эндоскопически негативная форма ГЭРБ выявлена у 163 (37,9%) пациентов, у остальных изменения в пищеводе не отмечены. Стриктура пищевода выявлена у 2 пациентов с эрозивным эзофагитом.
Общеизвестно, что основой патогенеза ГЭРБ является нарушение моторики, в результате чего происходит заброс содержимого желудка в пищевод, откуда его элиминация происходит длительное время. Это приводит к развитию эзофагита, способствующего дальнейшим расстройствам моторики, формируя порочный круг.
Патогенетические механизмы, опосредующие развитие НПВП-индуцированного поражения пищевода, включают [1, 6]:
- усиление желудочной секреции и снижение рН;
- контактное раздражающее действие НПВП на слизистую оболочку пищевода (локальная абсорбция лекарственного препарата слизистой оболочкой пищевода, внутрислизистое накопление в токсических концентрациях);
- снижение выработки бикарбонатов и изменение поверхностных свойств слизи;
- торможение перистальтики желудка, провоцирование гастроэзофагеального рефлюкса и увеличение его частоты.
В целом повреждающее действие НПВП в большей мере обусловлено опосредованным снижением эффективности защитных антирефлюксных механизмов и устойчивости слизистой пищевода к повреждающему действию данного класса препаратов. Клинически НПВП-ассоциированные повреждения пищевода проявляются симптоматикой ГЭРБ, особенно распространены у пациентов пожилого возраста и вызывают существенное беспокойство. При этом важно подчеркнуть значимость внепищеводных проявлений ГЭРБ не только у пожилых пациентов, но и у лиц, страдающих избыточной массой тела или ожирением, когда, например, наряду с изжогой или регургитацией отмечается возникновение приступов кашля и/или удушья преимущественно в ночное или утреннее время, реже – после еды, утренняя осиплость голоса, халитоз и др. [7]. Данный факт может быть обусловлен увеличением градиента давления нижнего пищеводного сфинктера на фоне приема НПВП.
Нельзя не отметить, что НПВП-ассоциированные эзофагиты зачастую сопровождаются выраженными клиническими симптомами и риском развития опасных осложнений, таких как пептическая язва, кровотечение и стриктуры нижней трети пищевода [1]. Среди факторов риска, ассоциированных с повышенной частотой встречаемости НПВП-индуцированной патологии пищевода, описаны такие, как пожилой возраст, мужской пол, прием глюкокортикостероидов, алендроната, низких доз аспирина. Эрозивный эзофагит значительно чаще выявляется у больных с развитием язв желудка и двенадцатиперстной кишки, а также при наличии грыжи пищеводного отверстия диафрагмы [2].
Таким образом, подводя итог вышесказанному, вполне обоснованно возникает вопрос: поражения пищевода, ассоциированные с приемом НПВП, – это изменения в рамках ГЭРБ или все же данная патология является еще одной нозологической единицей, а именно «НПВП-индуцированной эзофагопатией»? Известно, что, когда речь идет о патологических реакциях в желудке на фоне применения НПВП, в клинической практике используется термин «НПВП-гастропатия». Однако данная формулировка отсутствует в Международной классификации болезней 10-го пересмотра (МКБ-10). Вместе с тем в МКБ-10 имеются соответствующие рубрики под определенным кодом в вариантах: салицилаты (Y45.1), производные пропионовой кислоты (Y45.2), другие нестероидные противовоспалительные лекарственные средства (Y45.3). Для кодировки болезней пищевода, желудка и двенадцатиперстной кишки используется код К20-К31. Сочетая разделы данной классификации, можно поставить соответствующий диагноз. Примером постановки диагноза по МКБ-10 могут быть следующие диагностические формулировки: «НПВП-гастропатия: язва желудка, осложненная кровотечением» (K25, K92, Y45.3), «НПВП-индуцированная гастропатия: язва желудка, связанная с приемом диклофенака натрия» (К26, Y45.3). Следовательно, можно провести подобную аналогию и с поражениями пищевода, индуцированными приемом НПВП, и применить термин «НПВП-индуцированная эзофагопатия». Примером постановки диагноза может быть формулировка: «НПВП-индуцированная эзофагопатия: гастроэзофагеальный рефлюкс с эзофагитом, связанный с приемом ацетилсалициловой кислоты, изжога» (К21.0, R12, Y45.1).
Как известно, во второй половине ХХ в. был накоплен огромный опыт в предупреждении негативных проявлений (в большей мере гастроинтестинальных) на фоне приема НПВП. Важнейшее значение в профилактике НПВП-индуцированных поражений верхних отделов желудочно-кишечного тракта (ЖКТ) имеет рациональное использование препаратов с учетом особенностей клинической ситуации и фармакологических свойств лекарств. Согласно Клиническим рекомендациям по применению НПВП, при наличии риска осложнений со стороны ЖКТ следует использовать селективные НПВП (уровень доказательности А) или неселективные НПВП в комбинации с ингибиторами протонной помпы (ИПП) (уровень доказательности А) [8]. Вместе с тем имеются данные, что прием селективных НПВП также может вызывать развитие тяжелого пептического эзофагита и его осложнений, особенно у больных, страдающих ГЭРБ [2, 9]. Таким образом, применение селективных НПВП не может считаться достаточным методом эффективной профилактики НПВП-ассоциированной патологии пищевода.
Поскольку НПВП-индуцированные повреждения пищевода проявляются симптоматикой ГЭРБ (о чем упоминалось выше), для профилактики и/или купирования клинических проявлений необходимо проведение терапии, аналогичной лечению ГЭРБ.
Следовательно, основными направлениями в лечении НПВП-ассоциированных повреждений пищевода являются:
- Изменение режима и характера питания.
- Регламентация образа жизни.
- Изменение дозы и режима приема НПВП.
- Фармакотерапия (ИПП, антациды, прокинетики, альгинатсодержащие препараты, препараты комбинированного действия с антацидным эффектом).
- Хирургическое лечение (при необходимости).
Современные принципы медикаментозной терапии ГЭРБ, согласно Генвальскому консенсусу 1999 г., основаны на использовании препаратов антисекреторного действия, лидирующие позиции среди которых в настоящее время занимают ИПП. Принципиально важно, что ИПП имеют удобную схему применения (1–2 раза в сутки) и, как правило, хорошо переносятся. Их длительное непрерывное использование не сопровождается развитием серьезных нежелательных эффектов, даже если необходимо перманентное лечение.
Ввиду широкого представительства ИПП на фармацевтическом рынке врач зачастую стоит перед выбором назначения того или иного ИПП, и в большинстве случаев данный выбор обусловливают не только аспекты клинической эффективности, но и соображения рентабельности. В настоящее время в гастроэнтерологической практике используются ИПП с несколько различающимися химической структурой и механизмом действия. Широко применяются омепразол (исторически первый – «эталонный» ИПП), лансопразол, пантопразол, рабепразол, а также эзомепразол. Именно эти пять типов ИПП разрешены к применению в Российской Федерации, США и других развитых странах.
Среди всех имеющихся на российском рынке ИПП наибольшего внимания в вопросах лечения и профилактики НПВП-индуцированных поражений верхних отделов ЖКТ заслуживает эзомепразол. Это единственный на сегодняшний день ИПП, для которого официально зарегистрированы такие показания, как «длительный прием НПВП» (заживление язвы желудка, связанной с приемом HПBП; профилактика язвы желудка и двенадцатиперстной кишки, связанной с приемом НПВП у пациентов, относящихся к группе риска «НПВП-гастропатия») [10].
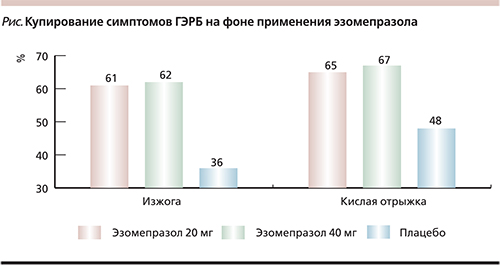
Специальных исследований, посвященных лечению НПВП-индуцированных поражений пищевода, не проводилось. Вместе с тем данные рандомизированных клинических исследований по оценке эффективности ИПП для профилактики развития НПВП-гастропатии показали, что препараты этого класса (в частности, эзомепразол) эффективно купируют изжогу и регургитацию (см. рисунок) [11].
Важно подчеркнуть, что эзомепразол – это первый ИПП, синтезированный в виде чистого левовращающего оптического изомера (S-стереоизомер омепразола). Его особенностью и уникальностью является то, что благодаря стереоизомерии достигается улучшение фармакокинетического профиля и значительное повышение биодоступности препарата, что обеспечивает более выраженное подавление продукции соляной кислоты париетальными клетками желудка. Все остальные представители ИПП являются смесью S- и R-изомеров (рацематами). При сравнении применения эзомепразола и омепразола по 20 мг в течение 5 дней установлено, что площадь под кривой зависимости «концентрация–время» (AUC) у эзомепразола на 70% больше [12]. Данный факт обусловлен меньшей степенью метаболизации эзомепразола системой цитохрома Р450 (CYP2C19) в печени и имеет меньший клиренс по сравнению с R-изомером. Особенно важно учитывать и то обстоятельство, что полиморфизм гена CYP2C19 в популяции достаточно значительный и не позволяет с большой точностью предсказывать эффективность ИПП, метаболизируемых этим ферментом. Эзомепразол позволяет решить данную проблему.
Эффективность эзомепразола в терапии пациентов (n=604) с жалобами на дискомфорт, боли в эпигастрии и изжогу после длительного приема НПВП изучалась в клинических исследованиях NASA2 (Nexium Anti-Inflammatory Symptom Amelioration) и SPACE2 (Symptom Prevention by Acid Control with Esomeprazole) [13]. Пациенты были разделены на три группы и получали эзомепразол 20 и 40 мг/сут, а также плацебо. В динамике через 6 месяцев в группах эзомепразола первоначальные симптомы сохранились лишь у 29 (р=0,006) и 26% (р=0,001) пациентов, тогда как в группе плацебо – у 39%. Кроме того, прием эзомепразола значительно повысил качество жизни пациентов, принимавших НПВП.
Поддерживающая длительная (6 месяцев) противорецидивная терапия ГЭРБ с использованием эзомепразола является достаточно эффективной, что отражено в работах зарубежных авторов. Так, N. Talley и соавт. отметили положительную динамику в купировании симптоматики и повышении качества жизни у пациентов (n=721) с эндоскопически негативной ГЭРБ при применении эзомепразола в дозах 20 и 40 мг/сут по сравнению с группой плацебо. При этом в последней группе частота прекращения лечения превышала 40%, тогда как в группе эзомепразола почти 90% пациентов прошли полный 6-месячный курс терапии и в последующем у большинства не отмечалось жалоб со стороны верхнего отдела ЖКТ [14].
В двух испытаниях других исследований (Johnson D., 2001; Vakil N., 2001) также была показана высокая эффективность эзомепразола в дозе 20 мг/сут для профилактики рецидивов ГЭРБ в течение 6 месяцев после проведенного успешного стартового лечения [15, 16].
При сравнении эффективности омепразола в терапии ГЭРБ в дозе 20 мг/сут и эзомепразола в дозе 20 и 40 мг/сут показатели рН на 5-й день лечения превышали значение 4,0 более длительное время, чем при терапии омепразолом (4,1 и 4,9 против 3,6; р<0,01 и р<0,001 соответственно) [17].
Таким образом, исходя из вышесказанного, можно подчеркнуть высокую эффективность эзомепразола не только в лечении ГЭРБ, но и в профилактике ее рецидивов. Пациенты, получающие НПВП, особенно длительный (свыше 1 месяца) период времени, нуждаются в эффективной профилактике, а при необходимости – и терапии НПВП-индуцированных поражений пищевода. Следовательно, использование эзомепразола может выступать как более эффективная и безопасная альтернатива стандартному длительному приему ИПП предыдущих поколений.
В качестве практической иллюстрации приведем клинический пример эффективной терапии эзомепразолом пациента с ГЭРБ, принимающего НПВП.
Пациент И. 58 лет обратился с жалобами на жжение за грудиной после приема пищи и в ночное время, отрыжку воздухом, кашель по утрам. Данные симптомы беспокоили впервые. Из анамнеза: страдает подагрой около 12 лет, последние 5 лет обострения часто (3–5 раз в год), принимает диклофенак ретард 100 мг/сут курсами до 2 недель, постоянный прием аллопуринола 300 мг/сут (кроме периода обострений). Также страдает гипертонической болезнью, ишемической болезнью сердца, сахарным диабетом 2 типа, ожирением 2-й ст. Постоянно принимает небивалол, периндоприл, аторвастатин, индапамид, ацетилсалициловую кислоту (Аспирин кардио), Глюкофаж. В 50 лет диагностирован эрозивный гастрит, НР (-), со слов пациента, получал необходимую терапию. В периоды приема диклофенака, если возникал дискомфорт в эпигастрии, принимал омепразол. Не курит, алкоголь, по словам больного, употребляет в умеренных количествах. Аллергологический анамнез не отягощен.
На момент обращения имело место обострение подагрического артрита, принимал диклофенак 100 мг/сут в течение 10 дней. Подобные жалобы появились за 5 дней до обращения, самостоятельно начал прием омепразола 40 мг/сут с незначительным эффектом.
Были выполнены все необходимые методы диагностики, по данным функциональной гастродуоденоскопии (ФГДС) было выявленно неполное смыкание кардиального жома. Слизистая пищевода гиперемирована, отечна, в дистальном отделе поверхностные эрозии. Желудок воздухом расправляется, слизистая ярко гиперемирована, отечная, в антральном отделе множество простых и полных эрозий диаметром 0,3–0,8 см.
Хелпил-тест Нр (-). Привратник свободно проходим, смыкаем. Луковица двенадцатиперстной кишки и постбульбарный отдел: слизистая гиперемирована. Большой дуоденальный сосочек не изменен. По результатам суточной рН-метрии значение рН в пищеводе 3,9.
В терапии рекомендована замена омепразола на эзомепразол 40 мг/сут в течение 4 недель. Через неделю была отмечена положительная клиническая динамика: симптомы купированы, при контрольной ФГДС через месяц эрозии в пищеводе и желудке эпителизировались, сохранялась гиперемия слизистой. Была рекомендована поддерживающая терапия эзомепразолом в суточной дозе 20 мг в течение 3–6 месяцев. При контрольном визите через 3 месяца симптомов, эквивалентных ГЭРБ, дискомфорта в эпигастрии не отмечалось. В периоды приема диклофенака рекомендован прием эзомепразола 20 мг/сут в режиме «по требованию».
В заключение хотелось подчеркнуть, что на сегодняшний день имеется немало доказательств патологического влияния НПВП на пищевод, которое не только снижает качество жизни пациентов, но и может представлять непосредственную угрозу для жизни пациента. С учетом широкого применения НПВП в клинической практике, несмотря на тот факт, что клинические проявления НПВП-индуцированных поражений пищевода эквивалентны симптомам ГЭРБ, вполне обоснованно рассматривать данную патологию в рамках самостоятельной нозологической единицы – «НПВП-индуцированной эзофагопатии».
Терапевтическая тактика ведения пациентов с НПВП-индуцироваными поражениями пищевода аналогична терапии ГЭРБ. ИПП в настоящее время, несомненно, являются препаратом выбора для лечения проявлений данной патологии, при этом предпочтение отдается препарату, обладающему не только высокой эффективностью, но и безопасностью.



