Введение
Хроническая сердечная недостаточность (ХСН) осложняет течение многих болезней сердечно-сосудистой системы, при этом отмечается рост числа больных, сохраняется высокая летальность, инвалидизация и социальная дезадаптация пациентов.
В настоящее время число пациентов с сердечной недостаточностью достигает 15 млн в Европе, 6 млн в США, около 8 млн в Российской Федерации [1–3]. В начале XXI в. 17–45% госпитализированных пациентов с сердечной недостаточностью умирают в течение года наблюдения и более 50% в течение 5 лет, хотя отмечена тенденция к снижению летальности [4, 5]. Не менее сложной проблемой медицины является развитие острой декомпенсации ХСН, требующей госпитализации пациентов и сопровождающейся больничной летальностью до 10% [6, 7]. В течение года до 30% пациентов вновь направляются в стационар с утяжелением функционального класса сердечной недостаточности.
В свою очередь лечение таких пациентов требует значительных финансовых затрат (26–39 млн евро на 100 млн населения в Европе), составляя 1–3% от общих расходов на здравоохранение в Северной Америке, Западной Европе и Латинской Америке [8–10].
На сегодняшний день наиболее полно разработаны принципы лечения ХСН с низкой фракцией выброса, в то время как при сохраненной фракции выброса идет поиск новых лекарственных препаратов, повышающих качество жизни пациентов и способных уменьшать частоту повторных госпитализаций, улучшать прогноз заболевания. Одним из таких направлений является использование препаратов, восстанавливающих нормальный метаболизм кардиомиоцитов [11]. К таким лекарственным средствам относится таурин, клиническая эффективность которого была показана пациентам с тяжелой ХСН, интоксикацией сердечными гликозидами, различными нарушениями сердечного ритма [12, 13]. В то же время имеются единичные работы об эффективности препарата в отношении пациентов с ХСН с сохраненной фракцией выброса, влиянии таурина на диастолическую функцию миокарда левого желудочка и уровень биомаркеров, отражающих эффективность лечения и прогноз заболевания.
Целью настоящего исследования стала оценка эффективности таурина для пациентов с ишемической болезнью сердца (ИБС), осложнившейся ХСН, и сохраненной фракцией выброса, а также оценка динамики состояния диастолической функции левого желудка и возможности предупреждения прогресcирования ремоделирования миокарда.
Материал и методы
В исследование были включены 117 больных ИБС, осложненной ХСН II–III функциональных классов (ФК) по классификации NYHA в возрасте от 54 до 76 лет, 50 мужчин и 67 женщин. Из них у 62 пациентов был выявлен II ФК ХСН, у 55 – III. Длительность ХСН составила от 2,5 до 8 лет. Причиной развития застойной сердечной недостаточности послужили постинфарктный кардиосклероз (59 больных) и другие формы ИБС (58 больных). Продолжительность ИБС колебалась от 3 до 12 лет. Диагноз был установлен на основании клинической картины заболевания, анамнеза, данных электрокардиографии (ЭКГ), эхокардиографии (ЭХО-КГ), коронароангиографии, данных определения дистанции 6-минутной ходьбы. Артериальная гипертония была диагностирована у 78 больных.
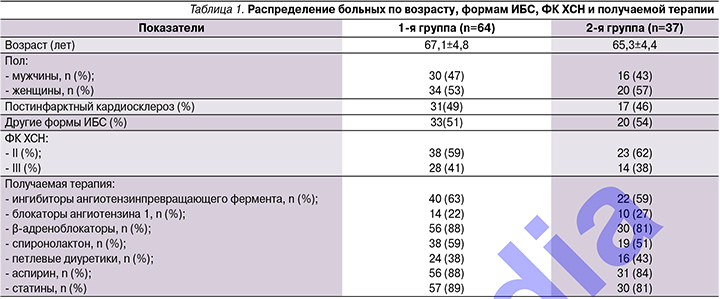
Больные наблюдались в амбулаторных условиях и получали стандартную терапию ХСН, включившую ингибиторы ангиотензинпревращающего фермента или блокаторы рецепторов ангиотензина II, блокаторы β-адренергических рецепторов, диуретики, ацетилсалициловую кислоту. Нитраты принимали 22 (19,7%) больных, блокаторы кальциевых каналов – 14, статины – 94 (80,3%) больных.
В период наблюдения дозы лекарственных препаратов не меняли. После получения информированного согласия больные были рандомизированы на две группы: 1-я группа (основная) – 73 пациента, получавших дополнительно к рекомендованной терапии ХСН курсовое лечение таурином 750 мг/сут в течение 12 месяцев; 2-я группа (контрольная) – 44 пациента, не получавших лечение таурином. За период наблюдения прекратили прием препарата 6 больных и умерли 3 больных 1-й группы, не закончили исследование 5 больных и умерли 2 больных 2-й группы, поэтому основную группу составили 64, контрольную – 37 больных ХСН II–III ФК.
Группы пациентов были сопоставимыми по возрасту, наличию сопутствующих заболеваний и принимаемой лекарственной терапии (табл. 1–2).
Критерии исключения из нашего исследовании:
- Пациенты со злокачественными новообразованиями, выявленными в течение последних 5 лет.
- Пациенты с хроническими нарушениями ритма и проводимости сердца (постоянная форма фибрилляции предсердий, атриовентрикулярная блокада II–III степеней, устойчивая желудочковая тахикардия, полная блокада ножек пучка Гиса).
- Фракция выброса <50%.
- Женщины детородного возраста, не использовавшие адекватные методы контрацепции, и беременные женщины.
- Гемодинамически значимое поражение клапанного аппарата сердца.
- Нормальный уровень NT-proBNP.
- Отсутствие согласия пациента на участие в исследовании.
Использовались следующие методы диагностики исходно и через 12 месяцев наблюдения:
- оценка клинического состояния: ФК сердечной недостаточности определялся с помощью шкалы оценки клинического состояния (ШОКС, в модификации В.Ю. Мареева, 2000) и посредством теста 6-минутной ходьбы;
- трансторакальная ЭХО-КГ на первом и последнем визитах;
- допплер-ЭХО-КГ на первом и последнем визитах;
- определение содержания в крови NT-proBNP и галектина 3 иммуноферментным анализом на первом и последнем визитах.
Статистическая обработка и графическое представление полученных данных осуществлены с помощью пакета программного обеспечения SPSS Statistics/Statistical Package for the Social Sciences 2015 (IBM, США). Выявление статистически значимых межгрупповых различий средних величин клинических, лабораторных, инструментальных, гемодинамических показателей произведено с применением критерия Стьюдента (для групп с нормальным распределением).

Результаты
Для решения поставленной задачи все больные на основании клинической картины заболевания и результатов инструментальных методов обследования были распределены на две группы. Первую (основную) группу составили 64 пациента с ИБС, имевшие клинические симптомы ХСН II–III ФК по классификации NYHA, с фракцией выброса более 50%, которым к стандартной терапии ХСН и ИБС, включившей ингибиторы ангиотензипревращающего фермента, β-адреноблокаторы, спиронолактон, дезагреганты, статины, был добавлен таурин. Вторую (контрольную) группу составили 37 пациентов с аналогичными критериями, которым проводилась стандартная терапия. Основными жалобами пациентов были одышка и сердцебиение при физической нагрузке, повышенная утомляемость, перебои в работе сердца, отеки лодыжек. Динамика функционального класса ХСН у больных оценивалась по результатам теста 6-минутной ходьбы.
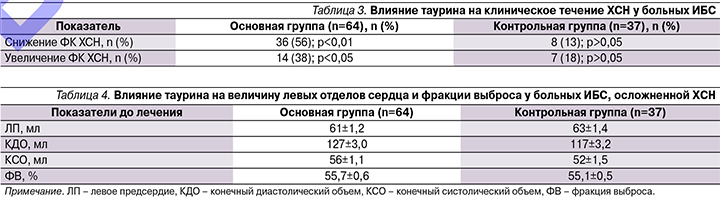
В обеих группах отмечено улучшение клинического состояния у большинства пациентов, что проявлялось в уменьшении одышки, утомляемости и сердцебиения при физической нагрузке у 41 (64%) пациента основной группы и у 13 (35%) – контрольной. Суммарно это выразилось в достоверном снижении суммы баллов по ШОКС в основной группе с 5,9±0,19 до 5,2 ± 0,16 балла (р<0,05) и такой же тенденции в контрольной группе – с 6,1 ± 0,21 до 5,6 ± 0,16 балла (р=0,061). Также по данным теста 6-минутной ходьбы в обеих группах было выявлено снижение ФК ХСН. В группе пациентов, принимавших таурин, к концу периода наблюдения уменьшение ФК ХСН отмечено у 36 из 64 пациентов (56%), в контрольной группе – у 14 из 37 (38%). Необходимо отметить, что у 8 (13%) пациентов основной группы и у 7 (19%) – контрольной произошло утяжеление ФК ХСН (табл. 3).
За 12 месяцев наблюдения были госпитализированы 6 (9%) пациентов основной группы и 7 (19%) – контрольной. Причиной госпитализации пациентов, принимавших таурин, стали декомпенсация ХСН в трех случаях, развитие гипертонического криза в двух, острая внебольничная пневмония в одном случае. В контрольной группе причиной госпитализации оказались острый коронарный синдром у одного пациента и декомпенсация ХСН у 6 больных. За время наблюдения умерли 3 (4,7%) пациента основной группы и 2 (5,4%) – контрольной, которые не были включены в обработку полученных результатов. Причиной летального исхода у пациентов, получавших таурин, были острый инфаркт миокарда, острое нарушение мозгового кровообращения и острая декомпенсация ХСН. В контрольной группе у одного больного развился острый инфаркт миокарда, у другого – отек легких.
Результаты изменений показателей глобальной сократимости миокарда левого желудочка, размеров левых отделов сердца представлены в табл. 4.
Как видно из приведенных данных, при включении в исследование размеры левого предсердия, диастолический и систолический объемы левого желудочка, значение фракции выброса в группах достоверно не различались.
К окончанию периода наблюдения отмечено уменьшение левых отделов сердца в пределах 3–5%, увеличение фракции выбора на 2%, что является статистически не достоверным (р>0,05). В контрольной группе выявлено увеличение левого предсердия и левого желудочка на 3–7%, при уменьшении фракции выброса на 1%, что также не имеет статистически достоверной разницы (р>0,05). Таким образом, курсовое лечение таурином не влияет на основные показатели внутрисердечной гемодинамики у больных ИБС, осложненной ХСН, с сохраненной фракцией выброса.
На момент включения в исследование все пациенты обеих групп имели нарушение диастолической дисфункции левого желудочка (ДДЛЖ) сердца (табл. 5).
В период наблюдения зарегистрировано снижение выраженности ДДЛЖ у 32 пациентов основной группы, увеличение – в 7 случаях. Снижение выраженности ДДЛЖ выразилось в уменьшении пациентов с II и III типами дисфункции, полное восстановление диастолической функции – у 8 пациентов. В целом снижение степени тяжести ДДЛЖ составило 39%. В контрольной группе снижение выраженности ДДЛЖ выявлено у 12 пациентов, увеличение – у 8. В целом снижение степени тяжести ДДЛЖ составило 11%.
Динамика изменений обоих биомаркеров за период наблюдения представлена в табл. 6.
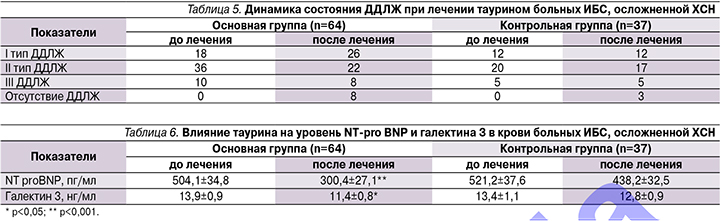
В группе пациентов, получавших таурин, среднее содержание NT proBNP в плазме составило 504,1±34,8 пг/мл (416–2189 пг/мл), в контрольной – 521,2±37,6 (422–3210 пг/мл). В основной группе снижение уровня NT proBNP на 32–870 пг/мл зарегистрировано у 42 (66%), повышение на 30–1042 пг/мл у 14 (22%) пациентов. В среднем по группе снижение NT proBNP cоставило 40,4%, что является высокодостоверным изменением (р<0,001). В контрольной группе к концу лечения уменьшение уровня NT proBNP на 38–986 пг/мл зарегистрировано у 18 (49%), повышение на 58–2566 пг/мл – у 10 (27%) пациентов. В среднем по группе содержание NT proBNP также уменьшилось на 16%, но такая динамика была недостоверной (р=0,064).
Повышенная концентрация галектина 3 в крови пациентов основной группы до начала лечения выявлена в 49 (76%), нормальная – в 15 (24%) случаях, составив в среднем по группе 13,9±0,9 нг/мл (4,9–29,8 нг/мл). К концу периода наблюдения выявлено достоверное снижение уровня галектина 3 до 11,4±0,8 нг/мл (р<0,05). Повышение концентрации галектина 3 на 0,5–2,3 нг/мл выявлено у 8 человек.
Обсуждение
Эффективность использования таурина для лечения ХСН не вызывает сомнений, что обусловлено способностью препарата уменьшать ишемию и гипоксию тканей, расстройства микроциркуляции, снижать уровень артериального давления, оказывать положительное инотропное действие [14]. Во многих исследованиях отмечено уменьшение акроцианоза, одышки, влажных хрипов в легких, периферических отеков при лечении таурином на фоне стандартной медикаментозной терапии больных недостаточностью кровообращения [15, 16].
В нашей работе в группе больных, получавших таурин, было отмечено улучшение клинического состояния у большинства пациентов, что проявлялось в уменьшении одышки, утомляемости и сердцебиения при физической нагрузке у 64% пациентов и в достоверном снижении суммы баллов по ШОКС. В контрольной группе подобные клинические изменения зарегистрированы у 35% пациентов, а уменьшение суммы баллов по ШОКС в среднем по группе было недостоверным – на 8,2% (р>0,05). Близкие результаты были получены в работе И.Г. Гордеева и соавт. (2012) у больных постинфарктным кардиосклерозом с ХСН II–III ФК и сниженной фракцией выброса после 3-месячного приема таурина в дозе 750 мг/сут [17].
За период наблюдения были госпитализированы 6 (9%) пациентов основной группы и 7 (19%) – контрольной. Декомпенсация ХСН в качестве причины госпитализации в основной группе пациентов отмечена у трех больных, что составило 4,7%, в то время как в контрольной группе – 16,2%. Мы оценили летальность в обеих группах и не получили статистической разницы. Смерть от всех причин в основной группе составила 4,7%, в контрольной – 5,4%. Полученные результаты свидетельствуют о положительном влиянии таурина на клиническое течение ХСН за счет уменьшения повторных госпитализаций в связи с декомпенсацией ХСН и улучшением среднеотдаленного прогноза у больных ИБС с II–III ФК ХСН.
Динамика размеров камер сердца и систолической функции левого желудочка у больных ХСН на фоне приема таурина изучалась во многих работах. При ЭХО-КГ отмечали уменьшение конечного диастолического и систолического объемов левого желудочка, увеличение фракции выброса у больных с исходной фракцией выброса <45%. В исследовании Э.М. Седовой и О.В. Магницкой (2010) таурин в дозе 1 г/сут в течение месяца получали женщины в перименопаузе с ХСН II–III ФК. Исходная величина фракции выброса авторами не приводится, но отмечено ее статистически значимое возрастание на 6,6% [18]. У больных пожилого и старческого возраста с застойной недостаточностью кровообращения I–III стадий, принимавших таурин в такой же дозировке в течение месяца, также отмечено достоверное увеличение фракции выброса с 43 до 51% [19]. В нашем исследовании не получено достоверных изменений размеров левого предсердия, систолодиастолического размера левого желудочка и фракции выброса как в основной, так и в контрольной группах. По-видимому, это обусловлено исходно высоким значением фракции выброса и нормальными объемами левого желудочка, что не позволяет полностью реализоваться положительному инотропному эффекту препарата.
Известно, что значительная роль в патогенезе ХСН принадлежит нарушению диастолической функции миокарда левого желудочка, которая наблюдается у больных с сохраненной и сниженной фракцией выброса [20]. В нашей работе у всех пациентов основной и контрольной групп регистрировалась ДДЛЖ I–III типов как критерий включения в исследование. На фоне приема таурина отмечена полная нормализация диастолической функции у 8 из 18 пациентов с I типом ДДЛЖ. В основной группе на 39% снизилось число пациентов с II типом ДДЛЖ с увеличением на 44% пациентов с I типом. Также зарегистрировано снижение числа больных с III типом ДДЛЖ.
Возможное влияние таурина на диастолическую функцию миокарда подробно изучалось в эксперименте. В исследованиях на крысах, кошках изучали влияние курсового применения таурина при различных моделях сердечной недостаточности. Анализ ЭХО-КГ-показателей позволил сделать вывод об улучшении диастолической функции миокарда (уменьшение IVRT – времени изоволюметрического расслабления левого желудочка) на фоне положительного инотропного эффекта препарата [21]. Механизм подобных эффектов таурина сложен и складывается из его способности нормализовать содержание электролитов в кардиомиоцитах, а также антиоксидантного и мембраностабилизирующего действия, антиишемического эффекта, способности улучшать эндотелиальную функцию сосудов за счет увеличения продукции оксида азота и простагландинов с вазодилатирующим эффектом, снижения содержания и нежелательных эффектов провоспалительных цитокинов [22, 23]. Кроме того, таурин обладает свойством нивелировать эффекты ангиотензина II, что уменьшает постнагрузку на миокард и патологическое ремоделирование сердца, уменьшает ДДЛЖ и препятствует падению систолической функции миокарда левого желудочка [24]. Мы не нашли в доступной иностранной литературе оценки влияния таурина на диастолическую функцию сердца у больных. В России в исследовании Г.И. Нечаевой и соавт. (2011) диастолическую функцию сердца и влияние на нее 4-месячного приема препарата в дозе 1 г/сут изучали на 40 больных сахарным диабетом, имевших симптомы ХСН I–II ФК и ДДЛЖ I типа. В группе получавших таурин отмечено достоверное повышение в среднем по группе отношения Е/А на фоне снижения IVRT, что свидетельствовало об уменьшении нарушений диастолической функции сердца. Было зарегистрировано достоверное снижение частоты регистрации ДДЛЖ в основной группе [25]. В работе М.Е. Стаценко и соавт. (2015) также выявлено подобное влияние препарата на состояние диастолической функции сердца [26].
В нашем исследовании оценивались возможные изменения концентрации пептида NT-proBNP, который является общепризнанным показателем для диагностики сердечной недостаточности и контроля эффективности проводимой терапии [27]. Была получена сходная динамика уровня NT-proBNP в обеих группах, которая выражалась в снижении содержания биомаркера в крови к концу периода наблюдения.
В основной группе снижение наблюдалось у 42 пациентов, повышение – у 14, что привело к достоверному уменьшению величины биомаркера в среднем по группе на 40%. При сопоставлении динамики клинических проявлений и ФК ХСН с концентрацией NT-proBNP в основной группе были получены следующие результаты: уменьшение или полное исчезновение симптомов (одышки и сердцебиения при физической нагрузке и др.) зарегистрировано у 64% пациентов, уменьшение ФК ХСН – у 56%, снижение уровня NT-proBNP – у 66% пациентов, что подтверждает благоприятный эффект добавления таурина к стандартной терапии ХСН у больных ИБС.
В нашей работе изучалось содержание в крови галектина 3, биомаркера, который, по мнению большинства исследователей, позволяет оценивать прогноз у больных ХСН, но в силу своей стабильности не служит в качестве контроля проводимого лечения [28]. В то же время появились работы, демонстрировавшие снижение концентрации биомаркера при эффективном лечении ХСН ингибиторами ангиотензинпревращающего фермента [29]. До начала лечения мы зарегистрировали повышенные цифры галектина 3 у 49 больных основной группы. Прием препарата в течение 12 месяцев сопровождался достоверным снижением уровня биомаркера в среднем по группе на 18%. Подобная положительная динамика концентрации галектина 3 в крови не привела к уменьшению летальности пациентов в течение года наблюдения, но сопровождалась снижением частоты госпитализаций по сравнению с контрольной группой.
Таким образом, полученные результаты доказывают безопасность использования таурина в комплексном лечении больных ХСН с сохраненной фракцией выброса на фоне ИБС. Дополнительное назначение препарата уменьшает клинические проявления сердечной недостаточности, повышает толерантность к физической нагрузке, снижает частоту повторных госпитализаций в связи с декомпенсацией сердечной недостаточности и не влияет на общую летальность пациентов. Таурин не оказывает положительного влияния на показатели глобальной сократимости левого желудочка, но достоверно уменьшает степень диастолической дисфункции миокарда и снижает концентрацию в крови галектина 3, что может свидетельствовать о замедле-нии патологического ремоделирования сердца.



