Редкая статья, посвященная проблематике анемий у пациентов с хронической сердечной недостаточностью (ХСН), не начинается с констатации того факта, что анемия является довольно распространенным состоянием среди этих больных и ухудшает их выживаемость. Далее, как правило, следует вывод о том, что нормализация уровня гемоглобина (Hb) у данной категории пациентов должна благоприятно сказываться на их прогнозе, что требует разработки методов лечения анемического синдрома при ХСН. На этом единодушие авторов заканчивается.
Разнятся даже данные о том, насколько распространенным является анемический синдром среди пациентов с ХСН. В зависимости от используемых критериев и особенностей исследуемых популяций приводятся цифры от 5 до 50 % и даже более. По данным эпидемиологических исследований, распространенность анемии среди пациентов с ХСН достигает 42,6 % [1]. Среди наиболее тяжелых больных ХСН IV функционального класса распространенность анемического синдрома достигает 79,1 % [2]. По данным мета-анализа 34 исследований, включивших более 150 тыс. пациентов, анемия встречается среди 37,2 % больных ХСН и ассоциирована с высоким риском смерти (отношение шансов [ОШ] = 1,96; 95 % доверительный интервал [ДИ] – 1,74–2,21) [3]. Однако не вполне ясно, является ли анемия сама по себе неблагоприятным прогностическим фактором, или отражает степень прогрессирования или декомпенсации ХСН. Если снижение уровня Hb происходит по мере прогрессирования ХСН, то определение прогностической значимости этого феномена не вполне корректно в отрыве от стадии заболевания, ведь прогноз необратимого и проградиентного состояния, каким безусловно является ХСН, в первую очередь определяется его стадией и только потом неизбежно возникающими по мере прогрессирования ХСН лабораторными и инструментальными отклонениями.
Пациентам с анемией свойственны бoльшая выраженность симптомов ХСН, снижение пикового потребления кислорода [4], повышение уровней С-реактивного белка и BNP (brain natriuretic peptide) [5], нарушение функции почек и снижение уровня альбумина [4, 5].
В качестве возможных причин снижения уровня Hb у пациентов с ХСН рассматриваются нарушения функции почек (кардиоренальный анемический синдром), гемодилюция, дефицит железа, связанный с хронической кровопотерей на фоне приема антитромботических препаратов, прием ингибиторов ангиотензинпревращающего фермента (ИАПФ) и антагонистов рецепторов ангиотензина II (АРА), активация провоспалительных цитокинов и связанная с ней дисфункция костного мозга [6].
Ряд работ свидетельствует о существенном вкладе гемодилюции в снижение уровня Hb у пациентов с ХСН. В исследовании A.S. Androne истинная анемия была выявлена лишь среди 54 % пациентов, в остальных случаях имела место гемодилюция, доказанная с помощью меченого 131I альбумина, причем в группе пациентов с гемодилюцией показана худшая выживаемость [7]. Кстати, в данном исследовании в группе больных с гемодилюцией уровень гематокрита (Ht) оказался достоверно выше (35,4 ± 4 против 32,8 ± 4 %; р < 0,05), чем у пациентов с истинной анемией. В другом исследовании продемонстрировано отсутствие достоверных различий в объеме циркулирующих эритроцитов (измеренном с помощью 51Cr) у пациентов с нормальным и сниженным уровнем Hb. Следует отметить, что критериями исключения из этого исследования являлись клинические признаки задержки жидкости (отеки, набухание шейных вен). При проведении многофакторного регрессионного анализа авторы установили, что наиболее мощным предиктором снижения уровня Hb является увеличение объема циркулирующей плазмы [8].
В нашей работе (В.А. Сулимов, Д.А. Напалков, А.С. Панферов, 2009) мы изучали вклад гемодилюции в снижение уровня Hb у пациентов с ХСН. Оказалось, что на фоне терапии, проводимой в соответствии со стандартами, но без применения препаратов, стимулирующих эритропоэз, достоверно увеличиваются показатели Hb и Ht (динамика в среднем за 12 дней; см. таблицу).
Для уменьшения вероятности переоценки осмолярности плазмы нам потребовалось исключить из анализа пациентов с сахарным диабетом и гиперлипидемией (уровень общего белка ни у одного из обследованных пациентов не был повышен). В результате у больных анемией осмолярность плазмы, медиана которой составляла 287 мосм/л, оказалась достоверно ниже, чем у пациентов с нормальным уровнем Hb: медиана – 297 мосм/л (р = 0,002). У всех пациентов со сниженной осмолярностью плазмы (менее 285 мосм/л) уровень Hb оказался сниженным, у лиц с нормальной и повышенной осмолярностью уровень Hb был снижен лишь в 40 % случаев, данные различия оказались достоверными (р = 0,003). Уровень осмолярности плазмы коррелировал с уровнями Hb (ρ = 0,581; р < 0,001) и Ht (ρ = 0,539; р < 0,001).
Уровень альбумина у пациентов со сниженной осмолярностью плазмы также был достоверно ниже, чем у пациентов с нормальной осмолярностью (3,32 против 4,13 г/дл; р < 0,001), что позволяет рассматривать снижение уровня альбумина на фоне снижения уровня Hb дополнительным указанием на необходимость исключения гемодилюции как возможной причины анемии.
В ряде исследований имеются указания на высокую распространенность нарушений обмена железа у пациентов с ХСН [8, 9]. При этом признаки дефицита железа (снижение уровня ферритина, сатурации трансферрина, повышение уровня растворимых рецепторов трансферрина) наблюдаются у пациентов не только со сниженным, но и с нормальным уровнем Hb; у 73 % пациентов с ХСН отмечается снижение запасов железа в костном мозге [10].
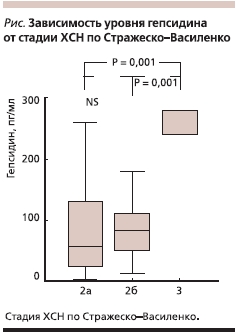
В последнее время при обсуждении особенностей обмена железа и патогенеза анемий при хронических заболеваниях много внимания уделяется гепсидину – острофазовому белку со свойствами регулятора обмена железа в организме, блокирующему транспорт железа в различных тканях (в т. ч. в энтероцитах и макрофагах). Синтез гепсидина усиливается при воспалении (под влиянием интерлейкина-6) и в условиях перегрузки железом. Повышение содержания гепсидина сопровождается снижением всасывания железа в тонкой кишке, его секвестрацией в макрофагах, что может приводить к функциональному дефициту железа и развитию резистентности к препаратам, стимулирующим эритропоэз [21]. В литературе имеются указания на повышение уровня гепсидина у пациентов с кардиоренальным анемическим синдромом [11]. Мы также обнаружили повышение уровня гепсидина по мере прогрессирования ХСН [12]. Вполне вероятно, что выявляемые признаки дефицита железа являются вторичными по отношению к повышению уровня гепсидина у пациентов с ХСН, и назначение препаратов железа для коррекции анемии в таком случае не является патогенетически оправданным, однако этот вопрос требует дальнейшего изучения. Тем не менее в нашей работе была продемонстрирована тенденция к увеличению уровня гепсидина в крови у пациентов с ХСН по мере ее прогрессирования (см. рисунок).
Тесная связь заболеваний сердечно-сосудистой системы и почек, особенно выраженная в последних их стадиях при формировании сердечной и почечной недостаточности, возможность развития анемии, которая в свою очередь способствует ускорению темпов их прогрессирования, позволяют объединить все три состояния в понятие “кардиоренальный анемический синдром”. Считается, что гипоперфузия почек у пациентов с ХСН может приводить к снижению уровня эритропоэтина и таким образом способствовать развитию анемии. Однако уровень эритропоэтина у пациентов с ХСН не всегда оказывается сниженным. В ряде исследований продемонстрировано увеличение содержания эритропоэтина у больных с более высоким функциональным классом сердечной недостаточности, причем его уровень коррелирует с уровнем BNP, а не с фракцией выброса левого желудочка [24]. При этом повышенный уровень эритропоэтина ассоциирован с неблагоприятным прогнозом [24, 25].
Особого внимания заслуживает вопрос о возможности развития анемии на фоне применения ИАПФ и АРА – препаратов первой линии, используемых при лечении ХСН в настоящее время. В результате анализа базы данных исследования SOLVD (Studies Of Left Ventricular Dysfunction) выяснилось, что прием эналаприла увеличивал риск развития анемии в течение года на 56 % (ОШ = 1,56; 95 % ДИ – 1,26–1,93) [13]. При анализе базы данных исследования Val-HeFT показано, что прием валсартана сопровождался достоверно бoльшим снижением уровня Hb по сравнению с плацебо на протяжении всего периода наблюдения [14].
Механизмы угнетения кроветворения средствами, влияющими на ренин-ангиотензин-альдостероновую систему, до конца не изучены. Продемонстрировано стимулирующее влияние ангиотензина II на пролиферацию наиболее ранних предшественников эритропоэза [15], причем стимулирующий эффект наблюдался только в присутствии эритропоэтина и нивелировался в присутствии лозартана. О возможном участии ангиотензина II в регуляции метаболизма железа свидетельствует увеличение экспрессии мРНК рецепторов трансферрина, дивалентного металлотранспортера, ферропортина и гепсидина в почках крыс под воздействием инфузии ангиотензина II, а также нивелирование этого эффекта под действием лозартана [16]. ИАПФ в дополнение к вышеизложенным механизмам влияния на кроветворение способны увеличивать содержание естественного ингибитора гемопоэза N-ацетил-серил-аспартиллизил-пролила (AcSDKP), т. к. под их влиянием полностью блокируется его распад [17].
В исследовании с участием здоровых добровольцев было продемонстрировано достоверное увеличение концентрации AcSDKP после приема 50 мг каптоприла по сравнению с плацебо [18]. В другом исследовании у пациентов с ХСН и анемией, принимавших ИАПФ, продемонстрирована достоверно меньшая активность АПФ сыворотки по сравнению с таковым у больных ХСН, сопоставимых по возрасту и фракции выброса, но с нормальным уровнем Hb. Уровень AcSDKP у пациентов с ХСН и анемией был достоверно выше, чем у больных без анемии [19]. Данные о влиянии ИАПФ и АРА на уровень эритропоэтина противоречивы.
Необходимо также упомянуть о возможном влиянии β-адреноблокаторов на эритропоэз. По данным исследования COMET (Carvedilol Or Metoprolol eEropean Trial), прием карведилола приводил к небольшому, но достоверному снижению уровня Hb по сравнению с метопролола тартратом, что, вероятно, связано с блокадой β2-адренорецепторов клеток юкстагломерулярного аппарата, приводящей к снижению выработки эритропоэтина, а также с блокадой β2-адренорецепторов клеток эритроидного ряда [20]. Аналогичные результаты получены при сравнении карведилола с плацебо в исследованиях COPERNICUS и CHRISTMAS (неопубликованные данные по [20]).
Поскольку наличие анемии у пациентов с ХСН сопровождается ухудшением прогноза, вероятно, нормализация уровня Hb должна сопровождаться улучшением показателей выживаемости. Очевидно, что многообразие причин, приводящих к снижению уровня Hb у пациентов с ХСН, делает затруднительным выбор лечебной тактики в каждом конкретном случае. К настоящему времени в качестве возможных методов лечения анемии у пациентов с ХСН рассматривается применение препаратов железа (преимущественно внутривенно), препаратов эритропоэтина и их сочетание.
По данным исследования FAIRHF (Ferinject Assessment in Patients With IRon Deficiency and Chronic Heart Failure), внутривенное введение карбоксимальтозного железа независимо от исходного уровня Hb сопровождалось субъективным улучшением, уменьшением функционального класса ХСН, увеличением дистанции 6-минутной ходьбы и улучшением качества жизни по сравнению с плацебо. При этом частота смертей и побочных эффектов в обеих группах не различалась [22]. В многоцентровом исследовании IRON-HF (Ferinject Assessment in Patients With Iron Deficiency and Chronic Heart Failure) сравнивают эффективность и безопасность препаратов железа при внутривенном и энтеральном введении железа для коррекции железо-дефицитной анемии у пациентов с ХСН; его результаты пока не опубликованы.
По данным мета-анализа 11 рандомизированных клинических исследований (794 наблюдения), в которых изучали эффекты от применения препаратов, стимулирующих эритропоэз (эпоэтина α, β, дарбэпоэтина) у больных ХСН, лечение препаратами эритропоэтина сопровождается увеличением дистанции 6-минутной ходьбы, пикового потребления кислорода, фракции выброса, уменьшением уровня BNP, функционального класса ХСН и частоты госпитализаций по поводу ХСН, а также улучшением качества жизни. Что касается влияния терапии этими препаратами на выживаемость, то полученные данные не позволяют уверенно говорить о наличии подобного эффекта (OШ для общей смертности – 0,58, 95 % ДИ – 0,34–0,99; p = 0,047) [26]. Скорее всего, вопрос о влиянии терапии препаратами эритропоэтина на выживаемость пациентов с анемией и ХСН прояснится после публикации результатов исследования RED-HF (Reduction of Events with Darbepoetin alfa in Heart Failure) [23].
По-видимому, прогрессированию ХСН свойственно снижение уровня Hb, т. к. с усугублением тяжести течения ХСН возникает для этого больше патофизиологических предпосылок; следовательно, прогностическая значимость анемий у таких пациентов должна определяться в ассоциации со стадией ХСН. Нарушения обмена железа играют важную роль в патогенезе анемий у пациентов с ХСН. При этом для них характерны изменения показателей обмена железа, присущие не только железодефицитным анемиям, но и анемиям хронических заболеваний. Нам представляется не вполне оправданным назначение препаратов железа больным ХСН, исходя только из уровней ферритина и сатурации трансферрина, т. к. эти показатели не в полной мере отражают изменения метаболизма железа, и их уменьшение не всегда свидетельствует о том, что кроветворение является железодефицитным. На наш взгляд, перспективным направлением изучения патогенеза анемий у пациентов с ХСН является более детальное выяснение изменений уровня гепсидина, особенно причин, приводящих к повышению его уровня у данных больных, а также возможностей медикаментозной коррекции его уровня.
Известно, что важную роль в регуляции синтеза эритропоэтина играет кислородчувствительный протеиновый комплекс, обладающий транскрипционной активностью, – фактор, индуцированный гипоксией (hypoxia inducible factor – HIF). Поскольку около 90 % эритропоэтина синтезируется в эндотелиоцитах перитубулярных капилляров, низкие или нормальные значения его содержания в сыворотке крови на фоне повышенного содержания HIF, вероятно, могут свидетельствовать о нарушении функции почек у пациентов с ХСН. Перспективной может оказаться возможность более аргументированного определения показаний к назначению препаратов рекомбинантного человеческого эритропоэтина, исходя из параллельного определения уровней HIF и эритропоэтина.
Как указывалось выше, причины снижения уровня Hb у пациентов с ХСН многочисленны и разнообразны. Вероятно, требуется разработка алгоритма диагностики причин развития анемии у пациентов с ХСН и выделения одного или нескольких факторов, вносящих наибольший вклад в развитие анемии в каждом конкретном случае. Возможно, такой подход позволит улучшить не только результаты лечения анемического синдрома, но и прогноз в отношении жизни этой категории больных. Современные подходы к лечению истинных железодефицитных анемий включают следующие принципы:
1. Этиологическое лечение железодефицита позволит предотвратить прогрессирование анемии, однако вне зависимости от установления причины анемии пациенты должны получать ферротерапию для коррекции анемии и увеличения запасов железа в организме (уровень доказательности В).
2. Парентеральные формы железа могут применяться при плохой переносимости пероральной терапии или плохой приверженности лечения таблетированным формам железа. Предпочтителен внутривенный путь введения, однако иногда возможно также внутримышечное введение препаратов.
3. Гемотрансфузии показаны пациентам, имеющим высокий сердечно-сосудистый риск из-за степени выраженности их анемии (уровень доказательности С). После проведения гемотрансфузии показана традиционная ферротерапия для восполнения резервов железа в организме.
В исследовании Anker S. et al. [27] 459 пациентов с ХСН, имевшим II–III ФК по NYHA, снижение фракции выброса левого желудочка менее 40–45 % и уровень Hb 95–135 г/л при уровне ферритина < 100 мкг/л или 100–199 мкг/л (при сатурации трансферрина < 20 %) были распределены на 2 группы: группа плацебо и группа активной терапии железа карбоксимальтозатом 200 мг. Железа карбоксимальтозат вводился внутривенно в виде болюсной инъекции 1 раз в неделю до достижения нормальных значений гемоглобина, а затем 1 раз в месяц в качестве поддерживающей дозы на протяжении 1 года. В группе ферротерапии было отмечено улучшение исходных показателей 6-минутного теста с ходьбой и качества жизни, число пациентов с ХСН с I–II ФК по NYHA по результатам лечения составило 50%, в то время как в группе плацебо – лишь 28 %. Частота летальных исходов и серьезных нежелательных явлений была сопоставимой в обеих группах.
Таким образом, железа карбоксимальтозат (препарат “Феринъект”) улучшает качество жизни и уменьшает симптомы сердечной недостаточности у пациентов с ХСН и может рекомендоваться в качестве дополнительной терапии пациентам с развившимся анемическим синдромом на фоне ХСН.



