Результаты крупных международных клинических исследований, проведенных за последние десятилетия, значительно расширили научные знания о патогенетических особенностях сахарного диабета (СД). Главным достижением этого периода в диабетологии является определение основных направлений в совершенствовании диагностики заболевания и профилактики его осложнений [1]. Было продемонстрировано, что адекватный контроль показателя гликированного гемоглобина (HbA1c) достоверно снижает риски микрососудистых осложнений и фатальных сердечно-сосудистых событий у пациентов с СД 1 и 2 типов – СД1 и СД2 [2]. Таким образом, последние два десятилетия в диабетологии можно назвать эпохой HbA1с, когда этот показатель во всех ведущих мировых алгоритмах и рекомендациях прочно занял место стандарта в оценке гликемического контроля, риска развития и прогрессирования осложнений диабета, стал новым диагностическим маркером заболевания, а также критерием эффективности при регистрации сахароснижающих препаратов в FDA – Food and Drug Administration [2]. Таким образом, основная стратегия управления СД в настоящее время направлена на достижение целевых показателей уровня HbA1c. Тем не менее в некоторых исследованиях было отмечено, что даже достижение целевого уровня HbA1c не всегда позволяет констатировать позитивные результаты, особенно для пациентов с длительным анамнезом заболевания [3, 4]. Одной из возможных причин служит то, что существующий подход к оценке эффективности лечения по уровню HbA1c предполагает контроль среднего уровня гликемии, но не учитывает размаха и частоты ее колебаний. По результатам исследования E. Bonora и соавт. группы пациентов с СД2, было выявлено, что даже при уровне HbA1c менее 7% около 80% пациентов имели уровень постпрандиальной гликемии (ППГ; через 2 часа после одного из приемов пищи) 8,9 ммоль/л [5]. Из этого следует, что, несмотря на признание HbA1c текущим «золотым» стандартом определения качества гликемического контроля, есть необходимость в четком представлении, какие еще показатели гликемии могут обеспечить столь необходимые дополнительные клинические цели. Таким образом, одной из приоритетных задач остается совершенствование методов оценки качества гликемического контроля и прогнозирования риска сосудистых осложнений у больных СД [3].
За последние годы все большую актуальность получает феномен гликемической изменчивости как самостоятельного предиктора осложнений СД. Некоторые авторы предлагают рассматривать вариабельность гликемии (ВГ) как среднюю амплитуду колебаний гликемии (САКГ) от максимальных значений до минимальных в течение выбранного промежутка времени, однако полное определение данного понятия включает не только САКГ, но и частоту и скорость изменений концентрации глюкозы в крови в течение определенного временнóго периода [6]. Термин ВГ получил особую популярность после внедрения в рутинную практику глюкометров, обеспечивших возможность самоконтроля уровня глюкозы и систем непрерывного мониторирования глюкозы (НМГ). В исследовании R. Derr и соавт. было проанализировано наличие связи между ВГ и уровнями HbA1с, в результате продемонстрирована корреляция между средним уровнями глюкозы крови и HbA1c, однако корреляции между уровнями HbA1c и ВГ не установлено [7]. Следовательно, уровень HbA1c отражает среднюю концентрацию глюкозы крови на длительном промежутке времени и существенно не изменяется при текущей нестабильности гликемии. Предполагают, что влияние ВГ на поражение сосудов опосредуется через стимуляцию окислительного стресса (ОС) [8–10]. Оценив содержание 8-изо-простагландина F2α (8-iso-PGF2α) в моче, L. Monnier и соавт. показали, что этот основной маркер ОС у больных СД2 сильно коррелирует с ВГ, но не с хронической гипергликемией [9]. Авторы другого исследования также обнаружили, что у пациентов с СД2 резкие колебания глюкозы были связаны с увеличением маркеров ОС и оказывали более разрушительное, чем стабильно высокий уровень глюкозы. действие на функцию эндотелия [11]. В то же время определенная группа исследователей в эксперименте не смогли подтвердить результаты L. Monnier и соавт., несмотря на большее число участников и схожий дизайн [12]. Точный механизм, через который высокая ВГ индуцирует ОС, остается не до конца изученным. Вероятно, вклад ВГ в развитие ОС определяется возрастом обследуемых, а также наличием и типом СД [12]. Кроме того, определение самой гликемической нестабильности представляет некоторые трудности, прежде всего из-за сложности в измерении и отсутствия четкого консенсуса в отношении оптимального подхода к ее управлению. Лучший и наиболее точный способ оценки ВГ по-прежнему обсуждается. С учетом тенденции современной диабетологии очень интересно рассмотреть различные аргументы как «за», так и «против» гипотезы, согласно которой ВГ вносит, возможно, наибольший вклад в развитие и прогрессирование СД и должна стать новым стандартом оценки управления заболеванием.
Одним из основных фактов в пользу этой гипотезы послужило следующее наблюдение: у пациентов как с СД, так и с нарушением толерантности к глюкозе уровень гликемии через 2 часа после перорального введения глюкозы имеет более высокую прогностическую ценность в плане развития сердечно-сосудистых событий, чем уровень глюкозы в крови натощак [13]. В крупных эпидемиологических исследованиях была выявлена ассоциация между ППГ и атеросклерозом [13, 14]. Подтверждение того, что уровень ППГ имеет более существенное влияние на возникновение сердечно-сосудистых осложнений (ССО), было ярко продемонстрировано в результате многоцентрового проспективного исследования STOP-NIDDM с участием 40 центров из 9 стран мира [15], целью которого было изучить возможное влияние контроля гликемии на риск развития СД и ССО у лиц с нарушением толерантности к глюкозе. Через 3 года исследования частота развития СД среди лиц, получавших терапию, была на 25% меньше по сравнению с группой плацебо, а суммарный показатель сердечно-сосудистых событий снизился на 49% [15]. Однако в другом исследовании, HEART2D, целью которого также была коррекция именно ППГ (и тем самым снижение ВГ), подобного результата не зафиксировали [16].
Анализ данных исследования DCCT (Diabetes Control and Complication Trial) показал связь долгосрочной ВГ, определенной по изменениям уровня HbA1c, с риском развития микрососудистых осложнений. Вариабельность HbA1c определена у 1441 пациента с СД1, прогрессирование осложнений оценивали в течение 9 лет. Увеличение SD уровня HbA1c на 1% оказалось ассоциированным с повышением риска ретинопатии (отношение рисков – ОР=2,26; р<0,0001) и нефропатии (ОР=1,8; р<0,0001) [17], что позволило М. Brownlee и соавт. прийти к следующему заключению: ВГ может играть роль в генезе диабетических микроангиопатий [18]. Средний уровень HbA1c также являлся предиктором развития данных осложнений [19]. На риск развития диабетических микроангиопатий не оказывали влияния показатели ВГ, рассчитанные по результатам ежеквартального уровня пре- и ППГ в 7 точках. Таким образом, вклад краткосрочной ВГ в развитие микроангиопатий у пациентов, участвовавших в DCCT, не был доказан [19]. В проспективном наблюдательном исследовании Finnish Diabetic Nephropathy Study, включившем 2107 больных СД1, вариабельность HbA1c была ассоциирована с риском прогрессирования диабетической нефропатии (ОР=1,92; p<0,001) и сердечно-сосудистыми осложнениями (ОР=1,98; p<0,001). Данная ассоциация сохраняла значимость после учета среднего уровня HbA1c [20].
В другом проспективном наблюдательном исследовании (Verona Diabetes Study), включившем 1409 пациентов с СД2, гликемическая нестабильность оказалась независимым предиктором смерти от СД, ССО и рака в течение 10 лет наблюдения [21]. В недавно опубликованных научных обзорах продемонстрировано, что краткосрочная ВГ, оцененная по результатам НМГ, и в большей степени долгосрочная ВГ (изменения HbA1c) ассоциированы с развитием кардиальной автономной невропатии [22]. В то же время долгосрочная ВГ (оцененная по уровню SD и коэффициенту вариации HbA1c) ассоциирована с субклиническим атеросклерозом в большей степени, чем средний уровень HbA1c, особенно на ранних стадиях развития диабета [22].
Следует отметить, что в исследованиях последних лет появляется все больше данных, демонстрирующих важность минимизации ВГ. В систематическом обзоре о влиянии ВГ на развитие осложнений СД отмечено, что если в отношении СД1 ее роль дискутабельна, то при СД2 она имеет значительное влияние. Так, только в 2 из 8 исследований была отмечена статистически значимая связь между ВГ и развитием микрососудистых осложнений при СД1, в то время как при СД2 в 8 из 10 исследований выявлена отчетливая связь между ВГ и развитием как микро-, так и макрососудистых осложнений [8]. Значимость учета ВГ при планировании терапии СД2 подтверждают и другие авторы [23, 24]. Между тем в части публикаций постулировалось, что ВГ не оказывает существенного влияния на риск микрососудистых осложнений, но, так же как и ППГ, связана с риском макрососудистых осложнений при СД2 [25]. В нескольких исследованиях определили значимые связи между ВГ и известными факторами риска атеросклероза (толщина комплекса интима-медиа каротидных артерий и эндотелий-зависимая вазодилатация плечевой артерии) и предположили, что высокая ВГ может способствовать развитию атеросклероза при СД2 независимо от других факторов риска [26, 27]. В одном из исследований, включившем 344 пациента с СД2, оценивалась средняя амплитуда колебаний гликемии (параметр MAGE – mean amplitude of glycemic excursions) и MAGE>3,4 ммоль/л была независимым предиктором развития коронарного атеросклероза, в то время как уровень HbA1c не оказывал статистически значимого влияния [27]. При этом ВГ была одним из факторов, детерминировавших тяжесть коронарного атеросклероза по данным коронарографии [27]. X. Zhang и соавт. также продемонстрировали, что гликемическую нестабильность следует рассматривать как фактор риска при прогнозировании ишемической болезни сердца (ИБС) и прогрессирования заболевания. Повышение частоты больших кардиальных событий (повторный инфаркт миокарда – ИМ, острая сердечная недостаточность, кардиальная смерть) после перенесенного ИМ отмечено у 233 больных СД2 с высокой ВГ (MAGE больше 3,9 ммоль/л) [28]. Некоторые исследователи пришли к следующему заключению: ВГ является значимым предиктором смертности среди пациентов в критическом состоянии независимо от средней гликемии и тяжести болезни [29]. Большой интерес представляют данные, полученные при исследовании параметров гликемии у пациентов в отделении интенсивной терапии, согласно которым острые гипергликемические пики ассоциированы с худшим прогнозом как в когорте больных СД, так и в группе без диабета [30]. Существуют достоверные данные и о влиянии гликемической изменчивости на прогрессирование микрососудистых осложнений. Так, например, продемонстрирована достоверная корреляция ВГ и риска диабетической ретинопатии, причем у пациентов как с СД2, так и СД1, а в исследовании S.M. Jin и соавт. была обнаружена значительная связь между высокими показателями ВГ и экскрецией альбумина с мочой [31, 32]. Несколько лет назад обнаружено, что показатели кардиоваскулярной смертности, а также смертности от всех причин среди пожилых людей с СД2 связаны в первую очередь с нестабильностью и изменчивостью гликемии натощак и уже после – с ее абсолютными значениями [33].
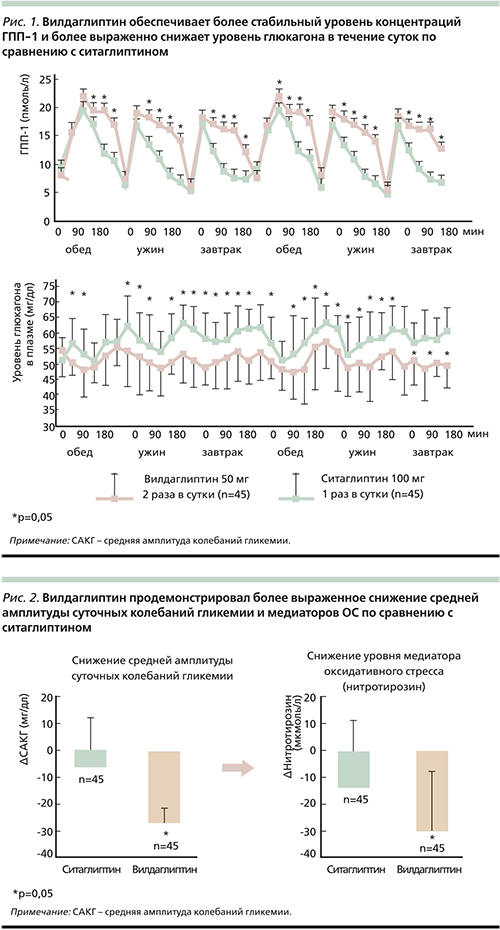
Все эти результаты провоцируют активные дебаты в научном сообществе. Накопленные к настоящему времени данные дают основания предполагать, что использование параметров гликемии в совокупности с уровнем НbA1с и другими традиционными факторами риска способно повышать точность прогноза развития сосудистых осложнений и гипогликемий. Оценка ВГ является наиболее перспективным подходом к оценке эффективности управления СД, а снижение ВГ можно рассматривать как одну из важных терапевтических целей при лечении СД [34]. Соответственно, все больше внимания уделяется изучению влияния различных режимов сахароснижающей терапии на параметры гликемической изменчивости. В связи с этим следует уделить пристальное внимание препаратам группы ингибиторов дипептидилпептидазы-4 (иДПП-4), главной особенностью действия которых является глюкозозависимое влияние на функцию β- и α-клеток поджелудочной железы. В результате происходит регуляция ключевых расстройств, лежащих в основе глюкозотоксичности и ВГ. В многочисленных исследованиях изучено влияние препаратов из группы иДПП-4 не только на стандартные показатели гликемии, но и на ВГ у больных СД2. В сравнительном исследовании Y.L. He и соавт., изучавших влияние терапии вилдаглиптином (Галвус) и глимепиридом у больных СД2 (n=24), выявлено сравнимое уменьшение ППГ, по данным НМГ (на 15 и 16% соответственно), при этом терапия вилдаглиптином обеспечила более низкую ВГ, показатель MAGE был на 20% ниже на фоне применения препарата Галвус по сравнению с глимепиридом. Кроме того, вилдаглиптин обеспечил статистически значимое снижение изменения средней кривой и межквартильного диапазона глюкозы [35]. Важная информация была получена в исследовании R. Marfella и соавт., в котором проведено прямое сравнение двух наиболее изученных иДПП-4 – вилдаглиптина и ситаглиптина – с участием 38 пациентов с СД2 и неудовлетворительным контролем на монотерапии метформином (средняя суточная доза –3,0 г) [36]. Пациенты были рандомизированы в 2 группы лечения: в одной в добавление к терапии метформином назначался вилдаглиптин (50 мг 2 раза в сутки), в другой – ситаглиптин (100 мг/сут). Иходно и по окончании 3 месяцев терапии всем пациентам, включенным в исследование, проведено НМГ. Согласно опубликованным результатам, вилдаглиптин способствовал более выраженному снижению параметра MAGE по сравнению с ситаглиптином. Особо следует отметить, что достоверно бóльшая и постоянная суточная активность глюкагоноподобного пептида-1 (ГПП-1) также наблюдалась при добавлении к метформину вилдаглиптина. Более того, концентрация глюкагона в плазме крови оказалась значительно более низкой у пациентов, получавших Галвус [36.]. Подобные различия между иДПП-4 могут быть связаны как с особенностями взаимодействия с самой молекулой ДПП-4 (крепкое связывание субстрат-специфичного ингибитора вилдаглиптина обеспечивает более длительное ингибирование ДПП-4), так и с различной биодоступностью препаратов [37].
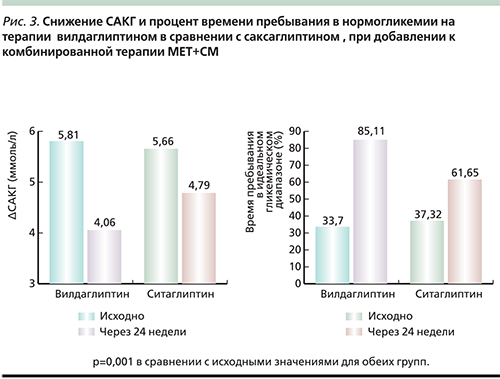
Позже были представлены результаты еще одного проспективного рандомизированного клинического исследования, направленного на изучение влияния суточных колебаний гликемии на уровень ОС [38]. Осуществлена оценка ОС (уровень нитротирозина), маркеров системного воспаления интерлейкина-6 (ИЛ-6), ИЛ-18 и средних колебаний глюкозы крови. Принято считать, что экскурсии глюкозы прямо коррелируют с концентрацией нитротирозина, который образуется с участием пероксинитрита – высокотоксичного соединения. Вследствие этого при значительных колебаниях САКГ значительно возрастает образование активного оксиданта пероксинитрина. Через 12 недель исследования установлено, что Галвус обеспечил не только статистически более значимое снижение показателя MAGE (до 2,5±0,89 ммоль/л), фактически до нормы, но и ассоциированное с ним снижение маркеров ОС – нитротирозина (-0,3±0,03 мкмоль/л) и воспаления – ИЛ-6 (-1,5±0,16 пг/мл) по сравнению с ситаглиптином; MAGE (-3,6±0,63 ммоль/л; p<0,01), нитротирозин (0,4±0,05 мкмоль/л; p<0,01), ИЛ-6 (-1,95±0,22 пг/мл; p<0,01) (рис. 1, 2) [38]. Можно констатировать, что применение вилдаглиптина обеспечивает более стабильный уровень глюкозы крови в течение суток за счет стабильной концентрации препарата в плазме, что сопровождается позитивным влиянием на маркеры свободнорадикальных процессов и воспаления [38]. Исследование R. Marfella и соавт. еще раз подтвердило, что устранение резких перепадов уровня глюкозы в течение суток эффективнее снижает уровень маркеров атеросклероза, чем только нормализация уровня HbA1c и гипергликемии натощак, а контроль избыточных колебаний уровня глюкозы в течение суток приносит существенную клиническую пользу пациентам с СД2.
В июне 2015 г. в рамках VIIV конгресса Американской диабетической ассоциации (ADA – American Diabetes Association) были продемонстрированы результаты 24-недельного исследования по сравнению с терапией вилдаглиптином и саксаглиптином при добавлении их к комбинированной терапии препаратами сульфонилмочевины (ПСМ)+метформин – Мет [39]. В группе вилдаглиптин+Мет+ПСМ отмечено более существенное снижение САКГ по сравнению с группой саксаглиптин+Мет+ПСМ (рис. 3). Также в группе вилдаглиптина зафиксирован более высокий процент времени пребывания в нормогликемии [39].
Необходимо дальнейшее проведение крупных клинических исследований как для укрепления доказательной базы оценки влияния контроля ВГ на развитие и прогрессирование микро- и макрососудистых осложнений, так и для поиска наиболее эффективных терапевтических инструментов регуляции гликемической изменчивости. Влияние различных режимов сахароснижающей терапии на ВГ еще предстоит оценить в крупных рандомизированных клинических исследованиях. Необходимо определить наиболее информативные показатели ВГ, пригодные для оценки качества контроля гликемии и риска осложнений в различных клинических ситуациях. Не следует забывать о том, что настоящих успехов в управлении СД позволит достичь только максимальная индивидуализация гликемического контроля и многофакторность подхода. Цель контроля не может быть стандартной для всех пациентов с СД, но для каждого пациента цель должна быть определена и персонифицирована.



