Сахарный диабет (СД) является самым распространенным эндокринным заболеванием, который приобретает характер «неинфекционной эпидемии» и характеризуется высокой частотой развития осложнений, инвалидизации и смертности в результате развития осложнений.
К основным причинам смерти пациентов с СД относятся сердечно-сосудистые заболевания.
 Эпидемиологический анализ данных по пациентам с первично-диагностированным СД 2 типа (СД2), полученный в одном из наиболее цитируемых исследований по диабету UKPDS (United Kingdom Prospective Diabetes Study), показал, что потенциально-модифицируемым фактором риска сердечно-сосудистых заболеваний и микроциркуляторных осложнений является повышенный уровень глюкозы [1].
Эпидемиологический анализ данных по пациентам с первично-диагностированным СД 2 типа (СД2), полученный в одном из наиболее цитируемых исследований по диабету UKPDS (United Kingdom Prospective Diabetes Study), показал, что потенциально-модифицируемым фактором риска сердечно-сосудистых заболеваний и микроциркуляторных осложнений является повышенный уровень глюкозы [1].
В многочисленных исследованиях, проведенных с участием пациентов с СД2, показано, что риск развития у них сердечно-сосудистых заболеваний может быть уменьшен путем снижения уровня гликированного гемоглобина – HbA1c [2, 3].
На сегодняшний день порядка 20% больных СД2 Москвы получают терапию с использованием препаратов инсулина и инсулиновых аналогов, но число пациентов, нуждающихся в препаратах инсулина, значительно больше, т.к. многие пациенты не достигают целевых значений HbA1c на терапии пероральными сахароснижающими препаратами (ПССП).
Современные рекомендации по сахароснижающей терапии содержат четкие цели терапии (индивидуальные целевые значения HbA1c), алгоритмы назначения и интенсификации инсулинотерапии [4], однако в реальной клинической практике этих целей часто не достигают, а алгоритмы не выполняются. До 25% пациентов отказываются от назначенной им инсулинотерапии [5], до 44%, уже получающих препараты инсулина, пропускают инъекции, что также способствует неудовлетворительному гликемическому контролю [6].
Дебют СД2, сопровождающийся повышением уровня HbA1c выше 9,0% и признаками декомпенсации, требует старта терапии с препаратов инсулина [4], однако в реальной клинической практике в данной ситуации назначают терапию с использованием ПССП, что приводит к преждевременному истощению собственной секреции инсулина и более раннему развитию осложнений диабета или неотложных состояний. Проведенное нами обсервационное исследование подтвердило, что препараты инсулина могут быть эффективно и безопасно применяться амбулаторно, а своевременное купирование глюкозотоксичности в ряде случаев может приводить к отмене назначенной инсулинотерапии с последующим сохранением компенсации углеводного обмена на фоне приема ПССП.
В недавнем прошлом пациенты, страдающие СД, были вынуждены вводить препараты инсулина с помощью инсулиновых шприцев, что сопровождалось значительными неудобствами (болезненность при инъекции; «боязнь инъекции» и связанные с этим дискомфорт и чувство беспокойства). Необходимость достаточно трудоемкого процесса набора дозы в шприц способствовала ошибкам при наборе дозы, особенно среди пожилых, что могло приводить к развитию осложнений инсулинотерапии, плохому контролю заболевания и в итоге к снижению социальной адаптации и качества жизни пациентов.
Преимущества новых средств для введения препаратов инсулина (инъекторов для введения инсулина или «шприц-ручек») заключаются в простоте использования, более свободном и гибком подходе к введению препаратов инсулина, что способствует улучшению приверженности лечению. Важно, чтобы врач и больной были уверены в точности шприц-ручки, ее удобстве и функциональности, поскольку данные характеристики важны для соблюдения пациентом всех рекомендаций и назначений по лечению диабета.
В данной наблюдательной программе для введения инсулина использовалась шприц-ручка БиоматикПен®, т.к. она была специально разработана для более удобного, простого и безопасного самостоятельного введения отечественных препаратов рекомбинантного инсулина человека Биосулин Р и Биосулин Н (Фармстандарт).
Ранняя поэтапная инициация и интенсификация сахароснижающей терапии, направленная на снижение риска гипогликемий, считается оптимальной стратегией лечения СД2 по соотношению эффективности и безопасности. Однако существует разрыв между оптимальными подходами к терапии, целесообразными с позиций доказательной медицины, и рутинной клинической практикой. С помощью проведения наблюдательных программ можно изучить возможности старта и интенсификации инсулинотерапии в условиях рутинного поликлинического наблюдения.
Одной из таких программ является исследование, которому посвящена данная статья, – открытая нерандомизированная наблюдательная программа по оценке эффективности и безопасности терапии Биосулином Р и Биосулином Н, проведенная в 2014–2015 гг. в Москве при участии врачей-эндокринологов.
 Целью исследования была оценка в реальных клинических условиях эффективности и безопасности применения инсулинов Биосулин Р и Биосулин Н у пациентов с СД2.
Целью исследования была оценка в реальных клинических условиях эффективности и безопасности применения инсулинов Биосулин Р и Биосулин Н у пациентов с СД2.
Материал и методы
В многоцентровом открытом нерандомизированном наблюдательном исследовании приняли участие 197 пациентов с СД2, из них 195 были доступны для наблюдения в течение 3 месяцев. В наблюдение включались пациенты, которым была необходима инициация или интенсификация инсулинотерапии.
Критерии включения:
- Пациенты от 18 до 80 лет с СД.
- Пациенты, не достигшие индивидуальных целевых значений гликемии и HbA1c на фоне терапии ПССП либо предшествующей терапии препаратами инсулина, либо пациенты с впервые выявленным СД2 и HbA1c>9,0%.
Протокол данного наблюдения был спланирован в соответствии с его основной целью – изучением препарата в условиях реальной клинической практики, что подразумевало максимально простой дизайн и отсутствие каких-либо специальных процедур, выходящих за рамки рутинной практики. Регистрировались демографические (пол, возраст) и антропометрические данные (рост, масса тела, индекс массы тела – ИМТ, объем талии), длительность СД. Специальные методы оценки диабетических осложнений не использовались. Наличие осложнений диабета (ретинопатии, невропатии, нефропатии, макроангиопатии) фиксировалось врачом на основании доступной из медицинских карт информации.
Период наблюдения составил 3 месяца и включал 3 визита с интервалом 1 и 2 месяца. На визите 1 осуществлялось включение пациентов, которым, согласно существующим клиническим рекомендациям, была необходима инициация или интенсификация инсулинотерапии, на визите 2 – титрование дозировок сахароснижающих препаратов, в первую очередь препаратов инсулина в зависимости от показателей гликемии, на визите 3 – итоговая оценка эффективности терапии.
Рекомендованные начальные дозы Биосулина Р и Биосулина Н составляли 1 МЕ на 10 кг массы тела пациента в сутки, если пациент не получал инсулин такого типа ранее либо от 80 до 120% от дозы ранее назначенного препарата прандиального или базального инсулина (или компонента комбинированного препарата инсулина) соответственно. Титрация доз инсулина проводилась, если достигнутый гликемический контроль не признавался удовлетворительным.
В качестве параметров гликемического контроля оценивались гликемия натощак (ГН) и постпрандиальная гликемия (ППГ), где ППГ – гликемия через 2 часа после завтрака или другого основного приема пищи. Согласно протоколу, определение уровня HbA1c не было обязательным и служило альтернативой измерению ГН/ППГ, однако данный показатель регистрировался, если выполнялся в рамках рутинного обследования пациентов вне связи с исследованием в течение месяца до включения и в течение месяца до последнего визита.
Критерии оценки эффективности терапии:
Динамика показателей ГН и ППГ, а также уровня HbA1c в течение всего периода наблюдения.
Число пациентов, достигших целевого уровня HbA1c.
Оценка безопасности проводилась с помощью регистрации любых побочных эффектов в течение всего периода исследования, в т.ч. частоты гипогликемий. Гипогликемия регистрировалась при уровне глюкозы крови (ГК)≤3,9 ммоль/л и/или развитии клинических симптомов, которые расценивались пациентом как типичные проявления гипогликемии, даже в отсутствие подтверждения данными измерения ГК. Для унификации обработки данных использовалась классификация гипогликемий по ADA – American Diabetes Association [7]. Так, тяжелая гипогликемия – эпизод с потерей сознания или без, потребовавший для купирования помощи третьих лиц (инъекции глюкозы или глюкагона).
Поскольку инсулинотерапия относится к факторам увеличения массы тела преимущественно за счет жировой ткани, оценивалась динамика массы тела и объема талии в течение всего периода наблюдения. Данные показатели имеют значение при оценке соотношения риск–польза наряду с классическими критериями безопасности: общей частотой побочных эффектов и частотой гипогликемий.
В исследование были включены 197 пациентов, средний возраст составил 62,7±9,5 года. Клиническая характеристика пациентов при включении представлена в табл. 1.
Представленные данные свидетельствуют о том, что в программу мониторинга были включены пациенты, у которых имелась декомпенсация СД2 и которым была необходима инициация или интенсификация инсулинотерапии.
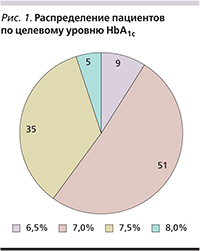
На визите 1 лечащим врачом для каждого пациента был зафиксирован целевой уровень HbA1c, исходя из действующих Алгоритмов специализированной медицинской помощи больным сахарным диабетом [4]. Распределение пациентов по целевому уровню HbA1c представлено на рис. 1.
Как и в общемировой практике, большая часть (86%) пациентов имели целевые значения HbA1c 7,0–7,5%.
Результаты исследования
Динамика основных показателей эффективности в течение 3 месяцев терапии представлена в табл. 2.
Зафиксировано значимое снижение уровней ГН, ППГ, HbA1c, что стало следствием увеличения как суточной дозы инсулина, так и охвата пациентов инсулинотерапией. Последний вырос с 32% на старте исследования до 99% через 3 месяца наблюдения. У 2 (1%) пациентов через 3 месяца наблюдения инсулинотерапия была прекращена в связи с достижением целевого значения HbA1c и стойкой компенсацией гликемии.
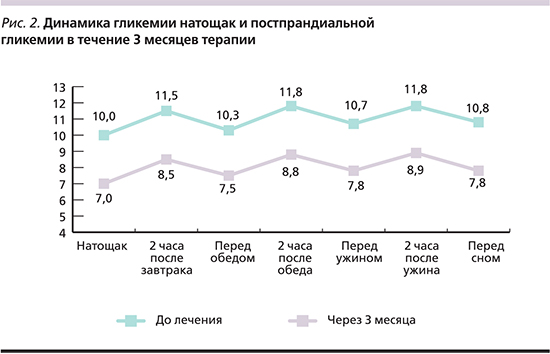
Динамика средних значений ГН и ППГ представлены на рис. 2. Снижение показателей НГ и ППГ в течение суток в ходе наблюдения согласуются с таковой HbA1c.
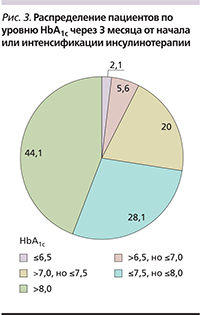
На рис. 3 представлено распределение пациентов по уровню HbA1c на визите 3 через 3 месяца от начала или интенсификации инсулинотерапии. Несмотря на то что 44% пациентов все еще имели уровень HbA1c выше 8,0%, 23% пациентов (табл. 2) достигли целевых значений HbA1c за 3 месяца терапии препаратами инсулина производства РФ Биосулин Р и Биосулин Н.
Данные, представленные в табл. 3, свидетельствуют о том, что инициация или интенсификация инсулинотерапии не повлекла за собой существенных негативных последствий для пациентов данной наблюдательной программы. Отмечено статистически незначимое увеличение массы тела, ИМТ и объема талии пациентов.

Общая частота гипогликемий составила 1 гипогликемию на 1 человека за 3 месяца, т.е. 4 гипогликемии на человека в год. При этом не было зафиксировано ни одной тяжелой гипогликемии, ни одного побочного эффекта и ни одной местной реакции на введение инсулина.
Обсуждение
Несмотря на короткий срок клинического наблюдения и ограничения, накладываемые протоколом и рутинной практикой, прослеживается четкая тенденция снижения гликемии (снижение ГН в среднем на 3 ммоль/л) и HbA1c (снижение HbA1c в среднем на 1,4%) до целевых значений даже за 3 месяца от инициации или интенсификации инсулинотерапии. Клинический эффект отмечен на фоне применения сравнительно низкой суточной дозы инсулина (30,5 МЕ/сут), что позволило избежать значимого набора массы тела и можно говорить о значительной роли обучения пациентов.
Показано, что препараты рекомбинантного инсулина человека Биосулин Р и Биосулин Н могут быть назначены врачами амбулаторно-поликлинического звена без риска тяжелых гипогликемий, местных реакций и побочных эффектов.
Результаты наблюдательной программы подтверждают данные, полученные в ходе клинических исследований и наблюдений, проведенных ранее [8].
Выводы
Мониторинг эффективности и безопасности применения произведенных в РФ препаратов рекомбинантного инсулина человека Биосулин Р и Биосулин Н у больных СД2, проведенный в реальной клинической практике амбулаторно-поликлинических учреждений Москвы в 2014–2015 гг. продемонстрировал, что поэтапная инициация и интенсификация инсулинотерапии позволяют эффективно достигать целевых параметров контроля СД2 при низком риске гипогликемий, побочных эффектов и отсутствии значимого повышения массы тела. Данные результаты были получены в наблюдательной программе при стандартном объеме обследования и экономических затрат на ведение пациента. Исследование позволило еще раз продемонстрировать, что старт и интенсификация инсулинотерапии в условиях, соответствующих рутинной практике врача-эндокринолога амбулаторно-поликлинического звена, являются реальной и выполнимой задачей.



