Острая или хроническая абдоминальная боль – наиболее частая причина обращения больных к гастроэнтерологу. В то же время описание боли пациентом чрезвычайно субъективно и зависит от массы факторов, включая психосоциальные, нейрофизиологические, анатомо-морфологические и др. [1]. Боль — это субъективное ощущение, возникающее вследствие поступления в центральную нервную систему импульсов с периферии. Болевое ощущение – физиологический феномен, информирующий о наличии повреждающих или представляющих потенциальную опасность для организма воздействий. Таким образом, боль входит в комплекс как предупредительных, так и защитных систем организма [2].
По механизму развития выделяют два типа болей: невропатическую (соматопариетальную), обусловленную повреждением рецепторов чувствительных нервных волокон, и висцеральную (ноцицептивную), связанную с активацией рецепторов двух типов волокон: толстых миелизированных (А-8) и составляющих большинство тонких демиелизированных (С). Основная масса болевых рецепторов С-волокон (ноцицепторов) полых органов брюшной полости (пищевод, желудок, кишечник, желчный пузырь, желчные и панкреатические протоки) локализуются в мышечной и серозной оболочках их стенок. Аналогичные рецепторы имеются в капсуле паренхиматозных органов, таких как печень, почки, селезенка, а также в брыжейке и париетальной брюшине, в то время как висцеральная брюшина и большой сальник лишены их. Ноцицепторы участвуют в восприятии механических, химических и термических стимулов с указанных анатомических структур [3]. Выделяют 3 типа ноцицепторов: высокопороговые механорецепторы, воспринимающие сигналы, которые возникают при чрезмерном сокращении или спазме гладкой мускулатуры полого органа; ноцицепторы «интенсивности», способные увеличивать их интенсивность и количество, реагируя на слабые стимулы; «молчащие» ноцицепторы, для активации которых необходимо наличие органического повреждения тканей внутренних органов, включая воспаление, ишемию, некроз и др. [4]. Ноцицепторы обладают определенным порогом чувствительности, при котором стимулы низкого уровня не вызывают их возбуждения. При снижении порога чувствительности ноцицепторов стимулы даже минимального уровня приводят к их активации, формируя гиперчувствительность к боли. Генерированные в ноцицепторах импульсы передаются по аксону нерва в спинной мозг и далее в центральную нервную систему [5]. Висцеральная (ноцицептивная) боль как с наличием, так и с отсутствием органических поражений органов пищеварения возникает при наличии патологических стимулов, связанных с органами брюшной полости, и проводится симпатическими волокнами. Основными пусковыми факторами для ее возникновения являются быстрое повышение давления в полом органе с растяжением его стенки (наиболее частая причина), патология капсулы паренхиматозных органов, натяжение брыжейки, сосудистые нарушения. Алгогены (химические медиаторы), участвующие в ноцицептивной передаче, включают нейротранcмиттеры (норадреналин, серотонин, гистамин, вазоактивный интестинальный полипептид); оксид азота; тахикинины (субстанция Р, нейрокинины А и В); тканевые медиаторы (брадикинин, коллидин); простагландины; ионы водорода; аденозинтрифосфат; молочную кислоту; ионы калия и др.
Соматическая (невропатическая) боль обусловлена наличием патологических процессов в париетальной брюшине и тканях, имеющих окончания чувствительных спинномозговых нервов. Ее возникновение связано с повреждением брюшной стенки и/или брюшины. Помимо двух основных типов абдоминальных болей выделяют также иррадиирующую и психогенную боль. Иррадиирующая боль локализуется в различных областях, удаленных от патологического очага, и передается на участки поверхности тела, имеющие общую корешковую иннервацию с пораженным органом брюшной области. Психогенная боль возникает в отсутствие висцеральных или соматических причин или последние играют роль пускового или предрасполагающего фактора. Характер психогенных болей определяется особенностями личности, влиянием эмоциональных, когнитивных, социальных факторов, психологической стабильностью больного и его прошлым «болевым опытом».

Анализ локализации болей является скрининговым методом, позволяющим с определенной долей вероятности судить о характере патологического процесса в брюшной полости, и только с учетом последующих уточняющих исследований выставляется окончательный диагноз (табл. 1).
Ведущим механизмом в формировании гастроэнтерологических симптомов, включая и висцеральные абдоминальные боли, является гастроинтестинальная дисмоторика. Известно, что моторная функция желудочно-кишечного тракта (ЖКТ) определяется активностью гладкомышечных клеток, которая находится в прямой пропорциональной зависимости от концентрации цитозольного Са2+ [6]. Ионы кальция, активируя внутриклеточные биоэнергетические процессы (фосфорилирование белков, превращение АТФ в цАМФ и др.), способствуют соединению нитей актина и миозина, что обеспечивает сокращение мышечного волокна. Одним из условий, необходимых для сокращения мышечного волокна, является высокая активность фосфодиэстеразы, которая участвует в расщеплении цАМФ и обеспечении энергией процессов соединения актина с миозином. Транспорт ионов кальция через клеточные мембраны осуществляется через специальные каналы, которые представлены макромолекулярными белками, встроенными трансмембранно и содержащими рецепторы, распознающие ионы кальция, т.н. кальциевые, или медленные, каналы. В настоящее время выделяют несколько типов кальциевых каналов, которые различаются по биофизическим свойствам, локализации в тканях и по содержанию дискретных рецепторов для различных групп лекарственных препаратов – антагонистов кальция.
В регуляции транспорта ионов кальция участвует ряд нейрогенных медиаторов: энкефалины, серотонин, ацетилхолин, катехоламины (норадреналин), холецистокинин, мотилин и др. После инициации рецепторного аппарата вагуса регуляторными молекулами и в первую очередь серотонином и энкефалинами происходит выделение ацетилхолина и связывание его с М-холинорецепторами, что приводит к открытию натриевых каналов и вхождению ионов натрия в клетку. Последнее снижает электрический потенциал клеточной мембраны (фаза деполяризации) и инициирует открытие кальциевых каналов, через которые ионы кальция поступают в клетку, вызывая мышечное сокращение. Расслабление мышечного волокна опосредуется медиатором симпатической нервной системы норадреналином, который через активизацию α1-рецепторов наружной мембраны миоцитов приводит к открытию быстрых ионных каналов, утечке положительно заряженных ионов из клетки и ее гиперполяризации. В условиях нарастания мембранного потенциала прекращают функционирование медленные кальциевые каналы, концентрация цитозольного кальция резко падает и наступает релаксация мышечного волокна.
Процесс сокращения мышечного волокна находится под строгим контролем ряда центральных и местных регуляторных механизмов, среди которых наиболее важные адренергическая, серотониновая и опиоидная системы, а также зависит от функционального состояния интерстициальных клеток Кахаля (ИКК). В последнее время в развитии моторных нарушений ЖКТ важная роль придается дисфункции ИКК, которые локализуются на протяжении всего ЖКТ – от пищевода до ануса. Выделено 4 субтипа данных клеток, которые присутствуют в области мышечного (ауэрбаховского) сплетения (ИКК МС), внутримышечной зоне (ИКК ВМ) глубокого внутримышечного сплетения (ИКК ГВС) и в подслизистом (мейснеровском) сплетении (ИКК ПС) и координируют моторику всех слоев мышечной оболочки пищеварительного тракта.
Данные клетки выполняют три основные функции, являющиеся важными компонентами гастроинтестинальной моторики:
- Генерируют потенциалы действия (пейсмейкеры) для формирования медленных перистальтических волн и регуляцию их продвижения в каудальном направлении.
- Выступают в роли механорецепторов.
- Передают сигналы от нервных окончаний к гладкомышечным клеткам [7].
При этом роль пейсмекеров желудка и тонкой кишки выполняют ИКК МС и ИКК ВМ, а толстой кишки – ИКК ПС [8]. Количественные или структурные нарушения ИКК были выявлены при некоторых заболеваниях, таких как ахалазия пищевода, детский гипертрофический пилорический стеноз, хроническая интестинальная псевдообструкция, болезнь Гиршспрунга, воспалительные заболевания кишечника и идиопатический медленнотранзитный запор [7].
В регуляции моторики ЖКТ существенная роль отводится опиоидной системе, включающей опиоидные пептиды (эндорфины, энкефалины) и рецепторы. В ЖКТ выявлено три типа опиоидных рецепторов: дельта (δ), каппа (κ) и мю (µ), которые локализуются на всех типах ИКК, в ганглиях, нейронах энтеральной нервной системы (ЭНС), окончаниях чувствительных нервов и в мембранах гладкомышечных клеток ЖКТ. Связь опиоидных пептидов с соответствующими рецепторами оказывает существенное и разнонаправленное влияние на моторику ЖКТ [10, 11].
Результаты экспериментальных исследований показали, что интестинальные опиоидные δ-, κ- и µ-рецепторы участвуют не только в антиноцицептивных механизмах, но и в модуляции мышечной активности. Было установлено, что активация κ-рецепторов угнетает моторную активность в результате блокады возбуждающих нейронов ЭНС и приводит к существенному анальгезирующему эффекту при висцеральной боли. Опиатные µ- и δ-рецепторы оказывают стимулирующее действие на моторику пищеварительного тракта в результате блокады тормозных нейронов ЭНС. [12, 13]. Также было показано, что энкефалины помимо непосредственного действия через связь с соответствующими рецепторами могут опосредованно ингибировать холинергические нейроны с блокированием продукции ацетилхолина, что приводит к подавлению моторной активности. Но в то же время они способны стимулировать моторику в результате блокады высвобождения вазоактивного интестинального полипептида из межмышечных нервных сплетений ЖКТ.
В регуляции моторики ЖКТ существенную роль играет также серотонин. Выделяют несколько подтипов серотониновых рецепторов (5-МТ1–4), из которых наиболее изученные 5-МТ3 и 5-МТ4. Связывание серотонина с 5-МТ3 способствует расслаблению, а с 5-МТ4 – сокращению мышечного волокна.
В механизмах возникновения висцеральных абдоминальных болей большая роль отводится также висцеральной гиперчувствительности (ВГЧ). Патофизиологический феномен ВГЧ впервые был обнаружен в 1990-е гг. у больных синдромом раздраженного кишечника (СРК). ВГЧ – это повышенная чувствительность к периферическим стимулам (механическим, термическим, химическим и др.), проявляющаяся появлением болевых ощущений, моторных и секреторных нарушений в ответ на допороговые стимулы. Было установлено, что выраженность ВГЧ достоверно коррелировала с симптомами заболевания, а баллоннодилатационный тест оказался высокоспецифичным и чувствительным методом ее исследования [14]. ВГЧ рассматривается в качестве первичного патофизиологического механизма, который обусловливает формирование и интенсивность абдоминальной боли при СРК [15]. В последнее время установлено, что феномен ВГЧ выявляется при висцеральном типе болевого синдрома, возникающего при поражении всех отделов ЖКТ. ВГЧ часто формируется в результате сенсисбилизирующих факторов, таких как перенесенная кишечная инфекция, психоэмоциональный стресс, хронические физические перегрузки, нарушение нормального состава кишечного микробиоценоза. Конкретное значение имеет наследственность, которая определяет реакцию организма на сенсибилизирующий фактор и/или на дальнейшее течение заболевания [16–19].
Клинические проявления ВГЧ связаны с эффектами гипералгезии и аллодинии. В основе гипералгезии лежит снижение порога болевой чувствительности, в результате чего даже подпороговые стимулы вызывают ощущение боли при нормальном пороге ее восприятия. Выделяют первичную гипералгезию, которая формируется на периферии в результате повышения чувствительности ноцицепторов к действию повреждающих стимулов, и вторичную, при которой имеется центральная сенситизация в результате повышения возбудимости ноцицептивных нейронов задних рогов спинного мозга. Аллодиния — боль, возникающая вследствие воздействия раздражителей, обычно ее не вызывающих. В патогенезе ВГЧ ведущую роль отводят нейромедиаторам, в частности серотонину, а также опиоидной системе. Опиоидная система работает по следующей схеме: активация ноцицепторных окончаний приводит к выделению субстанции Р, что вызывает генерацию периферических восходящих и центральных нисходящих ноцицептивных (болевых) импульсов. Последние активизируют выработку эндорфинов и энкефалинов, блокирующих выделение субстанции Р и снижающих болевые ощущения.
При появлении абдоминальной боли включаются механизмы антиноцицепции, в результате которых из ряда структур головного мозга (гиппокампа, ядра мозжечка, некоторых зон серого вещества, миндалевидного тела), входящих в нисходящий антиноцицептивный путь, к задним рогам спинного мозга передаются импульсы, вызывающие торможение нейронов спинного мозга и снижающие интенсивность восприятия боли. Медиаторами антиноцицепции являются опиоидные пептиды, серотонин, норадреналин, действующие на различных уровнях ноцицептивного пути: снижают чувствительность болевых рецепторов, угнетают синаптическую передачу импульса на уровне задних рогов спинного мозга, увеличивают поток импульсов из парагигантоклеточного ретикулярного ядра и периакведуктального серого вещества к большому ядру.
Болевому абдоминальному синдрому, как правило, сопутствует ряд диспепсических нарушений, таких как метеоризм, диарея, запоры и др., но наиболее часто абдоминальные боли ассоциируются с метеоризмом, который наблюдается примерно у 85% лиц с заболеваниями органов пищеварения [20]. В норме в тонкой и толстой кишке содержится менее чем 200 мл газа, при этом его количество после еды не увеличивается. Аналогичное количество газа выявляется и у больных, предъявляющих жалобы на вздутие живота. В то же время в течение суток через прямую кишку выделяется от 470 до 1490 мл (в среднем 705 мл) газа за 8–20 (в среднем 13,6) пассажей [21]. Количество выделяемого газа зависит от состава пищи. Если 50% дневного каллоража пищи покрывается за счет бобовых, растительной клетчатки и свинины, количество газа, проходящего через прямую кишку, увеличивается на 15–176 мл/ч выше нормы, что следует учитывать при назначении диетического питания пациентам с висцеральными болями. Однако основную роль в развитии метеоризма играет наличие избыточного бактериального роста в тонкой кишке и толстокишечного дисбиоза, а также функциональных и реже органических препятствий для отхождения газов. Если в просвете полого органа имеется жидкое содержимое с высоким поверхностным натяжением и избыточное количество газов, то при перемешивании и продвижении данного химуса создаются условия для образования массы пузырьков газа («пены»), что существенно увеличивает его объем и приводит к значительному растяжению органа, повышению внутрипросветного давления и формированию болевого абдоминального синдрома.
Клинические проявления избыточного содержания газа в ЖКТ включают наряду с абдоминальными болями воздушные отрыжки, вздутие живота, избыточное выделение газа per rectum (>30 пассажей в сутки), выявление при физикальном исследовании болезненных урчащих или с наличием «плеска» кишечных петель [22].
Основные направления купирования болевого абдоминального синдрома включают:
- а) этиологическое лечение основного заболевания;
- б) нормализацию моторных расстройств;
- в) восстановление нормального состава кишечной микрофлоры,
- г) снижение висцеральной чувствительности.
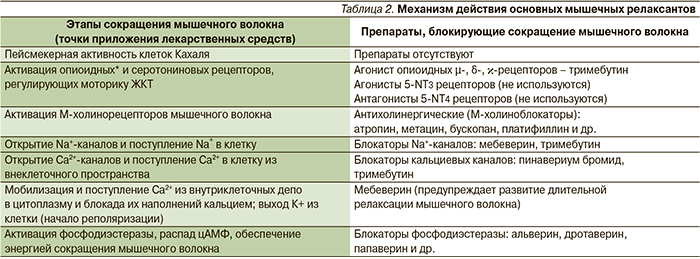
При выборе препарата для нормализации моторики ЖКТ следует учитывать, что ведущая роль в формировании болевого абдоминального синдрома и диспепсических расстройств, таких как запоры, метеоризм, отрыжка, изжога, тошнота, реже – рвота, принадлежит гипермоторной и/или гипертонической дискинезии гладкой мускулатуры. Следовательно, для купирования абдоминальных болей используются релаксанты гладкой мускулатуры, которые включают несколько групп препаратов. Этапы сокращения мышечного волокна и механизмы действия спазмолитических средств представлены в табл. 2.
У значительной части пациентов с наличием абдоминальных болей моторные нарушения носят разнонаправленный характер. При этом наблюдается значительное многообразие сочетаний гипер- и гипокинетических дискинезий в различных отделах пищеварительного тракта, что создает значительные трудности в выборе адекватной терапии, когда для нормализации моторных нарушений в одной зоне требуется спазмолитик, в другой – прокинетик.
К наиболее частым сочетанным нарушениям относятся дуоденостаз со спазмом сфинктера Одди или с СРК с запором, функциональная диспепсия типа постпрандиального дистресс-синдрома с СРК или СРК-подобными нарушениями с диареей. Для купирования сочетанных моторных нарушений перспективно использование препаратов, способных нормализовать моторику независимо от ее исходного состояния и влияющих на висцеральную чувствительность ЖКТ, а также участвующих в антиноцецептивных механизмах контроля боли. В данной ситуации особое место принадлежит тримебутину (Тримедату), обладающему уникальными фармакологическими свойствами. Тримебутин, являясь агонистом периферических µ-, δ- и κ-опиоидных рецепторов, расположенных на ИКК, гладкомышечных клетках и ганглиях ЭНС, в зависимости от исходной функциональной активности миоцитов оказывает спазмолитическое или прокинетическое действие. Так, при гиперкинетических состояниях препарат связывается с κ-рецепторами, блокирует возбуждающие импульсы нейронов ЭНС и угнетает моторику ЖКТ. При гипокинетических нарушениях тримебутин имеет тропность к µ- и δ-рецепторам, что приводит к блокаде тормозных стимулов из нейронов ЭНС и как следствие – к стимуляции моторики органов пищеварения. Отдельно следует упомянуть тропность препарата при гипокинетических состояниях к µ-рецепторам клеток Кахаля, что приводит к активизации собственной «пейсмейкерной» системы кишечника и дополнительно стимулирует его моторику.

Конечным этапом спазмолитического действия препарата является блокада Na+- и Ca2+-каналов гладкомышечных клеток ЖКТ [23–25]. При этом блокируется как вход внеклеточного Са2+ в гладкомышечную клетку через вольтаж-зависимые кальциевые каналы L типа, так и из внутриклеточных депо Са2+. Прокинетическое действие тримебутина обусловлено активацией µ-рецепторов и восстановлением функциональной активности клеток Кахаля, которые генерируют потенциалы физиологического ритма кишечника [11].
Кроме того, тримебутин оказывает обезболивающий эффект за счет как связывания с k-энкефалическими рецепторами, так и местного анестетического действия, что приводит к повышению порога болевой чувствительности и снижению ВГЧ [23, 26].
В терапии висцеральной боли показано курсовое назначение тримебутина по 200 мг 3 раза в сутки за 30 минут до еды в течение 30 и более дней.
Для коррекции состава микрофлоры кишечника используют кишечные антисептики, пре - и пробиотики [27].
Показаниями к назначению кишечных антисептиков:
- а) избыточный бактериальный рост в тонкой кишке;
- б) транслокация кишечных бактерий за пределы кишки;
- в) воспалительные процессы в кишечнике;
- г) выявление условно-патогенной флоры в кишечнике;
- д) отсутствие эффекта от лечения без проведения деконтаминации кишечника.
В этих случаях проводится один или два семидневных курса кишечных антисептиков широкого спектра действия (α-нормикс, фуразолидон, нифуроксазид, ципрофлоксацин и др. в общепринятых дозах) со сменой препарата в очередном курсовом лечении. При транслокации бактерий за пределы кишечника приоритетны всасывающиеся антибактериальные препараты (ципрофлоксацин, фуразолидон, доксициклин и др). Одновременно с антибактериальными препаратами целесообразно назначать пребиотики, препараты, способствующие росту нормальной кишечной микрофлоры. После окончания антибактериальной терапии, а в ряде случаев и одновременно с ней целесообразно принимать пробиотики. Любой пробиотик назначается, как правило, 1–3 раза в сутки в течение 2–8 недель (см. рисунок) [28–30].
Таким образом, тримебутин является универсальным модулятором гастроинтестинальной и билиарной моторики и может быть использован в терапии болевого абдоминального синдрома при СРК и СРК-подобных нарушениях, функциональных расстройствах желчного пузыря и сфинктера Одди билиарного и панкреатического типа, дуоденостазах, а также при гастроэзофагеальной рефлюксной болезни, функциональной диспепсии и послеоперационной паралитической кишечной непроходимости.



